Примеры решения типовых задач. Задача 1. Реакция между веществами А и В протекает по уравнению 2A + B = C; концентрация вещества А равна 6 моль/л
Задача 1. Реакция между веществами А и В протекает по уравнению 2A + B = C; концентрация вещества А равна 6 моль/л, а вещества В - 5 моль/л. Константа скорости реакции равна 0,5 л2моль-2•с –1. Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной смеси останется 45 % вещества В.
Решение. Согласно закону действующих масс скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Следовательно, для уравнения реакции в нашем примере V= K*CA2* CB
Скорость химической реакции в начальный момент равна:
V=0,5. 62 . 5 = 90,0 моль. с-1 . л-1
По истечении некоторого времени в реакционной смеси останется 45 % вещества В, т. е. концентрация вещества В станет равной 5. 0,45= 2,25 моль/л. Значит, концентрация вещества В уменьшилась на 5,0 - 2,25= 2,75 моль/л. Так как вещества А и В взаимодействуют между собой в соотношении 2 : 1, то концентрация вещества А уменьшилась нa 5,5 моль/л (2,75 . 2) и стала равной 0,5 моль/л (6,0 - 5,5). Следовательно, V2 = 0,5(0.5)2 • 2,25 = 0,28 моль. с-1 . л-1.
Ответ: 0,28 моль. с-1 . л-1
Задача 2.Как изменится скорость прямой реакции 2СО + О2 = 2СО2
если общее давление в системе увеличить в 4 раза?
Решение. Увеличение давления в системе в 4 раза вызовет уменьшение объема системы в 4 раза, а концентрация реагирующих веществ возрастет в 4 раза. Это вытекает из газовых законов, в соответствии с которыми, давление прямо пропорционально концентрации газа в объеме.
PV= 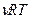 . Так как молярная концентрация вещества См (моль/л) определяется как отношение количества вещества (моль) к объему, то Р =
. Так как молярная концентрация вещества См (моль/л) определяется как отношение количества вещества (моль) к объему, то Р = 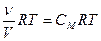 .
.
Согласно закону действующих масс начальная скорость реакции равна V1 = 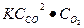 .
.
После увеличения давления в 4 раза, концентрация каждой компоненты вырастит в 4 раза. Тогда V2= k 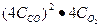 = 43
= 43 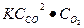 = 64
= 64 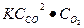 = 64V1
= 64V1
Следовательно, после увеличения давления в 4 раза скорость реакции возросла в 64 раза.
Ответ: скорость реакции возросла в 64 раза.
Задача 3. Константа скорости реакции А + 2В 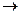 3С равна 0,6 л2 моль-2 с-1. Исходные концентрации веществ А и В составляли по 0,75моль/л. В результате реакции концентрация вещества В оказалось равной 0,5 моль/л. Вычислите, какова концентрация веществ А и С, начальную скорость и скорость прямой реакции, когда концентрация вещества В стала 0,5 моль/л.
3С равна 0,6 л2 моль-2 с-1. Исходные концентрации веществ А и В составляли по 0,75моль/л. В результате реакции концентрация вещества В оказалось равной 0,5 моль/л. Вычислите, какова концентрация веществ А и С, начальную скорость и скорость прямой реакции, когда концентрация вещества В стала 0,5 моль/л.
Решение. Начальную скорость реакции считаем, пользуясь законом действующих масс:
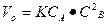 = 0,6
= 0,6 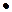 0,75
0,75 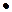 (0,75)2= 0,6
(0,75)2= 0,6 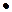 (0,75)3= 0,253 моль
(0,75)3= 0,253 моль 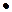 л-1
л-1 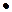 с-1.
с-1.
Допустим, имеем один литр реакционной смеси. Следовательно, в реакционной смеси имеем по 0,75 моль исходных реагентов. Когда концентрация вещества В стала 0,5 моль/л, значит в реакцию вступило 0,75 - 0,5 = 0,25 моль вещества В. Так как вещества А и В реагируют в мольных отношениях 1 : 2, то изменение концентрации вещества А при этом составит 0,5 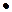 0,25= 0,125 моль. Следовательно, в системе останется 0,75 – 0,125 = 0,625 моль вещества А.
0,25= 0,125 моль. Следовательно, в системе останется 0,75 – 0,125 = 0,625 моль вещества А.
Рассчитаем скорость реакции. V1= 0,6 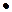 0,625
0,625 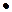 (0,5)2= 0,09375 моль
(0,5)2= 0,09375 моль 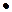 л-1
л-1 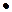 с-1.
с-1.
Вещество С образуется в мольном отношении к веществу А равному 3:1, следовательно при расходе вещества А 0,125 буде образоваться 3 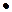 0,125= 0,375 моль вещества С. Так как в начале реакции в реакционной системе отсутствовало вещество С, то его концентрация будет 0,375 моль/л.
0,125= 0,375 моль вещества С. Так как в начале реакции в реакционной системе отсутствовало вещество С, то его концентрация будет 0,375 моль/л.
При сопоставлении значений скорости реакции в начальный момент и после превращения, то окажется, что скорость реакции по ходу уменьшилась в 0,253:0,09375= 2,7 раза. Такая закономерность обусловлена тем, что во времени происходит расходование исходных веществ. А по закону действующих масс, скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам.
Ответ: скорость реакции уменьшилась в 2,7 раза.
Задача 4: На сколько градусов нужно повысить температуру, чтобы скорость реакции возросла в 90 раз? Температурный коэффициент равен 2,7.
Решение: В соответствии с правилом Вант – Гоффа.
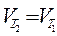
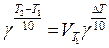 ;
; 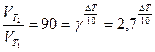 ;
; 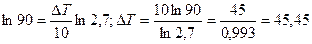
Ответ: Для того, чтобы скорость реакции возросла в 90 раза, необходимо повышать температуру реакционной смеси на 45,450С.
Задача 5: При 100С реакция заканчивается за 95с, а при 200С за 60с. Вычислить энергию активации этой реакции.
Ответ: Чем дольше протекает реакция, тем она медленнее и наоборот. Поэтому, время реакции, 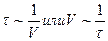 . Скорость реакции при 100С обозначим через V1, а при 200С - V2. Тогда
. Скорость реакции при 100С обозначим через V1, а при 200С - V2. Тогда 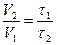 .
.
Взаимосвязь константы скорости реакции с энергией активации определяется уравнением Аррениуса:
К= 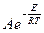 или, как иногда упрощенно пишут К=Аехр(-
или, как иногда упрощенно пишут К=Аехр(- 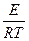 ),
),
где А - предэкспоненциальный множитель, зависит от типа реакции, Е- энергия активации (кДж/моль), также зависит от типа реакции и не зависит от температуры. Таким образом, константа скорости реакции зависит от типа реакции (А и Е) и от температуры (T).
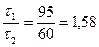
 . С другой стороны
. С другой стороны 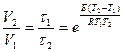 = 1,58.
= 1,58.
ln1,58= 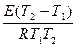 ; E=
; E= 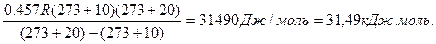
Ответ: 31,49 кДж/моль.
Задача 6: Через некоторое время после начала реакции 3А + В 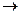 2С +D концентрация веществ А, В и С составляли (моль/л) 0,03; 0,01; 0,008 соответственно. Каковы исходные концентрации веществ А и В?
2С +D концентрация веществ А, В и С составляли (моль/л) 0,03; 0,01; 0,008 соответственно. Каковы исходные концентрации веществ А и В?
Решение: Допустим, что имеем один литр реакционной смеси, в которой в начале реакции отсутствовали вещества С и D. Так как за время реакции образовалось 0,008 моль вещества С, то за это время прореагировало два раза меньше вещества В (в соответствии с уравнением реакции). Таким образом, исходная концентрация вещества В составляла 0,01 + 0,004= 0,014моль/л. Если прореагировало 0,004 моль вещества В, то по уравнению реакции в это же время прореагировало 3 раза больше вещества А, то тесть 0,004  3=0,012 моль. Так как осталось 0,03 моль вещества А, то его начальная концентрация составляла 0,03+ 0,012= 0,042 моль/л.
3=0,012 моль. Так как осталось 0,03 моль вещества А, то его начальная концентрация составляла 0,03+ 0,012= 0,042 моль/л.
Задача 7: Рассчитать константу скорости реакции первого порядка, учитывая, что за 25 мин реакция проходит на 25%.
Решение: Дифференциальное уравнение для реакций первого порядка, а именно реакции, протекающие по схеме: А 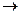 В, имеет вид:
В, имеет вид:
- 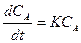 . Знак минус показывает, что рассматриваем процесс уменьшения концентрации вещества А во времени. Преобразуем это дифференциальное уравнение и проинтегрируем в неопределенных условиях:
. Знак минус показывает, что рассматриваем процесс уменьшения концентрации вещества А во времени. Преобразуем это дифференциальное уравнение и проинтегрируем в неопределенных условиях:
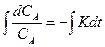 , -lnCA= Kt + соnst. При t=0, соnst =- lnCoA и
, -lnCA= Kt + соnst. При t=0, соnst =- lnCoA и 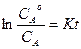 .
.
Отсюда
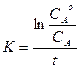 ,
, 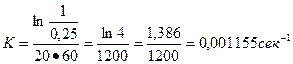 .
.
Ответ: K1 = 1,15 * 10-3 сек-1
Варианты задач по теме 2.1.1
1. Реакция протекает по схеме 2А+3В =С. Концентрация А уменьшилась на 0,1 моль/л. Как при этом изменились концентрации веществ В и С?
2. Начальные концентрации веществ, участвующих в реакции СО+Н2О = СО2 + Н2 были равны (моль/л, слева на право): 0,3; 0,4; 0,4; 0,05. Каковы концентрации всех веществ в момент, когда прореагировала ½ часть от начальной концентрации СО?
3. Начальные концентрации веществ участвующих в реакции N2+3H2 =2NH3, равны (моль/л, слева на право): 0,2; 0,3; 0. Каковы концентрации азота и водорода в момент, когда концентрация аммиака станет равной 0,1 моль/л.
4. Во сколько раз изменится скорость реакции 2А + В 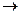 В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 3?
В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 3?
5. Через некоторое время после начала реакции 3А + В 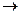 2С +D составляли (моль/л, слева на право): 0,03; 0,01; 0,008. Каковы исходные концентрации веществ А и В?
2С +D составляли (моль/л, слева на право): 0,03; 0,01; 0,008. Каковы исходные концентрации веществ А и В?
6. В системе СО + Сl2 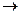 CОCl2 концентрацию СО увеличивали от 0,03 до 0,12 моль/л, а хлора от 0,02 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции?
CОCl2 концентрацию СО увеличивали от 0,03 до 0,12 моль/л, а хлора от 0,02 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции?
7. Начальные концентрации веществ А и В реакции А+2В 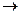 С были 0,03 и 0,05 моль/л соответственно. Константа скорости реакции равна 0,4. Найти начальную скорость реакции и скорость по истечении некоторого времени, когда концентрация вещества А уменьшится на 0,01 моль/л.
С были 0,03 и 0,05 моль/л соответственно. Константа скорости реакции равна 0,4. Найти начальную скорость реакции и скорость по истечении некоторого времени, когда концентрация вещества А уменьшится на 0,01 моль/л.
8. Как изменится скорость реакции 2NO + O2 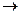 2NO2 , если: а) увеличить давление в системе в 3 раза; б) уменьшить объем системы в 3 раза?
2NO2 , если: а) увеличить давление в системе в 3 раза; б) уменьшить объем системы в 3 раза?
9. Во сколько раз следует увеличить концентрацию вещества В в системе 2А +В 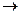 А2В, чтобы при уменьшении концентрации вещества А в 4 раза скорость прямой реакции не изменилась?
А2В, чтобы при уменьшении концентрации вещества А в 4 раза скорость прямой реакции не изменилась?
10. Во сколько раз следует увеличить концентрацию оксида углерода (II) в системе 2СО 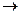 СО2 + С, чтобы скорость реакции увеличилась в 100 раза? Как изменится скорость реакции при увеличении давлении в 5 раза?
СО2 + С, чтобы скорость реакции увеличилась в 100 раза? Как изменится скорость реакции при увеличении давлении в 5 раза?
11. Начальные концентрации веществ в реакции СО + Н2О 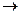 СО2 + Н2 , были равны (моль/л, слева на право): 0,05; 0,06; 0,4 и 0,2. Вычислить концентрации всех веществ после того, как прореагировала 40% воды.
СО2 + Н2 , были равны (моль/л, слева на право): 0,05; 0,06; 0,4 и 0,2. Вычислить концентрации всех веществ после того, как прореагировала 40% воды.
12. При повышении температуры на 600С скорость реакции увеличилась в 4х103 раза. Вычислить 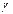 .
.
13. Сколько времени потребуется для завершения реакции при 180 С, если при 900С она завершается за 20 секунд, а 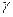 =3,2?
=3,2?
14. При 100С реакция заканчивается за 95с, а при 200С за 60с. Вычислить E активации.
15. Во сколько раз возрастет скорость реакции при повышении температуры с 300 до 500С, если энергия активации равна 125,5 кДж/моль?
16. Каково значение энергии активации реакции, скорость которой при 300К в 10 раз больше, чем при 280 К?
17. Чему равна энергия активации реакции, если при повышении температуры от 290 до 300 К скорость ее увеличится в 2 раза?
18. Энергия активации некоторой реакции равна 100 кДж/моль. Во сколько раз изменится скорость реакции при повышении температуры от 27 до 370С?
19. При 1500С некоторая реакция заканчивается за 16 минут. Принимая температурный коэффициент за 2,5 рассчитать, через какое время закончится эта реакция, если проводить её: а) при 2000 С, б) при 800С?
20. При какой температуре реакция закончится за 45 минут, если при 293 К на это требуется 3 часа? Температурный коэффициент реакции 3,2.
21. Энергия активации реакции NO2 = NO + 1/2O2 равна 103,5 кДж/моль. Константа скорости этой реакции при 298К равна 2,03 х 104 с-1 . Вычислить константу скорости этой реакции при 288 К.
22. При снижении температуры на 200С скорость реакции уменьшилась в 420 раз. Вычислить 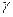 .
.
Химическое равновесие
Теоретические пояснения
Понятие «химическое равновесие» применимо только к обратимым реакциям. Химическим равновесием называют такое состояние реагирующей системы, при котором скорость прямой реакции Vпрямая равна скорости обратной реакции Vобратная . Равенство скоростей прямой и обратной реакций является кинетическим условием химического равновесия.
Химическое равновесие характеризуется постоянным для данных условий соотношением равновесных концентраций всех веществ, участвующих во взаимодействии.
Величина, равная отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ в степенях их стехиометрических коэффициентов, называется константой равновесия. Если в выражении константы равновесия концентрации веществ приведены в моль/л, то такая константа называется Кс. Когда реагирующие вещества находятся в газовой фазе, то можно концентрацию заменить на парциальные давления этих веществ. Константа равновесия, в которой концентрации реагирующих веществ представлены парциальными давлениями этих веществ называется Кр.
Для обратимой реакции Н2(г) + I2(г) 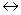 2HI(г) константа равновесия имеет вид:
2HI(г) константа равновесия имеет вид:
KР = 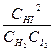
Для обратимой реакции синтеза аммиака N2+3H2 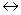 2NH3, константа равновесия имеет вид:
2NH3, константа равновесия имеет вид:
KР = 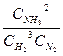
Константа равновесия зависит от природы реагентов, температуры и не зависит от исходной концентрации веществ в системе.
Химическое равновесие остается неизменным до тех пор, пока постоянны параметры, при которых оно установилось. При изменении условий равновесие нарушается. Через некоторое время в системе вновь наступает равновесие, характеризующееся новым равенством скоростей и новыми равновесными концентрациями всех веществ.
Равновесие смещается в ту или иную сторону потому, что изменение условий по-разному влияет на скорости прямой и обратной реакций. Равновесие смещается в сторону той реакции, скорость которой при нарушении равновесия становится больше. Например, если при изменении внешних условий равновесие нарушается так, что скорость прямой реакции становится больше скорости обратной реакции, то равновесие смещается вправо.
В общем случае направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии , оказывать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
