Полярность молекул (типы ковалентных молекул)
Следует отличать полярность молекулы от полярности связи. Для двухатомных молекул типа АВ эти понятия совпадают, как это уже показано на примере молекулы HCl. В таких молекулах чем больше разность электроотрицательностей элементов (∆ЭО), тем больше электрический момент диполя. Например, в ряду HF, HCl, HBr, HI он уменьшается в той же последовательности, как и относительная электроотрицательность.
Молекулы могут быть полярными и неполярными в зависимости от характера распределения электронной плотности молекулы. Полярность молекулы характеризуется значением электрического момента диполя μмол, который равен векторной сумме электрических моментов диполей всех связей и несвязывающих электронных пар, расположенных на гибридных АО: → →
n m
m м-лы = å(mсвязи)i + å(mнесвяз.эл.пары)j.
i=1 j=1
Результат сложения зависит от полярности связей, геометрического строения молекулы, наличия неподеленных электронных пар. Большое влияние на полярность молекулы оказывает её симметрия.
Например, молекула СО2 имеет симметричное линейное строение:


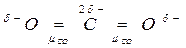 .
.
Поэтому, хотя связи С=О и имеют сильно полярный характер, вследствие взаимной компенсации их электрических моментов диполя молекула СО2 в целом неполярна (m м-лы = åmсвязи = 0). По этой же причине неполярны высокосимметричные тетраэдрические молекулы СН4, СF4, октаэдрическая молекула SF6 и т. д.
В угловой молекуле Н2О полярные связи О–Н располагаются под углом 104,5º: → →
n=2 m=2
mН2О = åmO–H + åmнесвяз.эл.пары ¹ 0.
i=1 j=1
Поэтому их моменты взаимно не компенсируются и молекула оказывается полярной ( 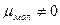 ).
).
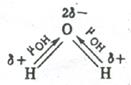


Электрическим моментом диполя обладают также угловая молекула SO2, пирамидальные молекулы NH3, NF3 и т. д. Отсутствие такого момента
свидетельствует о высокосимметричной структуре молекулы, наличие электрического момента диполя – о несимметричности структуры молекулы (табл. 3.2).
Таблица 3.2
Строение и ожидаемая полярность молекул
| Тип | Пространственная конфигурация | Ожидаемая полярность | Примеры |
 | Линейная | Неполярная | 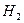 , , 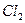 , , 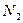 |
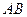 | Линейная | Полярная | 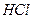 , , 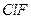 |
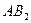 | Линейная | Неполярная | 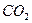 , , 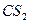 , , 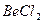 |
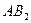 | Угловая | Полярная | 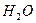 , , 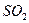 , , 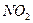 |
 | Линейная | Полярная | 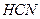 |
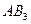 | Плоскотреугольная | Неполярная | 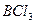 , , 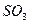 |
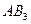 | Тригонально-пирамидальная | Полярная | 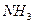 , , 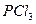 , , 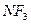 |
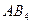 | Тетраэдрическая | Неполярная | 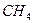 , , 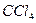 , , 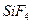 |
На значение электрического момента диполя молекулы сильно влияют несвязывающие электронные пары, расположенные на гибридных орбиталях и имеющие собственный электрический момент диполя 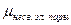 (направление вектора – от ядра, по оси расположения гибридной АО). Например, молекулы NH3 и NF3 имеют одинаковую тригонально-пирамидальную форму, полярность связей N–H и N–F также примерно одинакова. Однако электрический момент диполя NH3 равен 0,49·10-29 Кл·м, а NF3 всего 0,07·10-29 Кл·м. Это объясняется тем, что в NH3 направление электрического момента диполя связывающей N–H и несвязывающей электронной пары совпадает и при векторном сложении обусловливает большой электрический момент диполя. Наоборот, в NF3 моменты связей N–F и электронной пары направлены в противоположные стороны, поэтому при сложении они частично компенсируются (рис. 3.15).
(направление вектора – от ядра, по оси расположения гибридной АО). Например, молекулы NH3 и NF3 имеют одинаковую тригонально-пирамидальную форму, полярность связей N–H и N–F также примерно одинакова. Однако электрический момент диполя NH3 равен 0,49·10-29 Кл·м, а NF3 всего 0,07·10-29 Кл·м. Это объясняется тем, что в NH3 направление электрического момента диполя связывающей N–H и несвязывающей электронной пары совпадает и при векторном сложении обусловливает большой электрический момент диполя. Наоборот, в NF3 моменты связей N–F и электронной пары направлены в противоположные стороны, поэтому при сложении они частично компенсируются (рис. 3.15).

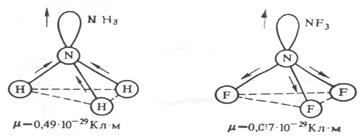
Рис 3.15. Сложение электрических моментов диполя связывающих и несвязывающих электронных пар молекул NH3 и NF3
Неполярную молекулу можно сделать полярной. Для этого её надо поместить в электрическое поле с определенной разностью потенциалов. Под действием электрического поля «центры тяжести» положительных и отрицательных зарядов смещаются и возникает индуцированный или наведенный электрический момент диполя. При снятии поля молекула опять станет неполярной.
Под действием внешнего электрического поля полярная молекула поляризуется, т. е. в ней происходит перераспределение зарядов, и молекула приобретает новое значение электрического момента диполя, становится ещё более полярной. Это может происходить и под влиянием поля, создаваемого приблизившейся полярной молекулой. Способность молекул поляризоваться под действием внешнего электрического поля называют поляризуемостью.
Полярностью и поляризуемостью молекул обусловлено межмолекулярное взаимодействие. С электрическим моментом диполя молекулы связана реакционная способность вещества, его растворимость. Полярные молекулы жидкостей благоприятствуют электролитической диссоциации растворенных в них электролитов.
3.8. Алгоритм выполнения заданий по теме «Химическая связь. Строение молекул»
1. Написать электронные формулы валентных электронов в атомах, входящих в состав молекулы
2. Расположить валентные электроны по квантовым ячейкам в основном или возбужденном состоянии атомов.
3. Определить электроны, участвующие в образовании химических связей (определить валентность атомов элементов).
4. Изобразить перекрывание валентных электронных облаков атомов с учетом возможности их гибридизации и требования их максимального перекрывания. Определить количество, тип связей, механизм их образования.
5. Определить геометрическую форму молекулы (для наглядности изобразить химические связи черточками).
Примечания: а) молекулы общей формулы АВ2 с sp-гибридизацией центрального атома А имеют линейную форму:
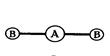 | Угол между связями ВАВ равен 1800. |
б) молекулы общей формулы АВ3 с sp2-гибридизацией центрального атома А имеют форму плоского треугольника:
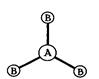 | Угол между связями ВАВ равен 1200. |
в) молекулы общей формулы АВ4 с sp3-гибридизацией центрального атома А имеют форму тетраэдра:
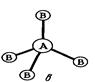 | Угол между связями ВАВ равен 109028`. |
г) молекулы общей формулы АВ3 (или АВ3Е, где Е – несвязывающая электронная пара центрального атома А) с sp3-гибридизацией центрального атома А имеют форму тригональной пирамиды (NH3, NF3 и другие молекулы, образованные аналогами азота):
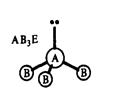 | Угол между связями ВАВ равен 107,3. |
д) молекулы общей формулы АВ2 (или АВ2Е2, где Е – несвязывающая электронная пара центрального атома А) с sp3-гибридизацией центрального атома А имеют форму тригональной пирамиды (H2О, H2S и другие молекулы, образованные аналогами кислорода):
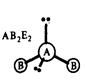 | Угол между связями ВАВ равен 104,50. |
е) пункты а), б), в) касаются строения молекул, рассмотренных с применением теории гибридизации Полинга, пункты г) и д) – теории полной гибридизации Джиллеспи.
6. Определить полярность химических связей на основании расчета разности относительных электроотрицательностей (DЭО) элементов:
а) если DЭО ¹ 0, mсвязи ¹ 0, связь полярна, нужно указать вектор связи mсвязи;
б) если DЭО = 0, mсвязи = 0, связь неполярна и вектор связи mсвязи отсутствует.
7. Определить полярность молекулы (определить электрический момент диполя молекулы mм-лы), используя табл. 3.2:
n → m →
m м-лы = å(mсвязи)i + å(mнесвяз.эл.пары)j.
i=1 j=1
Несвязывающие электронные пары, расположенные на гибридных орбиталях (теория Джиллеспи), имеют собственный электрический момент диполя (направление от ядра центрального атома по оси расположения гибридной АО).
а) если mм-лы = 0, молекула неполярна;
б) если mм-лы ¹ 0, молекула полярна.
Ионная связь
При взаимодействии двух атомов, обладающих весьма различными электроотрицательностями, общая пара электронов может быть практически полностью смещена к атому с большей электроотрицательностью. В результате образуются две заряженные частицы – два иона, между которыми действуют силы электростатического притяжения.
Связь, которая осуществляется в результате образования и электростатического взаимодействия противоположно заряженных ионов, называется ионной.
Например, ионная связь возникает между цезием и фтором, разница ЭО у которых составляет более трёх единиц. К типичным соединениям с ионной связью относятся галогениды щелочных металлов, например CsF, CsCl, NaCl.
Ионная связь характеризуется:
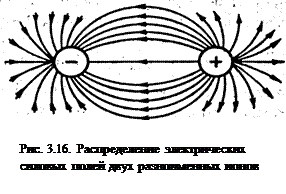
- ненаправленностью, так как электрическое поле иона имеет сферический характер и равноценно во всех направлениях;
- ненасыщаемостью, поскольку при взаимодействии ионов не происходит полной взаимной компенсации их силовых полей (рис. 3.16) и ионы сохраняют способность электростатически взаимодействовать с другими ионами.
Из-за отсутствия у ионной связи направленности и насыщаемости каждый ион окружен ионами противоположного знака, число которых определяется размерами и силой отталкивания одноименно заряженных ионов. Поэтому соединения с ионной связью представляют собой кристаллические вещества. Весь кристалл можно рассматривать как единую гигантскую молекулу, состоящую из очень большого числа ионов. Лишь при высоких температурах, когда вещество переходит в газообразное состояние, ионные соединения могут существовать в виде неассоциированных молекул.
 Теория ионной связи разработана в 1916 г. немецким ученым В. Косселем. Согласно этой теории, устойчивой конфигурацией является оболочка инертного газа s2p6. Все атомы, участвующие в химическом взаимодействии, стремятся приобрести устойчивую оболочку инертного газа. При этом атомы металлов отдают свои валентные электроны, приобретая оболочку предыдущего инертного газа и положительный заряд. Атомы неметаллов принимают электроны, приобретая оболочку последующего инертного газа и отрицательный заряд. Например:
Теория ионной связи разработана в 1916 г. немецким ученым В. Косселем. Согласно этой теории, устойчивой конфигурацией является оболочка инертного газа s2p6. Все атомы, участвующие в химическом взаимодействии, стремятся приобрести устойчивую оболочку инертного газа. При этом атомы металлов отдают свои валентные электроны, приобретая оболочку предыдущего инертного газа и положительный заряд. Атомы неметаллов принимают электроны, приобретая оболочку последующего инертного газа и отрицательный заряд. Например:

 К 3s23p64s1 – 1eˉ K+ 3s23p6;
К 3s23p64s1 – 1eˉ K+ 3s23p6;
F 2s22p5 + 1eˉ F  2s22p6.
2s22p6.
Полного перехода электрона от одного атома к другому в действительности не происходит даже в типичных ионных соединениях – галогенидах щелочных металлов. Например, в кристалле NaCl эффективный отрицательный заряд атома хлора составляет лишь 0,94 заряда электрона; таким же по абсолютной величине положительным зарядом обладает и атом натрия. Нельзя провести точную границу между ионной связью и ковалентной полярной связью, можно оценивать только степень ионности связи, которая количественно характеризуется эффективными зарядами атомов (d) в молекуле. Можно сказать, что ионная связь является предельным случаем ковалентной полярной связи, для которой эффективный заряд атомов по абсолютной величине близок к единице. Принято считать связь ионной, если разность электроотрицательностей атомов (DЭО) больше 1,9 или ½d½>0,5. Таким образом, природа химической связи едина и существующее различие между видами связей имеет количественный характер.
Свойства ионов:
1.Ионы обладают поляризующим действием – способностью деформировать, смещать электронную оболочку соседнего иона. В большей степени этим свойством обладают катионы. Поляризующее действие зависит, во-первых, от заряда и радиуса иона: чем больше заряд и меньше радиус иона, тем сильнее его поляризующее действие. Например:
а) Pb0 Pb2+ Pb4+
r, Å 1,74 1,32 0,84
-------------------------------------->
поляризующее действие усиливается;
б) Li+ Na+ K+ Rb+ Cs+
---------------------------------------------------------->
радиус ионов увеличивается, поляризующее действие уменьшается.
Во-вторых, чем больше электронов имеет катион металла на внешнем энергетическом уровне, тем больше его поляризующее действие.
Например, в ряду: Ca2+(8eˉ), Fe2+(14eˉ), Zn2+(18eˉ)1 поляризующее действие ионов усиливается.
2. Поляризуемость – это способность иона деформироваться под действием электрического поля соседнего иона. У ионов с одинаковым зарядом и одинаковым строением внешней электронной оболочки поляризуемость возрастает с увеличением размеров ионов. Например:
а) Li+ Na+ K+ Rb+ Cs+
---------------------------------------------------------->
радиус ионов увеличивается, поляризуемость возрастает;
б) F- Cl- Br- I-
---------------------------------------------------------->
радиус ионов увеличивается, поляризуемость возрастает.
Легче поляризуются отрицательно заряженные ионы (анионы). Их размеры по сравнению с атомами возрастают, отталкивание между электронами увеличивается и поляризуемость возрастает. В первом приближении можно считать, что деформации подвергается только внешняя электронная оболочка иона.
Металлическая связь
Само название «металлическая связь» указывает, что речь пойдет о внутренней структуре металлов.
Атомы большинства металлов на внешнем энергетическом уровне содержат небольшое число валентных электронов по сравнению с общим числом внешних энергетически близких орбиталей, а валентные электроны из-за небольшой энергии ионизации слабо удерживаются в атоме. Поэтому энергетически более выгодно, чтобы электроны не были локализованы, а принадлежали всему металлу. Так, по одному электрону содержат 16 элементов, по два – 58, по три – 4 элемента и ни одного — только один Pd. Лишь атомы элементов Sn и Pb имеют на внешнем уровне по 4 электрона, Sb и Bi – по 5 и Ро – 6. Но эти элементы не являются характерными металлами.
Элементы – металлы образуют простые вещества. В обычных условиях это кристаллические вещества (кроме ртути). Согласно теории «свободных электронов» в узлах решётки металла находятся положительно заряженные ионы, которые погружены в электронный «газ», распределённый по всему металлу, из нелокализованных валентных электронов. Между положительно заряженными ионами металла и нелокализованными электронами существует электростатическое взаимодействие, обеспечивающее устойчивость вещества.
На рис. 3.17 представлена схема кристаллической решетки металла натрия. В ней каждый атом натрия окружен восемью соседними атомами. На примере этого вещества рассмотрим металлическую связь.
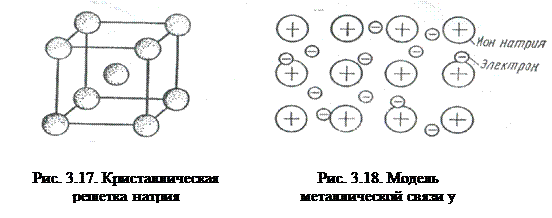 У атома натрия, как и у всех металлов, имеется избыток валентных орбиталей и недостаток электронов. Так, его валентный электрон (3s1) может занимать одну из 9 свободных орбиталей: 3s (одна), Зр (три) и 3d (пять). При сближении атомов, в результате образования кристаллической решетки валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно движутся из одной орбитали в другую, осуществляя связь между всеми атомами кристалла металла (рис. 3.18).
У атома натрия, как и у всех металлов, имеется избыток валентных орбиталей и недостаток электронов. Так, его валентный электрон (3s1) может занимать одну из 9 свободных орбиталей: 3s (одна), Зр (три) и 3d (пять). При сближении атомов, в результате образования кристаллической решетки валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно движутся из одной орбитали в другую, осуществляя связь между всеми атомами кристалла металла (рис. 3.18).
Таким образом, металлическая связь – это сильно нелокализованная химическая связь, возникающая в том случае, когда атомы имеют мало валентных электронов по сравнению с количеством свободных валентных орбиталей, а валентные электроны из-за малой энергии ионизации слабо удерживаются ядром.
Металлическая связь имеет некоторое сходство с ковалентной, поскольку основана на обобщении валентных электронов. Однако при ковалентной связи обобщены валентные электроны только двух соседних атомов, в то время как при металлической связи в обобществлении этих электронов принимают участие все атомы. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической — пластичны; в последнем случае возможно взаимное смещение ионов и электронов без нарушения связи. Это говорит о нелокализованности (отсутствии направленности) металлической связи. Наличие электронов, которые могут свободно перемещаться по объему кристалла, обеспечивает высокую электрическую проводимость и теплопроводность, а также ковкость. Металлический блеск обусловлен отражением световых лучей от электронного газа, который несколько выходит за границу положительно заряженных ионов. Именно металлической связью объясняются физические свойства металлов.
Металлическая связь характерна для металлов, находящихся в твердом и жидком состоянии. Это свойство агрегатов атомов, расположенных в непосредственной близости друг к другу. Однако в парообразном состоянии атомы металлов, как и всех веществ, связаны между собой ковалентной связью. Пары´ металлов состоят из отдельных молекул (одноатомных и двухатомных). Прочность связи в кристалле больше, чем в молекуле металла, поэтому процесс образования металлического кристалла протекает с выделением энергии.
