Т е м а: Электропроводность растворов
Примеры решения задач
Задача 1. Раствор хлорида калия с концентрацией, равной 0,2 моль/л, имеет при 298 К молярную электропроводность 1,24×10–2 Ом–1м2моль–1. Рассчитайте удельную электропроводность этого раствора.
Решение
Удельная и молярная электропроводности связаны соотношением
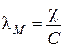 ,
,
где 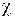 - удельная электропроводность, Ом–1м–1,
- удельная электропроводность, Ом–1м–1,
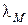 - молярная электропроводность, Ом–1м2моль–1,
- молярная электропроводность, Ом–1м2моль–1,
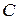 - концентрация раствора, моль/м3.
- концентрация раствора, моль/м3.
Выразив концентрацию в моль/м3 , найдем c:
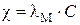 = 1,24×10–2×0,2×103 = 2,48 Ом–1м–1.
= 1,24×10–2×0,2×103 = 2,48 Ом–1м–1.
Задача 2. Рассчитайте молярную электропроводность уксусной кислоты при бесконечном разведении, если молярные электропроводности при бесконечном разведении соляной кислоты, ацетата натрия и хлорида натрия соответственно равны 426,1×10–4; 91,0×10–4 и 126,4×10–4 Ом–1м2моль–1.
Решение
Согласно закону Кольрауша, молярная электропроводность при бесконечном разведении ( 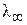 ) равна сумме подвижностей аниона и катиона, входящих в состав электролита:
) равна сумме подвижностей аниона и катиона, входящих в состав электролита:
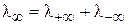
следовательно,
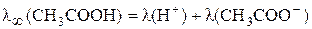 .
.
Таким же образом можно представить данные в задаче молярные электропроводности при бесконечном разведении:
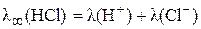 ;
;
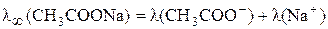 ;
;
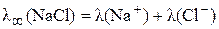 .
.
Выразим из этих уравнений подвижности иона водорода, ацетат–иона и подставим их в выражение для 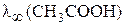 :
:
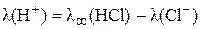 ;
;
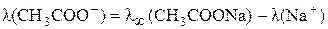 ;
;
Тогда
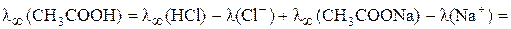
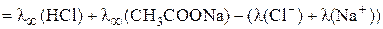 =
= 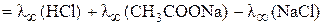 =
=
= 426,1×10–4 + 91,0×10–4 – 126,4×10–4 = 390,7×10–4 Ом–1м2моль–1.
Задача 3. Удельная электропроводность 0,1 н раствора СН3СООН равна 0,16 Ом–1м–1, а молярная электропроводность при бесконечном разведении равна 390,7×10–4 Ом–1м2моль–1. Найдите степень и константу диссоциации уксусной кислоты.
Решение
Вычислим молярную электропроводность раствора уксусной кислоты при данной концентрации:
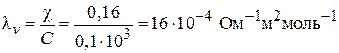 .
.
Степень диссоциации СН3СООН равна:
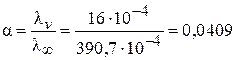 .
.
Константу диссоциации можно найти по закону Оствальда:
Кдисс = 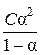
В данном случае концентрацию следует выражать в моль/л.
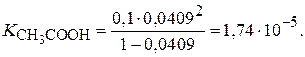
Вопросы и задания
1. Растворы, как и металлы, обладают способностью проводить электрический ток. Объясните, что является носителем электричества в металлах и растворах.
2. К проводникам какого рода относятся расплавы и растворы солей?
3. От каких факторов зависит электропроводность растворов?
4. Объясните суть метода, применяемого для определения электропроводности растворов электролитов.
5. Что такое электропроводность проводника? Как она связана с сопротивлением и в каких единицах измеряется?
6. Для каких расчетов используется величина постоянной сосуда и как она определяется экспериментально?
7. Что называется удельной электропроводностью раствора и как она определяется?
8. Объясните зависимость удельной электропроводности сильных и слабых электролитов от концентрации и представьте ее графически.
9. Что называется молярной электропроводностью? Как можно ее определить?
10. Объясните, как изменяется молярная электропроводность с разведением. Одинаковы ли эти изменения для слабых и сильных электролитов?
11. Напишите и поясните математическое выражение закона Кольрауша.
12. Что понимают под абсолютной скоростью движения иона и как она определяется? Объясните разницу между абсолютной скоростью движения ионов и их подвижностью.
13. Для каких целей используется измерение электропроводности растворов?
14. Объясните сущность и практическое значение метода кондуктометрического титрования.
15. Укажите значение измерения электропроводности в биологических системах.
16. Каким образом используется явление электропроводности для диагностических исследований и физиотерапевтического лечения?
17. Каковы размерности удельной и молярной электропроводности?
18. Как определяют молярную электропроводность слабых электролитов при бесконечном разведении?
19. Объясните вид кривой кондуктометрического титрования сильной кислоты сильным основанием.
20. Как рассчитывают степень диссоциации слабого электролита по данным об электропроводности его растворов?
21. Как определяют молярную электропроводность сильных электролитов при бесконечном разведении?
22. Можно ли вычислить константу электролитической диссоциации по величине электропроводности?
23. Объясните принцип кондуктометрического титрования.
24. Можно ли измерить экспериментально электропроводность раствора?
25. Удельная электропроводность клеток находится в пределах 10–3 - 10–9 Ом–1м–1, а межклеточной жидкости больше 10–3 Ом–1м–1. Объясните причину такого различия.
26. Объясните вид кривой кондуктометрического титрования слабой кислоты сильным основанием.
27. Можно ли по величине электропроводности определить концентрацию ионов в растворе?
28. При кислотно–основном титровании желудочного сока в присутствии индикатора определение точки эквивалентности затруднено из–за мутности раствора. Предложите другие методы определения точки эквивалентности.
29. В каких единицах измеряются абсолютная скорость движения иона и его подвижность?
30. Как, используя электропроводность раствора слабого электролита, определить степень и константу электролитической диссоциации растворенного вещества?
31. Объясните причины различия подвижностей ионов H+, Na+.
32. Как влияет температура на электропроводность растворов и металлов?
33. Вычислите постоянную электродного сосуда, если сопротивление 0,02 н раствора KCl при температуре 20°С равно 300 Ом, а удельная электропроводность 0,25 Ом–1м–1. (75 м–1)
34. Вычислите постоянную электродного сосуда, если сопротивление 0,02 н раствора KCl при температуре 16°С равно 300 Ом, а удельная электропроводность 0,229 Ом–1м–1. (68,9 м–1)
35. Вычислите константу диссоциации уксусной кислоты, если степень диссоциации ее в растворе с концентрацией 0,001 М равна 0,125. (1,79 10–5)
36. Сопротивление кровяной сыворотки, измеренное в сосуде с постоянной, равной 99,86 м–1, при 25 °С составляет 100 Ом. Определите удельную электропроводность сыворотки. (0,9986 Ом–1м–1)
37. Удельная электропроводность раствора бензойной кислоты равна 2,1×10–2 Ом–1м–1. Определите концентрацию раствора, если степень диссоциации бензойной кислоты равна 0,3. Молярная электропроводность при бесконечном разведении составляет 369,9×10–4 Ом–1м2моль–1. (1,89 моль/м3)
38. Подвижность ионов NH4+ равна 64×10–4 Ом–1м2моль–1, а ионов ОH–- 174×10–4 Ом–1м2моль–1. Рассчитайте удельную электропроводность 0,1 н раствора NH4ОH, степень диссоциации которого 0,01. (0,0238 Ом–1м–1)
39. Будут ли отличаться значения удельной и эквивалентной электропроводности для 0,01 М растворов: а) HCl и KCl, б) CH3COOH и CH3COOK?
40. Молярные электропроводности при бесконечном разведении NaCl, NaOH и КОН равны соответственно 109×10–4; 217,5×10–4 и 238×10–4 Ом–1м2моль–1. Найдите подвижности ионов Na+ и Cl–, если подвижность ионов К+ равна 64,6×10–4 Ом–1м2моль–1. (44,1×10–4 Ом–1м2моль–1; 64,51×10–4 Ом–1м2моль–1)
41. Удельная электропроводность 0,001 н раствора KNO3 равна 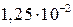 Ом–1м–1, подвижности ионов К+ и NO3–- соответственно 64,6×10–4 и 62×10–4 Ом–1м2моль–1. Определите молярную электропроводность раствора и кажущуюся степень диссоциации KNO3. (0,0125 Ом–1м2моль–1; 0,987)
Ом–1м–1, подвижности ионов К+ и NO3–- соответственно 64,6×10–4 и 62×10–4 Ом–1м2моль–1. Определите молярную электропроводность раствора и кажущуюся степень диссоциации KNO3. (0,0125 Ом–1м2моль–1; 0,987)
42. Удельная электропроводность 0,0001 н полностью диссоциированного раствора KCl равна 1,3×10–3 Ом–1м–1, подвижность ионов К+ –
64,6×10–4 Ом–1м2моль–1. Вычислите абсолютную скорость движения ионов Cl–. (6,78·10–8 м2В–1с–1)
43. Удельная электропроводность 0,5 н раствора одноосновной слабой кислоты при 25°С равна 0,09 Ом–1м–1. Молярная электропроводность при бесконечном разведении составляет 345×10–4 Ом–1м2моль–1. Вычислите степень диссоциации и константу диссоциации. (0,0052; 1,36·10–5)
44. При 18°С абсолютная скорость движения ионов цезия и хлора соответственно равна 6,98×10–8 и 6,76×10–8 м2с–1В–1. Удельная электропропроводность хлорида цезия при разведении 1000 л/моль составляет 1,306×10–2 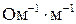 . Вычислите кажущуюся степень диссоциации этой соли в данном растворе. (0,98)
. Вычислите кажущуюся степень диссоциации этой соли в данном растворе. (0,98)
45. При 25 °С константа диссоциации угольной кислоты по I ступени равна 4,5×10–7 моль/л. Подвижность ионов Н+ и НСО3–при этой температуре - соответственно 349,8×10–4 и 44,5×10–4 Ом–1м2моль–1. Молярная электропроводность раствора некоторой концентрации равна 2,6×10–4 Ом–1м2моль–1. Рассчитайте концентрацию кислоты. (1,035·10–2 моль/л)
46. При титровании 100 мл соляной кислоты раствором гидроксида натрия концентрации 1,045 н получены следующие значения электропроводности:
| Объем NaOH, мл | ||||||
| c×102, Ом–1м–1 | 3,90 | 2,84 | 1,77 | 1,24 | 2,07 | 2,94 |
Определите концентрацию кислоты в моль/л.
47. Удельная электропроводность 0,05 н раствора уксусной кислоты при 18 °С равна 3,24×10–2 Ом–1м–1. Молярная электропроводность при бесконечном разведении ацетата натрия составляет 77,5×10–4 Ом–1м2моль–1, а подвижность ионов натрия и водорода – соответственно 43,5×10–4 и 315×10–4 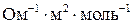 . Вычислите концентрацию ионов водорода в этом растворе и константу диссоциации уксусной кислоты. (9,28·10–4моль/л; 1,76·10–5)
. Вычислите концентрацию ионов водорода в этом растворе и константу диссоциации уксусной кислоты. (9,28·10–4моль/л; 1,76·10–5)
48. Найдите концентрацию раствора электролита, если степень диссоциации равна 0,6, а константа диссоциации - 9×10–3. (0,01 моль/л)
49. Сопротивление 0,1 н раствора AgNO3 при 25 °С равно 1090 Ом, сопротивление 0,02 н KCl в том же сосуде при тех же условиях - 4318 Ом, а удельная электропроводность его составляет 0,277 Ом–1м–1. Вычислите удельную и молярную электропроводности раствора AgNO3. (1,097 Ом–1м–1; 109,7·10–4 Ом–1м2моль–1)
50. Раствор, содержащий 16 г CuSO4 в 1 л, находится между двумя электродами с S=4 см2 на расстоянии 0,7 см. Сопротивление раствора равно 23 Ом. Найдите удельную и молярную электропроводности раствора сульфата меди. (0,76 Ом–1м–1; 76,1·10–4 Ом–1м2моль–1)
51. При титровании 100 мл маринадной заливки 0,5н раствором NaOH получены следующие данные:
| Объем NaOH, мл | 8,0 | 9,0 | 10,0 | 11,0 | 13,0 | 13,5 | 14 ,0 |
| R, Ом | 75,0 | 71,4 | 68,9 | 66,6 | 62,5 | 55,6 | 41,6 |
Определите нормальную концентрацию уксусной кислоты в заливке.
52. Удельная электропроводность 0,01 н СH3СООH при 25 °С равна 1,56×10–2 Ом–1м–1. Молярная электропроводность при бесконечном разведении составляет 390,7×10–4 Ом–1м2моль–1. Вычислите pH раствора. (3,4)
53. Рассчитайте молярную электропроводность гидроксида аммония при бесконечном разведении, если молярные электропроводности при бесконечном разведении гидроксида натрия, хлорида аммония и хлорида натрия соответственно равны 248,4×10–4, 149,85×10–4 и 126,4×10–4 Ом–1м2моль–1. (271,85·10–4 Ом–1м2моль–1)
54. Удельная электропроводность 0,06 н раствора уксусной кислоты при 25 °С равна 3,97×10–2 Ом–1м–1. Молярная электропроводность при бесконечном разведении ацетата натрия составляет 91×10–4 Ом–1м2моль–1, а подвижность ионов натрия и водорода - соответственно 50,1×10–4 и 349,8×10–4 Ом–1м2моль–1. Вычислить концентрацию ионов водорода в этом растворе и константу диссоциации уксусной кислоты. (1,02·10–3 моль/л; 1,73·10–5)
55. Рассчитайте концентрацию KCl в растворе, если удельная электропроводность раствора равна 0,277 Ом–1м–1, а молярная электропроводность - 136,3×10–4 Ом–1м2моль–1. (0,02 моль/л)
56. Определите степень электролитической диссоциации муравьиной кислоты в растворе с концентрацией 0,05 н, а также молярную электропроводность при 25 °С, если константа диссоциации муравьиной кислоты 1,77×10–4, а подвижности ионов Н+ и НСОО– равны соответственно 349,8×10–4 и 54,6×10–4 Ом–1м2моль–1. (0,06; 24,26·10 –4 Ом–1м2моль–1)
57. Для определения концентрации щавелевой кислоты в отбеливателе используют зависимость удельной электропроводности (c) от концентрации (C) кислоты в растворе:
| C, моль/л | 0,004 | 0,007 | 0,015 | 0,030 | 0,060 | 0,121 | 0,243 |
| χ×102, Ом–1м–1 | 2,5 | 3,8 | 5,00 | 8,00 | 12,3 | 21,00 | 36,3 |
Постройте график в координатах lg(c) - f(lgC) и определите концентрацию раствора, если удельная электропроводность его равна 14,4×10–2 Ом–1м–1.
58. В сосуд для измерения электропроводности помещены круглые платиновые электроды диаметром 1,34 см, расстояние между ними 1,72 см. Сосуд заполнен 0,05 н раствором NaNO3. При напряжении 0,5 В через раствор проходит ток силой 1,85 мА. Рассчитайте удельную и молярную электропроводности раствора. (0,45 Ом–1м–1; 90,0·10–4 Ом–1м2моль–1)
59. Таблетки ацидин – пепсина при введении в желудок легко гидролизуются, выделяя свободную соляную кислоту. При титровании 25 мл раствора, полученного при гидролизе 0,25 н раствором гидроксида калия, были получены следующие результаты:
| Объем КOH, мл | 3,2 | 6,1 | 9,2 | 15,4 | 20,1 | 23,4 |
| c×102, Ом–1м–1 | 3,28 | 2,56 | 1,85 | 1,64 | 2,40 | 2,96 |
Определите концентрацию соляной кислоты в моль/л.
60. При 25°С молярные электропроводности при бесконечном разведении растворов хлорацетата натрия, хлорида натрия и соляной кислоты соответственно равны 90×10–4; 126,4×10–4 и 426×10–4 Ом–1м2моль–1. Вычислите значение молярной электропроводности при бесконечном разведении раствора хлоруксусной кислоты. (389,6·10–4 Ом–1м2моль–1)
61. При кондуктометрическом титровании 25 мл раствора пепсина 0,1 М раствором гидроксида калия были получены следующие результаты:
| VКОH, мл | 3,2 | 6,0 | 9,2 | 15,6 | 20,0 | 23,5 |
| c×102, Ом–1м–1 | 3,20 | 2,56 | 1,86 | 1,64 | 2,38 | 2,96 |
Определите концентрацию пепсина в моль/л.
62. Абсолютные скорости движения ионов цезия и хлора при 25 °С равны 6,98×10–8 и 6,76×10–8 м2/с×В. Удельная электропроводность хлорида цезия при разбавлении 500 л/моль составляет 2,612×10–2 Ом–1м–1. Вычислите степень диссоциации хлорида цезия в данном растворе. (0,985)
63. Сопротивление водной вытяжки озоленного образца сыра, содержащего поваренную соль, в ячейке с электродами площадью 2,54 см2 и расстоянием между ними 0,65 см равно 5,61 Ом. Определите процентное содержание поваренной соли в сыре, если молярная электропроводность раствора – 79,7×10–4 Ом–1м2моль–1, а плотность раствора - 1,01 г/см3. (3,3%)
64. Для раствора иодата калия с концентрацией, равной 1,83×10–4 моль/л, молярная электропроводность равна 113,07×10–4 Ом–1м2моль–1. Найдите удельную электропроводность этого раствора. (20,7·10–4 Ом–1м–1)
65. Определите степень и константу электролитической диссоциации 0,01 н раствора уксусной кислоты, молярная электропроводность которого при 18 °С равна 14,3×10–4 Ом–1м2моль–1. Молярная электропроводность при бесконечном разведении – 349×10–4 Ом–1м2моль–1. (0,041; 1,75·10–5)
66. Вычислите pH 0,1 н раствора NH4OH, если молярная электропроводность равна 4×10–4 Ом–1м2моль–1, а молярная электропроводность при бесконечном разведении 272,2×10–4 Ом–1м2моль–1. (11,17)
67. Постоянная сосуда для определения сопротивления растворов равна 426,4 м–1. Вычислите сопротивление 0,2 н раствора нитрата калия, измеренное в этом сосуде при 18 °С. Молярная электропроводность этого раствора равна 98,7×10–4 Ом–1м2моль–1. (216 Ом)
68. Подвижности ионов H+ и ОН– при бесконечном разведении равны соответственно 349,8×10–4 и 198,5×10–4 Ом–1м2моль–1. Вычислите абсолютные скорости движения ионов H+ и ОH–. (36,2·10–8 м2В–1с–1; 20,57·10–8 м2В–1с–1)
69. Удельная электропроводность 0,03 н СH3СООH при 25 °С равна 2,81×10–2 Ом–1м–1. Молярная электропроводность при бесконечном разведении равна 390,7×10–4 Ом–1м2моль–1. Вычислите pH этого раствора. (3,14)
70. Вычислите степень и константу электролитической диссоциации 0,05 н раствора уксусной кислоты, удельная электропроводность которого при 18 °С равна 3,25×10–2 Ом–1м–1. Подвижности ионов СН3СОО– и Н+ при данной температуре равны соответственно 34×10–4 и 315×10–4 Ом–1м2моль–1. (0,0186; 1,73·10–5)
71. Кажущаяся степень диссоциации NH4OH при концентрации водного раствора 0,5 н равна 0,0482, а удельная электропроводность 0,655 Ом–1м–1. Определите молярную электропроводность гидроксида аммония при бесконечном разведении. (271,8·10–4 Ом–1м2моль–1)
72. Сопротивление 0,1 М раствора хлорида калия равно 35,2 Ом. Измеренное в том же сосуде сопротивление 0,1 М раствора AgNO3 составило 42,4 Ом. Рассчитайте удельную и молярную электропроводности раствора AgNO3, если для раствора KСl величина удельной электропроводности равна 1,29 Ом–1м–1. (1,071 Ом–1м–1; 107,1·10–4 Ом–1м2моль–1)
73. Константа диссоциации азотистой кислоты при 12,5 °С равна 4,6×10–4. Вычислите степень электролитической диссоциации 0,05 н раствора азотистой кислоты. (0,096)
74. Сопротивление 0,307 н раствора нитрата серебра при 18 °С равно 404,3 Ом. Измеренное в том же сосуде, сопротивление 0,02 н раствора хлорида калия составило 4318 Ом, а его удельная электропроводность - 0,239 Ом–1м–1. Вычислите удельную и молярную электропроводности раствора нитрата серебра. (2,55 Ом–1м–1; 83,15·10–4 Ом–1м2моль–1)
75. При 25°С константа диссоциации масляной кислоты равна 1,5×10–5. Молярная электропроводность раствора этой кислоты при концентрации 15,6×10–3 моль/л составляет 11,6×10–4 Ом–1м2моль–1. Вычислите значение молярной электропроводности при бесконечном разведении масляной кислоты. (374,2·10–4 Ом–1м2моль–1)
76. Препарат "Бетацид" легко гидролизуется с выделением свободной соляной кислоты. При анализе препарата концентрация кислоты определяется кондуктометрическим титрованием. При титровании 50 мл раствора препарата раствором 0,5 н КОН получены следующие данные:
| Объем KOH, мл | 3,0 | 6,4 | 9,0 | 17,0 | 20,5 | 25,0 |
| c×102, Ом–1м–1 | 3,65 | 2,75 | 2,05 | 1,70 | 2,55 | 3,65 |
Определите концентрацию соляной кислоты в моль/л.
77. Вычислите постоянную электродного сосуда, если сопротивление 0,02 н раствора некоторого электролита при температуре 25 °С равно 350 Ом, а удельная электропроводность — 0,2765 Ом–1м–1. (96,77 м–1)
78. Вычислите постоянную электродного сосуда, если сопротивление 0,02 н раствора KCl при температуре 22 °С равно 300 Ом, а удельная электропроводность — 0,2606 Ом–1м–1. (78,18 м–1)
79. Кажущаяся степень диссоциации хлорида лития при 25 °С в 0,01 н растворе составляет 94%. Молярная электропроводность хлорида лития при бесконечном разведении равна 115×10–4 Ом–1м2моль–1. Вычислите удельную электропроводность данного раствора. (0,1081 Ом–1м–1)
80. Подвижности ионов Na+ , Rb+ и Cl–равны соответственно 50,1×10–4; 77,8×10–4 и 76,3×10–4 Ом–1м2моль–1. Объясните причины различия молярных электропроводностей при бесконечном разведении растворов хлорида натрия и хлорида рубидия.
81. Предельные значения эквивалентной электропроводности ионов Na+, Fe2+, Cl–, SO42–соответственно равны: 50,1·10–4; 53,5·10–4; 76,35·10–4 и 80,0·10–4 Ом–1м2моль–1. Расположите в порядке возрастания значения предельной эквивалентной электропроводности водных растворов хлоридов и сульфатов натрия и железа (II).
82. Каков общий вид графической зависимости удельной и молярной электропроводности от концентрации растворов соляной и уксусной кислот в воде?
83. В чем отличия предельных подвижностей ионов Na+ и Cl–, H+ и OH–.
84. В чем заключается удобство введения величины постоянной сосуда Z? Какой физический смысл имеет эта величина?
85. Каким образом можно рассчитать степень диссоциации, константу диссоциации, рН раствора, используя данные определения электропроводности?
86. Вычислите удельную электропроводность спинномозговой жидкости, если сопротивление 0,1 н раствора KCl при температуре 20°С равно 24 Ом, а его удельная электропроводность 1,167 Ом–1м–1. Сопротивление спинномозговой жидкости, измеренное в том же сосуде, равно 45 Ом. (0,6224 Ом–1м–1)
87. Удельная электропроводность раствора HCl в желудочном соке при 25°С равна 0,185 Ом–1м–1, а его молярная электропроводность при той же температуре 370,0·10–4 Ом–1м2моль–1. Определите рН желудочного сока. (2,3)
88. Удельная электропроводность 1% – го раствора хлорида натрия (ρ = 1,0053 г/мл) равна 1,8 Ом–1м–1. Рассчитайте молярную электропроводность этого раствора. (105,9·10–4 Ом–1м2моль–1)
| |
