Приклади розв’язування задач. Приклад 1. Обчислити граничне розведення, межу виявлення, граничну концентрацію і показник чутливості
Приклад 1. Обчислити граничне розведення, межу виявлення, граничну концентрацію і показник чутливості, якщо 0,005мкг речовини калій катіона можна виявити у розчині об’ємом 0,05см3.
Дано:
mmin(К+) = 0,005 мкг
Vmin(К+(р)) = 0,05 см3
 Vгран(К+(р)) – ?
Vгран(К+(р)) – ?
Сгран(К+) – ?
Сmin1(К+) – ?
pD – ?
Розв’язування
1. Визначення граничного розведення.
Vгран(К+(p)) = [Vmin(К+(p))·106]:mmin(К+) = (0,05см3·106мкг/г):0,005мкг = =1·107см3/г
2. Визначення граничної концентрації.
Сгран(К+) = 1:Vгран(К+(p)) = 1г:1·107см3 = 1:1·107 г/см3
3. Визначення межі виявлення.
Сmin1(К+) = 1г:1·107см3 = 1·10–7 г/см3
4. Визначення показника чутливості.
pD = –lgCmin1(К+) = –lg1·10–7 = 7.
Приклад 2. Визначити масу речовини BaCl2·2H2O, що викристалізується при охолодженні насиченого при 100°С розчину барій хлориду масою 794г до 10°С, якщо коефіцієнти розчинності його дорівнюють 0,588 при 100°С і 0,357 при 10°С.
Дано:
m(BaCl2(p)) = 794г М(BaCl2 ) = 208г/моль
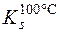 = 0,558 M(BaCl2·2H2O) = 244г/моль
= 0,558 M(BaCl2·2H2O) = 244г/моль

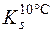 = 0,357
= 0,357
m(BaCl2·2Н2О) – ?
Розв’язування
1. Визначення маси речовини BaCl2, що міститься в насиченому при 100°С розчині.
m(BaCl2) = 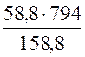 = 294г
= 294г
2. Визначення маси води у розчині, насиченому при 100°С.
m(H2O) = 794г–294г = 500г
3. Визначення маси речовини BaCl2·2H2O, що викристалізується при 10°С. Позначимо масу ВаСl2·2H2O, яка викристалізується при 10°С, за x, тобто:
m(BaCl2·2Н2О) = x г.
Тоді маса води, що міститься в x г BaCl2·2Н2О, дорівнює: m(H2O) = 36x:244 = 0,1475·х г, а в розчині залишиться (500–0,1475·х)г води.
Маса BaCl2, яка міститься в х г BaCl2·2H2O, дорівнює: m(BaCl2) = 208х:244 = 0,8525х г, а у розчині залишиться (294–0,8525)г барій хлориду.
Таким чином, є рівність:
У 100г води розчиняється 35,7г BaCl2,
у (500–0,1475х)г води – (294 – 0,8525х)г BaCl2.
Тоді (294–0,8525х) = 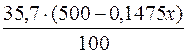 ;
;
100·(294–0,8525х) = 35,7·(500–0,1475х);
х=144,4; m(BaCl2·2H2O) = 144,4г.
Приклад 3. У воді масою 1кг розчинено калій гідроксид масою 560г. Знайти молярні частки речовин калій гідроксиду і води у розчині.
Дано:
m(H2O) = 1кг М(Н2О) = 18г/моль
 m(KOH) = 560г M(KOH) = 56г/моль
m(KOH) = 560г M(KOH) = 56г/моль
χ(KOH) – ?
χ(H2O) – ?
Розв’язування
1. Визначення кількості речовини калій гідроксиду в розчині.
n(KOH) = 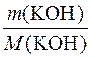 =
= 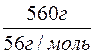 = 10моль
= 10моль
2. Визначення кількості речовини води в розчині.
n(H2O) = 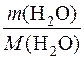 =
= 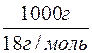 = 55,5 моль.
= 55,5 моль.
3. Визначення молярної частки речовини калій гідроксиду в розчині.
χ(KOH) = 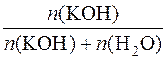 =
= 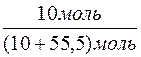 = 0,1530, або 15,30%
= 0,1530, або 15,30%
4.Визначення молярної частки води в розчині.
χ(H2O) = 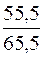 = 0,8470 або 84,70%.
= 0,8470 або 84,70%.
Приклад 4. Є розчин фосфатної кислоти з масовою часткою речовини H3PO4 38,17%. Густина розчину становить 1,24г/см3. Розрахувати молярну масу еквівалента речовини H3PO4 у розчині, якщо молярна концентрація еквівалента речовини H3PO4 у розчині 9,6580 моль/дм3.
Дано:
w(%)(H3PO4) = 38,17
ρ(H3PO4(p)) = 1,24г/см3
 c(fекв(H3PO4)H3PO4) = 9,6580 моль/дм3
c(fекв(H3PO4)H3PO4) = 9,6580 моль/дм3
M(fекв(H3PO4)H3PO4) – ?
Розв’язування
1. Визначення молярної маси еквівалента речовини H3PO4.
c(fекв(H3PO4) H3PO4) = 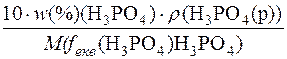
M(fекв(H3PO4) H3PO4) = 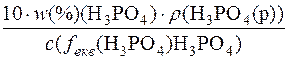 =
=
= 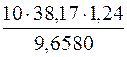 = 49 г/моль
= 49 г/моль
Отже, M(fекв(H3PO4)H3PO4) = 49г/моль; М(H3PO4) = 98г/моль
Відомо, що M(fекв(X)X) = fекв(X)·М(X), тоді M(fекв(H3PO4)H3PO4) = = fекв(H3PO4)·М(H3PO4)
fекв(H3PO4) = M(fекв(H3PO4)H3PO4)/М(H3PO4)
fекв(H3PO4) = 49г/моль: 98г/моль = ½
Отже, fекв(H3PO4) = ½. Тоді М(½H3PO4) = 49г/моль.
Приклад 5. У воді масою 60г розчинили сульфатну кислоту масою 40г. Використовуючи ці дані, виразити склад розчину і концентрацію H2SO4 всіма відомими способами.
1. Масова частка (%) розчиненої речовини в розчині.
Дано:
m(H2O) = 60г
 m(H2SO4) = 40г
m(H2SO4) = 40г
w(%)(H2SO4) – ?
w(%)(H2SO4) = m(H2SO4):[m(H2SO4)+m(H2O)]·100 =
= 40г:(40г+60г)·100 = 40,00%.
2. Мольна частка (%) розчиненої речовини в розчині.
Дано:
m(H2O) = 60г M(H2SO4) = 98,08г/моль
 m(H2SO4) = 40г M(H2O) = 18,02г/моль
m(H2SO4) = 40г M(H2O) = 18,02г/моль
χ(%)(H2SO4) – ?
χ(%)(H2SO4) = n(H2SO4):[n(H2SO4)+n(H2O)·100 =
= (40г:98,08г/моль):[40г:98,08г/моль+60г:18,02г/моль]·100 =
= 0,408моль:(0,408моль+3,330моль)·100 = 10,91%.
3. Моляльність розчину (відношення числа молів розчиненої речовини, що припадає на 1кг розчинника).
Дано:
m(H2O) = 60г
 m(H2SO4) = 40г
m(H2SO4) = 40г
b(H2SO4/H2O) – ?
b(H2SO4/H2O) = n(H2SO4):m(H2O) = [m(H2SO4):M(H2SO4)]:m(H2O) =
= (40г:98,08г/моль):0,06кг = 6,797моль/кг.
4. Сольватне число розчиненої речовини в розчині.
Дано:
m(H2O) = 60г
m(H2SO4) = 40г
 h(H2SO4) – ?
h(H2SO4) – ?
h(H2SO4)=n(H2O):n(H2SO4)=
= (1000г:18,02г/моль):(40г/60г·1000г:98,08г/моль)=
= 55,50моль:6,797моль = 8,16.
5. Молярна концентрація розчиненої речовини в розчині.
| Дано: m(H2O) = 60г m(H2SO4) = 40г w(%)(H2SO4) = 40,00 | З довідника: густина розчину ρ сульфатної кислоти з масовою часткою речовини 40% становить 1,303г/см3 |
c(H2SO4) – ?
c(H2SO4) = 10·w(%)(H2SO4)·ρ(H2SO4(p))/M(H2SO4) =
= 10·40,00%·1,303г/см3/98,08г/моль = 5,3140моль/дм3.
6. Молярна концентрація еквівалента речовини H2SO4 у розчині за умови, що цей розчин буде використано для реакції сульфатної кислоти, у якій фактор еквівалентності дорівнює ½.
Дано: w(%)(H2SO4) = 40,00
m(H2O) = 60г ρ(H2SO4(p)) = 1,303г/см3
 m(H2SO4) = 40г M(H2SO4) = 98,08г/моль
m(H2SO4) = 40г M(H2SO4) = 98,08г/моль
с(½H2SO4) – ? M(½H2SO4) = 49,04г/моль
с(½H2SO4) = 10·w(%)(H2SO4)·ρ(H2SO4(p))/M(½H2SO4) =
= 10·40,00%·1,303г/см3/49,04г/моль = 10,6281моль/дм3.
Приклад 6. До 20см3 розчину аргентум нітрату, с(AgNO3)=0,40моль/дм3, додали 40см3 розчину калій ціаніду, с(KCN)=0,50моль/дм3. Обчислити рівноважну молярну концентрацію речовини аргентум-іонів у суміші, якщо константа нестійкості аніона [Ag(CN)2]− становить 1,0·10–21.
Дано:
V(AgNO3) = 20см3
с(AgNO3) = 0,40моль/дм3
V(KCN) = 40см3
с(KCN) = 0,50моль/дм3
 Kн[Ag(CN)2]– = 1,0·10–21
Kн[Ag(CN)2]– = 1,0·10–21
[Ag+] – ?
Розв’язування
Визначаються молярні концентрації кожної речовини після змішування розчинів.
Загальний об’єм суміші після змішування становить 60см3.
с(AgNO3) = (0,40·20)/60 = 0,13моль/дм3 ; с(Ag+) = 0,13моль/дм3.
с(KCN) = (0,50·40)/60 = 0,33моль/дм3 ; с(CN–) = 0,33моль/дм3.
Молярна концентрація речовини калій ціаніду по відношенню до молярної концентрації аргентум нітрату є в надлишку, тому у розчині може відбуватися процес комплексоутворення:
Ag+ + 2CN– D [Ag(CN)2]–.
Цей процес зворотний, який кількісно можна охарактеризувати константою нестійкості комплексного йона.
Визначаємо рівноважну концентрацію Ag+ у суміші.
[Ag(CN)2]– D Ag+ + 2CN–
| 1моль | 1моль | 2моль | |
| срівн. | х моль | 2х моль | |
Kн[Ag(CN)2]– = 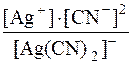
[Ag+] = х моль;
[CN–]=с(CN–)–2(с(Ag+)–х);
[CN–] = 0,33–2·(0,13–х) = 0,33–2–0,13 = 0,07моль/дм3;
[Ag(CN)2]– = с(Ag+)–х = (0,13–х)моль/дм3.
Оскільки х – мала величина у порівнянні з молярною концентрацією Ag+, то значенням х можна знехтувати.
1,0·10–21 = 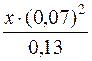 ; х= 2,65·10–20.
; х= 2,65·10–20.
Рівноважна концентрація аргентум-іонів у розчині
[Ag+]=2,65·10–20моль/дм3.
Приклад 7. Молярна концентрація речовини Н+-іонів у розчині ацетатної кислоти (с(СН3ООН)=0,1моль/дм3) становить 1,3·10–3 моль/дм3.Обчислити константу і ступінь дисоціації кислоти.
Дано:
с(СН3СООН) = 0,1моль/дм3
 [H+] = 1,3·10–3моль/дм3
[H+] = 1,3·10–3моль/дм3
Kд(CH3COOH) – ?
α – ?
Розв’язування
CH3COOH D H+ + CH3COO–
У стані рівноваги [H+] = [CH3COO–]= с·α; a[CH3COOH] = с–с·α
Kд(CH3COOH) = 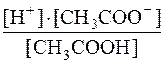 =
= 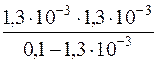 =1,71·10–5
=1,71·10–5
Kд(CH3COOH) = α2·с(CH3COOH); α= 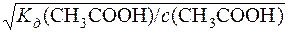 =
= 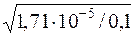 = 0,0171 (1,71%).
= 0,0171 (1,71%).
Приклад 8. Розрахувати активність натрій-іонів і сульфат-іонів у розчині, в 1дм3 якого міститься 0,005 натрій сульфату і 0,02моль ацетатної кислоти.
Дано:
с(Na2SO4) = 0,005моль/дм3
с(СH3COOH) = 0,02моль/дм3
 а(Na+) – ?
а(Na+) – ?
a( 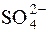 ) – ?
) – ?
Розв’язування
Визначаються молярні концентрації Na+ і 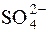 у розчині.
у розчині.
Na2SO4 " 2Na+ + 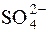
| 1моль | 2моль | 1моль | |
| срівн. | (0,005·2) моль | 0,005 моль | |
[Na+] = 0,01моль/дм3; [ 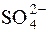 ] = 0,005моль/дм3.
] = 0,005моль/дм3.
Дисоціацією молекул ацетатної кислоти нехтують, оскільки ацетатна кислота – слабкий електроліт і участь її у створенні йонної сили не суттєва.
Розраховують йонну силу розчину.
μ = 3с(Na2SO4) = 3·0,005 = 0,015моль/дм3.
Коефіцієнт активності йонів Na+ за цієї йонної сили f(Na+)=0,89, a йонів 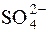 – f(
– f( 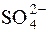 ) = 0,63 (з довідника).
) = 0,63 (з довідника).
Далі розраховують активності йонів Na+ і 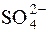 у розчині.
у розчині.
а(Na+) = [Na+]·f(Na+) = 0,01· 0,89 = 8,9·10–3моль/дм3;
а( 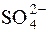 ) = [
) = [ 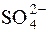 ]·f(
]·f( 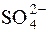 ) = 0,005·0,63 = 3,15·10–3моль/дм3.
) = 0,005·0,63 = 3,15·10–3моль/дм3.
Приклад 9. Розрахувати ступінь дисоціації і pH у розчині ацетатної кислоти (с(СН3СООН) = 0,2моль/дм3) з урахуванням коефіцієнтів активності.
Дано:
с(СН3СООН) = 0,2моль/дм3 Kд(СH3COOH) = 1,74·10–5. (μ=0)
 α – ?; рН - ?
α – ?; рН - ?
Розв’язування
Визначають наближену молярну концентрацію йонів Н+ у розчині.
СН3СООН D Н+ + СН3СОО–
| 1моль | 1моль | 1моль | |
| срівн. | (с–сα)моль | (сα)моль | (сα)моль |
[H+] = [СН3СОО–]
Оскільки ступінь дисоціації – мала величина, то допускають, що рівноважна концентрація СН3СООН дорівнює початковій молярній концентрації ацетатної кислоти, тобто [СН3СООH] = с(СН3СООН).
[H+] = 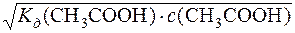 =
= 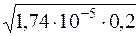 = 1,87·10–3
= 1,87·10–3
[H+] = 1,87·10–3моль/дм3.
Далі визначають йонну силу розчину.
Оцтова кислота – бінарний електроліт, тому
[H+] = [СН3СОО–] = 1,87·10–3 моль/дм3 і μ=1,87·10–3.
За рівнянням Девіса визначають точне значення константи дисоціації СН3СООН.
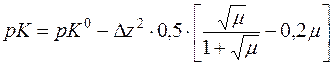
Δz2 = Σnz2 продуктів реакції – Σmz2 вихідних речовин = 1+1–0=2
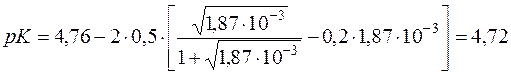
Kд(СH3COOH) = 1,92·10–5.
Визначають молярну концентрацію йонів H+ з урахуванням активності.
[H+]а= 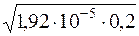 = 1,96·10–3.
= 1,96·10–3.
[H+]а = 1,96·10–3 моль/дм3.
Далі визначають раН розчину і ступінь дисоціації CH3COOH.
раH = –lg[H+]a = –lg1,96·10–3 = 2,71
α = 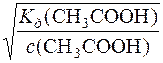 =
= 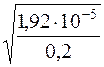 = 9,8·10–3 або 0,98%
= 9,8·10–3 або 0,98%
раН = 2,71
α = 0,98%
Приклад 10. Як зміниться pH і ступінь дисоціації амоній гідроксиду у розчині з с(NH3·H2O)=1,0моль/дм3 після додавання до розчину речовини амоній хлориду в такій кількості, щоб молярна концентрація речовини амоній хлориду в розчині стала 0,2моль/дм3?
Дано:
с(NH3·H2O) = 1,0моль/дм3 Kд(NH3·H2O) = 1,76·10–5
 с(NH4Cl) = 0,2моль/дм3
с(NH4Cl) = 0,2моль/дм3
pH1 – ? α1 – ?
pH2 – ? α2 – ?
Розв’язування
Визначення молярної концентрації гідроксид-іонів у розчині NH3·H2O до додавання солі:
[OH–] = 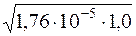 = 4,20·10–3моль/дм3.
= 4,20·10–3моль/дм3.
Визначення ступеня дисоціації амоній-гідроксиду:
α = (4,20·10–3/1,0)·100 = 0,42%
Визначення pOH розчину:
pOH = –lg4,20·10–3 = 2,38
Визначення pH розчину:
pH = 14–pOH = 14–2,38 = 11,62
Визначення молярної концентрації гідроксид-іонів у розчині після додавання солі NH4Cl:
[OH–] = 1,76·10–5·1,0/0,2 = 8,8·10–5моль/дм3
Визначення ступеня дисоціації амоній гідроксиду після додавання солі NH4Cl:
α = (8,8·10–5/1,0)·100 = 0,009%
Визначення pOH розчину після додавання солі NH4Cl:
pOH = –lg8,8·10–5 = 4,06
Визначення pH розчину після додавання солі NH4Cl:
pH = 14–pOH = 14–4,06 = 9,94
Після додавання до 1,0М розчину амоній гідроксиду амоній хлориду pH зміниться з 11,62 до 9,94, а ступінь дисоціації зменшиться з 0,42% до 0,009%.
Приклад 11. Розрахувати, як зміниться pH, якщо до 400см3 буферного розчину з молярними концентраціями амоній гідроксиду 0,2моль/дм3 і амоній хлориду 0,3моль/дм3 додати 100см3 розчину NaOH з молярною концентрацією натрій гідроксиду 0,05моль/дм3.
Дано:
V(NH3·H2O+NH4Cl) = 400cм3 Kд(NH3·H2O) = 1,76·10–5
с(NH3·H2O) = 0,2моль/дм3
с(NH4Cl) = 0,3моль/дм3
V(NaOH) = 100см3
с(NaOH) = 0,05моль/дм3
 ΔpH – ?
ΔpH – ?
Розв’язування
Допускають, що [NH3·H2O] ≈ с(NH3·H2O) = 0,2моль/дм3; [NH4Cl] ≈ с(NH4Cl) = 0,3моль/дм3.
Визначають молярну концентрацію гідроксид-іонів у буферному розчині:
[OH–] = Kд(NH3·H2O)· 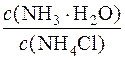 = 1,76·10–5·
= 1,76·10–5· 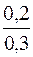 = 1,7·10–5моль/дм3
= 1,7·10–5моль/дм3
Визначають pOH і pH буферної системи:
pOH = –lg[OH–] = 1,7·10–5 = 4,93; pH = 14–pOH = 14–4,93 = 9,07.
Додавання розчину натрій гідроксиду викликає перетворення частини амоній-іонів в амоніак.
Визначають молярні концентрації амоніаку і амоній хлориду у розчині після додавання натрій гідроксиду:
с(NH3·H2O) = 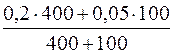 = 0,17моль/дм3
= 0,17моль/дм3
с(NH4Cl) = 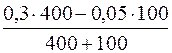 = 0,23моль/дм3
= 0,23моль/дм3
Визначають молярну концентрацію гідроксид-іонів у буферному розчині після додавання розчину натрій гідроксиду:
[OH–] = Kд(NH3·H2O)· 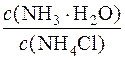 = 1,76·10–5·
= 1,76·10–5· 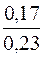 = 1,3·10–5моль/дм3
= 1,3·10–5моль/дм3
Визначають pOH і pH буферної системи після додавання розчину лугу:
pOH = –lg[OH–] = –lg1,3·10–5 = 4,87;
pH = 14–pOH = 14–4,87 = 9,13.
При додаванні лугу ∆pH = 9,13–9,07 = 0,06.
Тобто, при додаванні до буферних систем невеликих кількостей сильних основ або сильних кислот pH буферної системи змінюється в дуже незначній мірі.
Приклад 12. Обчислити, у скільки разів розчинність (моль/дм3) барій сульфату в насиченому водному розчині більша, ніж у водному розчині натрій сульфату з концентрацією Na2SO4 0,05моль/дм3
Дано:
BaSO4, с(Na2SO4)=0,05моль/дм3 ДР(BaSO4) = 1,1·10–10

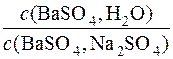 – ?
– ?
Розв’язування
У насиченому водному розчині встановлюється рівновага:
BaSO4 D Ba2+ + 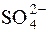
| 1моль | 1моль | ||
| срівн. | х моль | х моль | |
ДР(BaSO4) = [Ba2+]·[ 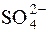 ]; 1,1·10–10 = x2; x=1,05·10–5.
]; 1,1·10–10 = x2; x=1,05·10–5.
[Ba2+] = с(BaSO4). Отже, с(BaSO4, H2O) = 1,05·10–5моль/дм3.
Далі визначається молярна концентрація 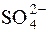 -іонів у розчині натрій сульфату з с(Na2SO4)=0,05моль/дм3:
-іонів у розчині натрій сульфату з с(Na2SO4)=0,05моль/дм3:
Na2SO4 " 2Na+ + 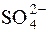
| 1моль | 2моль | 1моль | |
| срівн. | 0,05 моль | ||
Отже, с( 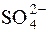 ) = 0,05моль/дм3.
) = 0,05моль/дм3.
Визначається розчинність барій сульфату у розчині натрій сульфату з с(Na2SO4)=0,05моль/дм3:
BaSO4 D Ba2+ + 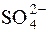
| 1моль | 1моль | ||
| срівн. | х моль | (х+0,05) моль | |
ДР(BaSO4) = [Ba2+]·[ 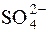 ]; 1,1·10–10 = х·(х+0,05)
]; 1,1·10–10 = х·(х+0,05)
Оскільки величина х у загальній рівноважній молярній концентрації сульфат-іонів у порівнянні з 0,05моль мала, то нею можна знехтувати і вважати, що рівноважна молярна концентрація сульфат-іонів дорівнює 0,05моль/дм3. Тоді:
1,1·10–10 = х·0,05; х = 2,2·10–9.
Отже, с(BaSO4, Na2SO4) = 2,2·10–9моль/дм3
Далі визначається , у скільки разів молярна концентрація барій сульфату у насиченому водному розчині більша, ніж у водному розчині натрій сульфату з с(Na2SO4)=0,05 моль/дм3.
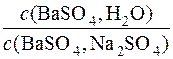 =
= 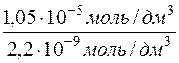 = 4772
= 4772
Відповідь: у 4772 рази розчинність барій сульфату у воді більша, ніж у водному розчині Na2SO4 з с(Na2SO4) = 0,05моль/дм3.
Приклад 13. Обчислити розчинність аргентум сульфіду у розчині хлоридної кислоти (с(НСl)=0,1моль/дм3), насиченому гідроген сульфідом (с(H2S)=0,1моль/дм3).
Дано:
Ag2S ДР(Ag2S) =6,3 · 10–50;
с(HCl) = 0,1моль/дм3 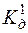 (H2S) = 1,0·10–7;
(H2S) = 1,0·10–7;
 с(H2S) = 0,1моль/дм3
с(H2S) = 0,1моль/дм3 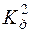 (H2S) = 2,5·10–13.
(H2S) = 2,5·10–13.
S(Ag2S) – ?
Розв’язування
Визначають молярну концентрацію Н+-іонів у розчині хлоридної кислоти:
[H+] = с(HCl) = 0,1моль/дм3.
Визначають частку речовини вільних сульфід-іонів у розчині. Процес розчинення Ag2S в HCl можна представити таким рівнянням:
Ag2S(т) D 2Ag+ + S2–
S2– + 2H+ D H2S
Або Ag2S(т) + 2Н+ D 2Ag+ + H2S
с(S2–) = [H2S] + [HS–] + [S2–]
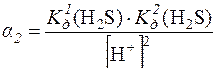 =
= 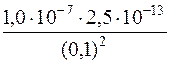 = 2,5∙10–18
= 2,5∙10–18
[S2–] = с(H2S)∙α2 = 0,1∙2,5∙10–18 = 2,5∙10–19моль/дм3
Розраховують розчинність аргентум сульфіду.
Якщо S – розчинність Ag2S, то [Ag+]=2S
Тоді (2S)2∙0,1 = ДР(Ag2S)/α2 = 6,3∙10–50/2,5∙10–19 = 2,52∙10–31
S = 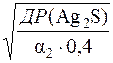 =
= 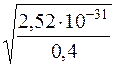 = 2,51∙10–16
= 2,51∙10–16
S(Ag2S) = 2,51∙10–16моль/дм3.
Приклад 14. Обчисліть pH у водному розчині натрій ацетату з молярною концентрацією CH3COONa 0,01моль/дм3 за температури 25oС.
Дано:
с(СН3COONa) = 0,01моль/дм3 Константа дисоціації оцтової
кислоти –
t° = 25°С Kд(CH3COOH) =1,74∙10–5
pH – ? Йонний добуток води за вказаної
температури Kw=1∙10–14
Розв’язування
Натрій ацетат гідролізується за аніоном.
CH3COO– + HOH D CH3COOH + OH–
Визначають константу гідролізу ацетат-іона:
Kг(CH3COO–) = 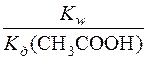 =
= 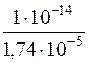 = 5,7 ∙ 10–10
= 5,7 ∙ 10–10
Визначають молярну концентрацію Н+-іонів у розчині:
[H+] = 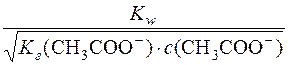 =
= 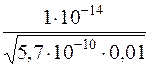 = 4,2 ∙ 10–9 моль/дм3
= 4,2 ∙ 10–9 моль/дм3
Визначають pH розчину:
pH = –lg[H+] = –lg4,2∙10–9 = 8,38.
Приклад 15. Яка маса калій ціаніду розчинена у 10см3 водного розчину його, якщо pH розчину становить 11,10?
Дано:
V(KCN) = 10см3 Kд(HCN) = 6,2∙10–10
 pH = 11,10
pH = 11,10
m(KCN) – ?
Розв’язування
Калій ціанід гідролізується за аніоном.
CN– + HOH D HCN + OH–
Визначають молярну концентрацію калій ціаніду в розчині.
pH = 7–½lg Kд(HCN)+½lgс(KCN);
½lgс(KCN) = pH–(7–½lgKд(HCN)) = pH–7+½lgKд(HCN);
lgс(KCN) = 2(pH–7+½lgKд(HCN));
lgс(KCN) = 2[11,10–7+½(–9,19)] = 2∙(–0,495) = –0,99
с(KCN) = 0,1026моль/дм3
Далі визначають масу речовини калій ціаніду, що міститься в 10 см3 цього розчину.
m(KCN) = [M(KCN)∙с(KCN)∙V(KCN)]/1000;
m(KCN) = 65,12г/моль∙0,1026моль/дм3∙0,010дм3/1000 = 0,0668г
m(KCN) = 0,0668г.
Приклад 16. Обчислити константу і ступінь дисоціації форміатної кислоти у водному розчині амоній форміату з молярною концентрацією HCOONH4 0,1моль/дм3, який має pH 6,50.
Дано:
с(HCOONH4) = 0,1моль/дм3
pH = 6,50
 Kд(HCOOH) – ?
Kд(HCOOH) – ?
α – ?
Розв’язування.
Амоній форміат гідролізується і за катіоном, і за аніоном.
HCOO– + 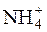 + HOH D HCOOH + NH3∙H2O
+ HOH D HCOOH + NH3∙H2O
Визначають константу дисоціації форміатної кислоти:
pH = ½pKw + ½pK(HCOOH) – ½pK(NH3∙H2O);
½pK(HCOOH) = pH–½pKw + ½pK(NH3∙H2O);
pK(HCOOH) = 2∙(pH–½pKw + ½pK(NH3∙H2O) = 2∙(6,50–7+2,38) = –3,76
Kд(HCOOH) = 1,74∙10–4
Визначають ступінь дисоціації форміатної кислоти:
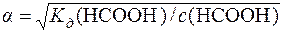 =
= 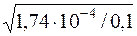 =0,0417 або 4,17%.
=0,0417 або 4,17%.
Приклад 17. Визначити напрям окисно-відновної реакції 2Fe3++Sn2+=2Fe2++Sn4+, якщо концентрації компонентів дорівнюють: с(Fe3+)=с(Sn2+)=0,001моль/дм3, с(Fe2+)=с(Sn4+)=0,1моль/дм3.
Розв’язування
За рівнянням Нернста редокс-потенциал системи визначається:
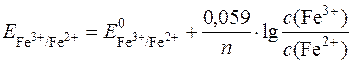 ;
;
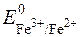 = +0,771B (табличне значення).
= +0,771B (табличне значення).
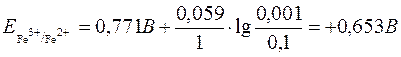 ;
;
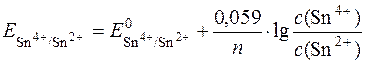 ;
;
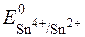 = + 0,15B (табличне значення).
= + 0,15B (табличне значення).
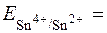 0,15B
0,15B 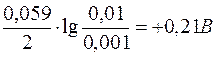 ;
;
Редокс-пара з більшим окисно-відновним потенціалом є окисником по відношенню до редокс-пари з меншим окисно-відновним потенціалом.
Отже, в даній окисно-відновній реакції окисником є Fe3+, а відновником Sn2+. Реакція буде проходити в бік утворення Sn4+ і Fe2+.
Електрорушійна сила = Еox–Ered = 0,653–0,21 = 0,443B > 0.
Приклад 18. До розчину CuSO4 з молярною концентрацією купрум сульфату 0,2моль/дм3 додали рівний об’єм розчину амоніаку з c(NH3)=2,0моль/дм3.
Обчислити молярну концентрацію Сu2+ в отриманому розчині, якщо вважати, що у розчині утворюється комплексний катіон [Cu(NH3)4]2+.
Дано:
c(CuSO4) = 0,2моль/дм3 Константа нестійкості комплексного
йона
V(CuSO4(p)) = V(NH3(p)) Kн[Cu(NH3)4]2+ = 9,33·10–13.
 c(NH3) = 2моль/дм3
c(NH3) = 2моль/дм3
[Cu2+] – ?
Розв’язування.
Визначають вихідні молярні концентрації кожної речовини після змішування розчинів.
с(CuSO4)=0,1моль/дм3; с(NH3)=1моль/дм3.
Визначають молярну концентрацію Cu2+-іона у розчині після додавання розчину амоніаку.
При додаванні розчину амоніаку концентрація Cu2+-іонів зменшується внаслідок реакції комплексоутворення:
Cu2+ + 4NH3 D [Cu(NH3)4]2+
| 1моль | 4моль |
Утворений комплексний йон [Cu(NH3)4]2+ дисоціює як слабкий електроліт:
[Cu(NH3)4]2+ D Cu2+ + 4NH3
| 1моль | 4моль | ||
| срівн. | (0,1–х) моль | х моль | (0,6–4х) моль |
Оскільки рівноважна молярна концентрація речовини [Сu(NH3)4]2+-іона дорівнює (0,1–x) моль/дм3, то молярна концентрація речовини амоніаку при утворенні цього комплексу зменшилась на 4(0,1–x)моль/дм3. Тоді рівноважна молярна концентрація амоніаку дорівнює [1–4·(0,1–x)] моль/дм3.
Kн[Cu(NH3)4]2+= 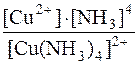 ; 9,33·10–13 =
; 9,33·10–13 = 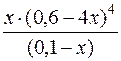
Значення x – мала величина у порівнянні з 0,1 і 0,6, тому значенням x у знаменнику і (4x)4 у чисельнику можна знехтувати. Тоді матимемо:
9,33 · 10–13 = 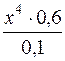 ; x = 7,2·10–14.
; x = 7,2·10–14.
Отже, [Cu2+] у розчині комплексної сполуки [Cu(NH3)4]SO4 становить 7,2 ·10–14моль/дм3, що свідчить про високу стійкість комплексного катіона.
