Жесткость воды и методы ее умягчения
Специфические свойства воде придают ионы Ca2+ и Mg2+ , присутствие которых определяет жесткость воды.
Жесткость воды – один из технологических показателей, принятых для характеристики состава и качества природных вод, который характеризуется содержанием числа миллимолей эквивалентов ионов Са2+ и Мg2+ в 1л воды. Один миллиэквивалент жесткости отвечает содержанию в воде 20,04мг/л Са2+ или 12,16мг/л Mg2+, что соответствует значению эквивалентной массы этих ионов.
Различают несколько видов жёсткости: общую, временную, постоянную, карбонатную и некарбонатную.
Общей жёсткостью называется суммарная концентрация ионов Ca2+, Mg2+ в воде, выраженная в мэкв/л.
Постоянная жёсткость - часть общей жёсткости, остающаяся после кипячения воды при атмосферном давлении в течение определённого времени.
Временная жёсткость – часть общей жёсткости, удаляющаяся кипячением воды при атмосферном давлении в течение определённого времени. Она равна разности между общей и постоянной жёсткостью.
Карбонатная жёсткость – часть общей жёсткости, эквивалентная концентрации гидрокарбонатов кальция и магния.
Некарбонатная жёсткость - часть общей жёсткости, равная разности между общей и карбонатной жёсткостью.
ПРИМЕР 1.В 5 м3 воды содержится 250 г ионов кальция и 135 г ионов магния. Определить общую жесткость воды.
РЕШЕНИЕ. Найдем содержание ионов кальция и магния (в мг/л) в воде:
250 × 1000 / 5 ×1000 = 50 (мг/л) ионов Са2+
и 135 × 1000 / 5 × 1000 = 27 (мг/л) ионов Mg2+.
1 мэкв жесткости отвечает содержанию 20,04 мг/л ионов. Са2+ или 12,16 мг/л ионов Мg2+; следовательно,
Ж = 50/20,04 + 27/12,16 = 4,715 (мэкв/л).
Ответ: Ж=4,715 мэкв/л
ПРИМЕР 2. Вычислить карбонатную жёсткость воды, зная, что на титрование 100мл этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25мл, 0,08 н раствора НС1. Привести уравнение соответствующей реакции.
РЕШЕНИЕ: Задачу решаем используя закон эквивалентов для растворов.
N1•V1 = N2•V2, (1)
где N1 и N2 – нормальность растворов 1 и 2, моль-экв/л
V1 и V2 – объём растворов 1 и 2, мл
Вычислим нормальность раствора гидрокарбоната кальция:
N1 = 6,25•0,08 ⁄ 100 = 0,005моль-экв/л
Следовательно, в 1 л воды содержится 0,005•1000 = 5 мэкв гидрокарбоната кальция.
Ответ: Ж=5мэкв/л
Использование природной воды в технике требует ее предварительной очистки. Процесс, приводящий к снижению жёсткости воды, называется умягчением воды.
Способы умягчения воды можно разделить на три основные группы:
1) термическое умягчение воды; 2) реагентные методы умягчения; 3) умягчение воды методом ионного обмена.
Термический способ умягчения воды
Временная или карбонатная жесткость, устраняется нагреванием воды до 70—80°С и последующей фильтрацией. При нагревании протекают реакции:
Са(НСОз)2 = СаСО3¯ + СО2 + H2O
Mg(HCО3)2 = MgCО3¯ + CO2 + H2О
Однако полностью устранить карбонатную жёсткость термическим методом нельзя, т. к. СаСО3, хотя и незначительно, но растворим в воде. Растворимость МgСО3 достаточно высока, поэтому гидрокарбонат магния сразу же взаимодействует с водой, т.е. наблюдается процесс гидролиза и вместо МgСО3, в осадок выпадает Mg(ОН)2:
MgC03 + H2О =Мg(ОН)2¯ + СO2
2. Реагентное умягчение воды.
Реагентное умягчение воды состоит в том, что при введении в воду специальных реагентов катионы кальция и магния, растворенные в ней, переходят в практически нерастворимые соединения, которые выпадают в осадок.
Например, фосфатный способ умягчения воды:
3CaS04 + 2Na3P04 = Саз(РО4)2↓ + Na2SO4
3MgCl2 + 2Na3PO4 = Mg3(PO4)2 ↓ + 6NaCl
3Ca(HCO3)2 + 2Na3PO4 = Ca3(PO4)2↓ + 6NaHCO3
3Mg(HCO3)2 + 2Na3PO4 = Mg3(PO4)2 ↓+ 6NaHCO3
Методы ионного обмена
Катионитовый метод умягчения воды основан на способности некоторых практически нерастворимых в воде веществ, называемых катионитами , обменивать содержащиеся в них активные группы катионов (натрия, водорода и др.), на катионы кальция или магния, находящиеся в воде.
В настоящее время большое распространение получили ионообменные смолы, которые получают на основе синтетических полимеров. Ионнообменные смолы – это сетчатые, трёхмерные полимеры, не растворяющиеся в воде, но ограниченно набухающие в ней и содержащие групы, способные к обмену ионов
Умягчаемую воду фильтруют через слой катионита, при этом катионы кальция и магния из воды переходят в катионит, а в воду переходят катионы натрия или водорода. Химизм Na-катионирования описывается уравнениями реакций:
2NaR + Ca(HCO3)2 = CaR2 + 2NaHCO3
2NaR + Mg(HCO3)2 = MgR2 + 2NaHCO3
2NaR + CaSO4 = CaR2 + Na2SO4
2NaR + MgCl2 = MgR2 + 2NaCl
(где R – комплекс катионита, практически нерастворимый в воде)
ПРИМЕР 3. Жесткость воды равна 5,4 мэкв ионов кальция в 1 л воды. Какое количество фосфата натрия Na3P04 необходимо взять, чтобы понизить жесткость 100л воды практически до нуля.
РЕШЕНИЕ: Задачу решаем, используя формулу
Ж = m•1000 / Мэ•V, (1)
Где m – масса вещества, обусловливающего жёсткость воды, или применяемого для устранения жёсткости воды, г; Мэ – эквивалентная масса этого вещества; г/моль; V – объём воды, л, 1000 – коэффициент перевода экв/л в мэкв/л
Мэ (Na3PO4) = М(Na3PO4) / n•В, (2)
где n – количество ионов металла; В – валентность металла.
Мэ(Na3PO4) = 164 / 3 =54,7 (г/моль)
Из уравнения (1) выразим массу
m = Ж•Э•V/1000 = 5,4•54,7•100/1000 = 29,538 (г)
Ответ: m = 29,538г.
ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ
101. Вода содержит 0,12 г MgSO4 и 0,243 г Са(НСОз)2 на 1 литр. Определить общую жёсткость воды. Привести реакции фосфатного метода умягчения воды, содержащей данные соли.
102. Какова постоянная и временная жёсткость воды, если в ней содержится ионов Са2+ - 0,110 г/л; Mg2+ - 0,0425 г/л; НСО3- - 0,07 г/л.Составить уравнение реакции, лежащее в основе термического умягчения воды.
103. Общая жесткость воды равна 7,8 мэкв/л. Определить постоянную жесткость воды, если при определении временной жесткости на 100 мл испытуемой воды при титровании пошло 5,2 мл 0,1 н. раствора соляной кислоты
104. Какая масса сульфата кальция содержится в 200 л воды, если жёсткость, обуславливаемая этой солью, равна 8 мэкв/л? Привести уравнение реакции бариевого метода умягчения воды.
105. Какова общая и карбонатная жёсткость воды, если в 1 л воды содержатся ионы Са2+ - 0,111 г; Mg2+ - 06 г; SO42- - 0,098 г; С1- - 0,14 г.
106. Вычислить временную жёсткость воды, зная, что для реакции с гидрокарбонатом магния, содержащемся в 200 см3 воды, требуется 15 см3 0,08 н раствора соляной кислоты. Привести уравнение соответствующей реакции.
107. Общая жесткость воды равна 11,7 мэкв/л. Определить постоянную жесткость воды, если при определении временной жесткости на 100 мл испытуемой воды при титровании пошло 6,5 мл 0,1 н. раствора соляной кислоты
108. Какую массу карбоната натрия надо прибавить к 1 м3 воды, чтобы устранить жёсткость, равную 8 мэкв/л? Привести уравнение реакции.
109. В 10 л воды содержится 38 мг гидрокарбоната магния и 108 мг гидрокарбоната кальция. Вычислить общую жёсткость воды. Привести уравнения реакций термического умягчения воды.
110. При кипячении 250 мл воды, содержащей только гидрокарбонат магния, выпал осадок массой 4,5 мг. Чему равна жёсткость воды. Привести уравнение реакции.
111. Вычислить временную жёсткость воды, зная, что на реакцию с гидрокарбонатом магния, содержащимся в 200 мл этой воды, потребовалось 5 мл 0,1 н раствора соляной кислоты. Составить уравнение реакции.
112. Сколько граммов гидроксида кальция необходимо прибавить к 1000 л воды, чтобы удалить временную жёсткость, равную 2,86 мэкв/л? Составить уравнение реакции.
113. В 1 м3 воды содержится 140 г сульфата магния. Вычислите жесткость этой воды. Привести уравнение реакции умягчения воды содовым способом..
114. Чему равна жесткость природной воды, если содержание ионов магния в ней составляет 121,6 мг/л? Привести уравнения реакции катионитного умягчения воды с использованием Н-катионита.
115. Определить жесткость воды, если в 1 л ее содержится 0,1002 г ионов Са2+ и 0,03648 г ионов Mg2+. Привести уравнения реакций устранения карбонатной жесткости термическим методом.
116. Какова общая и временная жёсткость воды, если в 1 л воды содержатся ионы Mg2+ - 0,3 г; SO42- -0,049 г; С1- - 0,07 г, Са2+ -0,055 г;
117. Определить общую жёсткость воды, в 100 л которой содержится 8,5 г хлорида магния, 11,8 г хлорида кальция, 6,1 г гидрокарбоната магния и 18,3 г гидрокарбоната кальция.
118. Определить общую жёсткость воды, в 10 л которой содержится 0,95 г хлорида магния, 2,22 г хлорида кальция, 0,73 г гидрокарбоната магния и 2,43 г гидрокарбоната кальция.
119. Рассчитайте карбонатную, некарбонатную и общую жёсткость воды, содержащую в 10 л: Са2+ - 40 мг; НСО3- - 61 мг; С1- - 35 мг; Mg2+ - 24 мг.
120. Общая жесткость воды равна 8,5 мэкв/л. Определить постоянную жесткость воды, если при определении временной жесткости на 100 мл испытуемой воды при титровании пошло 6,5 мл 0,1 н. раствора соляной кислоты
ЭЛЕКТРОЛИЗ
Электролизом называется совокупность процессов, протекающих при прохождении постоянного электрического тока через систему, состоящую из двух электродов и расплава или раствора электролита. Эти процессы складываются из направленного движения ионов в растворе или расплаве электролита и реакций восстановления и окисления, происходящих на электродах
Электрод, на котором протекают процессы окисления, называется анодом, а электрод, на котором протекают процессы восстановления – катодом.
Потенциал анода всегда меньше потенциала катода. При электролизе анод заряжен положительно, катод – отрицательно.
При электролизе растворов электролитов на катоде возможны следующие реакции:
1) восстановление ионов металла Men+ + nē → Me;
2) восстановление ионов водорода в кислой среде
2Н+ + 2ē → Н2 (φ0 (2Н+/Н2) = 0,0 В);
3) восстановление молекул воды
2Н2О + 2ē → Н2 + 2ОН- (φ0 (Н2О/Н2) = -0,41 В).
Из возможных катодных процессов осуществляется тот, который характеризуется наибольшим значением электродного потенциала.
Из этого следует, что при электролизе растворов солей металлов, стоящих в ряду напряжения после водорода, например, медь, серебро, золото и другие, на электроде восстанавливаются только ионы металла и выделяется металл. В нейтральных и щелочных растворах с рН ≥ 7 возможно выделение и тех металлов, электродные потенциалы которых выше -0,41 В. (Объяснение следует дальше)
Из растворов, содержащих смесь таких катионов, происходит последовательное выделение металлов в порядке уменьшения величины их электродных потенциалов.
Если в растворе находятся ионы металлов, стоящие в ряду напряжения до алюминия включительно (φ0 (Аl3+/Al) = -1.66 В), например, натрий, литий, кальций и другие, то на катоде восстанавливается только вода.
Металлы, электродные потенциалы которых не сильно отличаются от водородного (находится в ряду напряжения металлов после алюминия), восстанавливаются на катоде одновременно с водой. При этом выделяется и металл, и водород. В зависимости от условий электролиза массовые соотношения металла и водорода могут быть различными, вплоть до выделения только одного металла или водорода.
При электролизе растворов электролитов на аноде могут протекать реакции окисления:
1) анионов кислотных остатков: Ann- →An + nē;
2) гидроксид - анионов
4ОН- - 4ē →2Н2О + О2 (φ0 (O2 + 2Н2O/4OH-) = 0,4 B);
3) молекул воды
2Н2О - 4ē → О2 + 4Н+ (φ0 (O2 + 4Н+/2Н2O ) = 1,23 B при рН = 7);
4) металла анода (растворимый анод)
Me →Men+ + nē.
Из возможных анодных процессов осуществляется тот, который характеризуется наименьшим значением электродного потенциала.
Характер анодных процессов зависит от природы используемого анода. Различают инертные и растворимые аноды. Первые изготовлены из малоактивных металлов, например, из платины, а также используют графитовые, угольные электроды. Материалом растворимых анодов является металл с потенциалом меньшим, чем потенциалы конкурирующих процессов, например, медь, цинк и другие. При этом окислению подвергается материал анода. Так, при электролизе раствора сульфата меди (II) с медным анодом происходит растворение анода: Сu → Cu2+ + 2ē. Это объясняется тем, что потенциал меди (φ0(Cu2+/Cu) = 0,34 B) меньше потенциалов окисления воды и сульфат - иона. В процессе электролиза с использованием растворимого анода металла анода в виде ионов переходит в раствор, затем они могут восстанавливаться на катоде. На этом основаны методы очистки металлов от примесей (электрохимическое рафинирование металлов), методы нанесения покрытий и прочее.
На инертных анодах (графитовый, угольный, платиновый) могут окисляться молекулы воды, гидроксид – ионы или ионы кислотных остатков.
На аноде в растворах кислородосодержащих кислот или их солей разряжается вода. Это связано с тем, что электродные потенциалы анионов кислородосодержащих кислот имеют большие значения, чем потенциал окисления воды. Например, 2SO42- - 2ē → S2O82- (2,01 В). Аналогично ведут себя фторид-ионы (φ0(F2/2F-) = 2,87 B).
Ионы Cl-, Br-, J-, S2- разряжаются из не очень сильно разбавленных растворов.
2Сl- → Cl2 + 2ē, φ0(Cl2/2Cl-) = 1,36 B,
2Br- → Br2 + 2ē, φ0(Br2/2Br-) = 1,065 B,
2J- → J2 + 2ē, φ0(J2/2J-) = 0,54 B,
S2- → S + 2ē, φ0(S/S2-) = -0,51 B,
В связи с перенапряжением реакции выделения кислорода на аноде идёт окисление ионов хлора, хотя его потенциал больше потенциала окисления воды.
При электролизе растворов щелочей на аноде происходит окисление гидроксид-ионов, т.к. этот процесс характеризуется наименьшим потенциалом.
ПРИМЕР 1:Составьте схемы электролиза раствора NiCl2 (анод угольный).
ОТВЕТ:На катоде могут разряжаться вода и катионы никеля. Т. к. величина потенциала никеля (φ0(Ni2+/Ni) = -0,25 В) близка к значению потенциалу восстановления воды, на катоде будут восстанавливаться и ионы металла, и вода. Конкурирующими анодными реакциями являются окисление воды и окисление хлорид – иона, на аноде окисляется ион хлора (объяснение смотрите выше).
Схема электролиза раствора NiCl2
(-) Катод: (+) Анод:
Ni2+ + 2ē → Ni 2Cl- -2ē → Cl2
2Н2О + 2ē → Н2 + 2ОН-
Ni2+
Общая реакция электролиза хлорида никеля (II) –
2NiCl2 + 2Н2О → Ni + Ni(OH)2 + H2 + 2Cl2
ПРИМЕР 2:В чём состоит различие процессов электролитического разложения раствора сульфата меди на угольном и медном анодах?
ОТВЕТ:На катоде могут разряжаться вода и катионы меди. Так как потенциал восстановления катионов меди (II) больше потенциала восстановления воды, восстанавливаться будут ионы меди.
Конкурирующими анодными реакциями (угольный анод) являются окисление воды и окисление сульфат – иона.
Так как φ0 (S2O82-/2SO42-) > φ0 (O2 + 4Н+/2Н2O), следовательно, на аноде окисляется вода.
Схема электролиза раствора CuSO4 на угольном аноде
(-) Катод: (+) Анод:
Сu2+ + 2ē → Cu 2Н2О - 4ē → О2 + 4Н+
2SO42-
При использовании медного анода окислению подвергается материал анода - медь, в результате чего анод будет растворяться.
Схема электролиза раствора CuSO4 на медном аноде
(-) Катод: (+) Анод:
Сu2+ + 2ē → Cu Сu - 2ē → Cu2+
SO42-
Следовательно, электролиз растворов сульфата меди (II) на угольном и растворимом аноде отличаются анодными процессами. При электролизе на инертном аноде окисляется вода, образуя кислород и кислоту, в случае растворимого анода данные процессы происходить не будут.
Процессы, протекающие при электролизе, подчиняются законам Фарадея.
I. Масса электролита, подвергшаяся превращению при электролизе, а также массы образующихся веществ прямо пропорциональны количеству электричества, прошедшего через электролит.
m = k ∙ q
где m - масса (г) образовавшегося, или подвергшегося превращению вещества;
q – количество электричества, прошедшего через электролит (Кл),
q = J ∙ t,
где J – сила тока, А; t – время, с.
k – электрохимический эквивалент.
Электрохимический эквивалент численно равен массе вещества, выделяемого 1 Кл электричества.
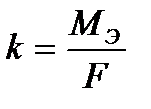
где МЭ – молярная масса эквивалента, г/моль-экв;
F – постоянная Фарадея, равная 96500 Кл.
Постоянная Фарадея – это количество электричества, необходимое для осуществления электрохимического превращения одного моль эквивалента вещества.
Подставив все параметры, получим выражение:
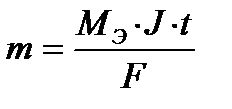
II. При электролизе различных электролитов равные количества электричества выделяют на электродах массы веществ, пропорциональные их эквивалентным массам.
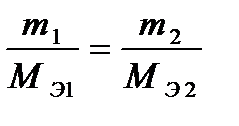
ПРИМЕР 3:Рассчитайте массы веществ, образовавшихся на электродах при электролизе раствора сульфата меди (II) (на инертном аноде) при пропускании тока силой 10 А в течение 30 минут.
ОТВЕТ:Схема электролиза раствора сульфата меди (II) на угольном аноде рассмотрена в примере 4. Суммарное уравнение электролиза раствора CuSO4:
2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4.
На катоде образуется медь, на аноде – кислород. Для определения масс меди и кислорода воспользуемся первым законом Фарадея.
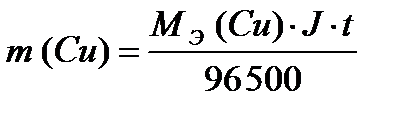 ;
; 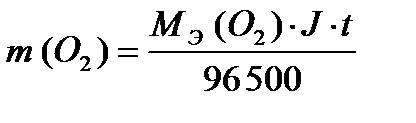
MЭ (Cu) = 63,55/2 = 31,78 г/моль-экв
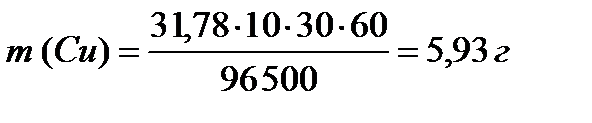
MЭ (О2) = 32/4 = 8 г/моль-экв
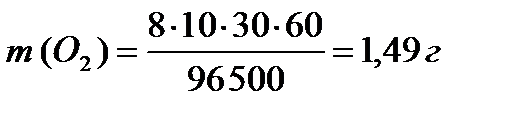 .
.
ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ
121.Составьте схемы электролиза растворов веществ (на угольных анодах): K2SO4; NiCl2. При электролизе какого из предложенных вам веществ выделяется кислород? Сколько кислорода выделится при электролизе током силой 30 А в течение 1,5 часов?
122. Составьте схемы электролиза растворов веществ (на угольных анодах): NaOH; AgNO3. При электролизе, какого из предложенных вам веществ выделяется водород? Сколько водорода выделится при электролизе током силой 25 А в течение одних суток?
123. Составьте схемы электролиза растворов веществ (на угольных анодах): H2SO4; CaCl2. Сколько грамм серной кислоты подвергнется электролитическому разложению в течение 20 мин под действием тока силой 120 А?
124. Составьте схемы электролиза растворов веществ (на угольных анодах): NaNO3; SnCl2. Какое соединение образуется на катоде при электролизе нитрата натрия? Найдите его массу, если электролиз протекал 2 часа с силой тока 100 А.
125. Составьте схемы электролиза растворов веществ (на угольных анодах): CuSO4; FeCl2. Сколько грамм меди выделится на электроде при пропускании через раствор электролита заряда 241,25 Кл?
126. Составьте схемы электролиза растворов веществ (на угольных анодах): HCl; Cr(NO3)2. Рассчитайте силу тока, который выделит 50 г водорода из раствора HCl в течение 20 мин.
127. Составьте схемы электролиза растворов веществ (на угольных анодах): KOH; CuCl2. Найдите силу тока, с которой проводят электролиз раствора CuCl2, массой 16,79 г, в течение 20 мин.
128. Составьте схемы электролиза растворов веществ (на угольных анодах): AgNO3; CoCl2. Определите массу серебра, выделившегося на катоде при пропускании через раствор нитрата серебра тока силой 50 А в течение 50 мин.
129. Составьте схемы электролиза растворов веществ (на угольных анодах): BeCl2; CdSO4. Рассчитайте электрохимический эквивалент хлорида бериллия.
130. Составьте схемы электролиза растворов веществ (на угольных анодах): HNO3; CuBr2. При электролизе какого из предложенных вам соединений образуется водород? Определите объём водорода, если электролитическое разложение проводят током силой 200 А в течение 2 часов.
131. Составьте схемы электролиза растворов веществ (на угольных анодах): Ca(OH)2; NiCl2. Какое количество электричества необходимо для электрохимического превращения 34 г гидроксида кальция?
132. Составьте схемы электролиза растворов веществ (на угольных анодах): PtCl2; Sn(NO3)2. Как долго нужно проводить электролиз для получения 19,5 г платины, если сила тока составляет 120 А?
133. Составьте схемы электролиза растворов веществ (на угольных анодах): CuCl2; FeSO4. В течение какого времени осуществляется электролитическое разложение 38 г хлорида меди, содержащихся в растворе? Сила тока равна 65 А.
134. Составьте схемы электролиза растворов веществ (на угольных анодах): Ba(OH)2; NaCl. При электролизе какого из предложенных вам соединений образуется кислород? Определите объём кислорода, если электролитическое разложение проводят током силой 40 А в течение 1 часа.
135. Составьте схемы электролиза растворов веществ (на угольных анодах): MnBr2; Ni(NO3)2. Определите электрохимические эквиваленты веществ, образующихся на катоде при электролизе нитрата никеля(II).
136. Cоставьте схемы электролизов раствора AgNO3, протекающих на угольном и растворимом серебряном анодах. В чём будет заключаться различие? Определите массу серебра, выделившегося на катоде при пропускании тока силой 100 А в течение 30 мин через раствор AgNO3?
137. Cоставьте схемы электролиза растворов Zn(NO3)2, протекающих на угольном и растворимом цинковом анодах. В чём будет заключаться различие? Определите объём газа выделившегося на катоде при пропускании тока силой 50 А в течение 10 мин через раствор Zn(NO3)2?
138. Cоставьте схемы электролиза растворов NiCl2, протекающих на угольном и растворимом никелевом анодах. В чём будет заключаться различие? Какой заряд нужно пропустить через раствор хлорида никеля (угольный анод), чтобы подвергнуть превращению 0,325г хлорида никеля?
139. Cоставьте схемы электролиза растворов Ti(NO3)2, протекающих на угольном и растворимом титановом анодах. В чём будет заключаться различие? Определите силу тока, пропускаемого через раствор Ti(NO3)2 в течение 20 мин, если объём газа, выделившегося на аноде, составляет 2,79 л (угольный анод)?
140. Cоставьте схемы электролиза растворов CoCl2, протекающих на угольном и растворимом кобальтовом анодах. В чём будет заключаться различие? Рассчитайте электрохимический эквивалент выделившегося на аноде продукта (электролиз проводят на угольном аноде).
КОРРОЗИЯ МЕТАЛЛОВ
КОРРОЗИЯ -процесс самопроизвольного разрушения металлов и сплавов под действием окружающей среды; данный процесс является окислительно-восстановительным и протекает на границе раздела фаз.
По механизму протекания коррозионного процесса, который зависит от характера внешней среды, различают химическую и электрохимическую коррозию.
Химическая коррозия – самопроизвольное разрушение металла или сплава в окислительных средах, которые не проводят электрический ток.
К ней относятся:
а) высокотемпературная коррозия в атмосфере сухих газов, т.е. при отсутствии конденсации влаги на поверхности металла или сплава (сухой воздух, хлор, сероводород и т.д.);
б) коррозия в жидких неэлектропроводных средах. К ним относятся жидкости органического происхождения (бензин, керосин, сернистая нефть и т.д.), а также ряд жидкостей неорганического происхождения ( расплавленная сера, жидкий бром и др.).
Сущность химической коррозии сводится к окислительно-восстановительной реакции, которая протекает между металлом или сплавом и окислителем.
Например, хМе + у/2 О2 = МехОу
ПРИМЕР1: Рассмотрите процесс коррозии цинковой пластины в атмосфере сухого сероводорода при температуре 400К.
ОТВЕТ: В атмосфере любого сухого газа при высоких температурах протекает химическая коррозия, сущность которой, в данном случае, сводится к окислительно-восстановительной реакции между металлом (Zn) и окислителем (H2S):
Zn + H2S = ZnS + H2
Zn – 2e = Zn2+ | 1
2H+ + 2e = H2 |1
Продуктом коррозии является сульфид цинка.
ПРИМЕР 2: Опишите процесс коррозии железного гвоздя, помещенного в бензин, который насыщен кислородом.
ОТВЕТ: В чистом виде органические растворители не реагируют с металлами, но в присутствии примесей химическое взаимодействие протекает интенсивно. В данном случае будет протекать химическое взаимодействие между железом и кислородом:
4Fe + 3O2 = 2Fe2O3
Fe – 3e = Fe3+ | 4
O2 + 4e = 2O2- | 3
Электрохимическая коррозия –самопроизвольное разрушение металла или сплава в среде электролита:
- в растворах электролитов (растворы щелочей, кислот и солей; морская вода);
- в атмосфере любого влажного газа;
- в почве
При электрохимической коррозии протекают раздельно два процесса: окисление на анодных участках и восстановление на катодных участках, при этом образуется коррозионный элемент:
nē
Ме1 / Д / Ме2
nē
где Д – деполяризатор.
Схематично процесс электрохимической коррозии можно описать следующими электродными процессами:
Анодные участки: Ме – nе = Меn+
Катодные участки: Д + nе = Дn-
Катодный процесс зависит от кислотности среды (рН):
а) если рН< 7 (в растворах кислот и солей, гидролизующихся по катиону), то деполяризатором являются ионы водорода Н+, и на катодных участках осуществляется водородная деполяризация, протекающая по схеме:
2Н+ + 2е = Н2.
б) если рН ≥ 7 (в нейтральных и щелочных средах), то деполяризатором являются молекулы кислорода, растворенные в электролите, и на катодных участках осуществляется кислородная деполяризация, протекающая по схеме:
О2 + 2Н2О + 4е = 4ОН-.
ПРИМЕР 3: Рассмотрите химические процессы, протекающие при контакте цинковой и свинцовой пластин, погруженных в раствор хлорида аммония.
ОТВЕТ: В данном случае мы имеем дело с контактной электрохимической коррозией. Е0(Zn/Zn2+) = -0,76B, a E0(Pb/Pb2+) = -0,13 B. Следовательно, цинк, характеризующийся более низким значением электродного потенциала, будет проявлять свойства анода, а свинец с большим значением электродного потенциала – свойства катода.
В водном растворе хлорид аммония подвергается процессу гидролиза по катиону слабого основания :
NH4Cl = NH4+ + Cl-
NH4Cl + H2O ↔ NH4OH + HCl
NH4+ + HOH ↔ NH4OH + H+
В результате гидролиза среда раствора становится кислой, т.к. накапливаются ионы водорода Н+ (pH < 7), следовательно, деполяризатором являются ионы водорода Н+, а на катодных участках осуществляется водородная деполяризация
Строение и работа коррозионного элемента описывается следующей схемой:
2ē
(-) Zn / NH4Cl + H2O + O2 / Pb (+)
NH4ОН + HCl
2ē
Анодные участки : Zn – 2e = Zn2+
Катодные участки: 2H+ + 2e = H2 (pH< 7)
Суммарное уравнение коррозии: Zn + 2H+ = Zn2+ + H2
Продуктом коррозии является хлорид цинка.
ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ
141.Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, , и схему коррозионного элемента для случая электрохимической коррозии.
а) Шероховатая железная пластинка в среде газообразного хлора при Т>573 К;
б) Какой из двух металлов (Fe/Ti), контактирующих в конструкции, будет подвергаться разрушению? Металлическое изделие находится в растворе CuCl2;
142.Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, , и схему коррозионного элемента для случая электрохимической коррозии.
а/ Полированная пластина из углеродистой стали в сухом хлороводороде при Т>300 К;
б/ Каким - анодным или катодным – покрытием будет цинк, если изделие изготовлено из железа? Напишите схему коррозионного процесса, протекающего при нарушении целостности покрытия в растворе (NH4)2SO4 .
143.Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Полированная алюминиевая пластина в сухом воздухе при Т>400К;
б/ В качестве протектора для защиты от коррозии стальных изделий используют алюминий. Составьте схему процессов, лежащих в основе защитного действия протектора, протекающих в растворе Mn(NO3)2 .
144.Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Шероховатая железная пластинка в сухом воздухе при Т>373К;
б/ Какой из двух металлов (Cu/Ti), контактирующих в конструкции, будет подвергаться разрушению. Металлическое изделие находится в растворе К2S;
145.Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Шероховатая цинковая пластинка в сухом сероводороде при Т>300К;
б/ Каким - анодным или катодным – покрытием будет хром, если изделие изготовлено из железа? Напишите схему коррозионного процесса, протекающего при нарушении целостности покрытия в растворе Cu(NO3)2
146.Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Изогнутая пластина из углеродистой стали в сухом хлороводороде при Т>300К;
б/ В качестве протектора для защиты от коррозии стальных изделий используют марганец. Составьте схему процессов, лежащих в основе защитного действия протектора, протекающих в растворе NaНCO3.
147.Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Шероховатая алюминиевая пластина в водяном паре при Т>423К;
б/ К какому типу покрытия относится олово на меди? Напишите схему коррозионного процесса, протекающего при нарушении целостности покрытия в растворе сульфида калия?
148.Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Полированная цинковая пластина в сухом сероводороде при Т>360К;
б/ магниево-алюминивый сплав эксплуатируется во влажной атмосфере воздуха.
149.Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Изогнутая пластина из углеродистой стали в насыщенном кислородом бензине при Т=298К;
б/ алюминиевое изделие с медными заклепками находится в растворе Na2SO3 при Т=298 К.
150.Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Полированная алюминиевая пластина в сухом воздухе при Т>398К;
б/Каким - анодным или катодным – покрытием будет олово, если изделие изготовлено из железа? Напишите схему коррозионного процесса, протекающего при нарушении целостности покрытия в растворе карбоната натрия.
151.Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Полированная пластина из углеродистой стали в сухом хлороводороде при Т>350К;
б/ В качестве протектора для защиты от коррозии стальных изделий используют цинк. Составьте схему процессов, лежащих в основе защитного действия протектора, протекающих в морской воде.
152. Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Шероховатая железная пластинка в насыщенном кислородом керосине при Т>298К;
б/ пластина из латуни (сплав цинка с медью) эксплуатируется в растворе серной кислоты.
153.Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Полированная пластина из углеродистой стали в насыщенном хлором керосине при Т=298К;
б/ медное изделия, паянное серебром эксплуатируется в растворе КОН.
154.Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Полированная цинковая пластина во влажном воздухе при Т>300К;
б/ Какой из двух металлов (Cr/Sn), контактирующих в конструкции, будет подвергаться разрушению? Металлическое изделие находится в растворе CuCl2;
155.Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Полированная железная пластина в водяном паре при Т>473К;
б/ биметаллическая композиция Cu/Ag в растворе KCl при Т=298 К.
156.Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/Шероховатая алюминиевая пластинка в сухом хлороводороде при Т>380К;
б/ Какой из двух металлов (Cu/Fe), контактирующих в конструкции, будет подвергаться разрушению? Металлическое изделие находится в растворе Na2SO3;
157.Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Шероховатая медная пластинка в сухом сероводороде при Т>330К;
б/ В качестве протектора для защиты от коррозии стальных изделий используют цинк. Составьте схему процессов, лежащих в основе защитного действия протектора, протекающих в растворе сульфата алюминия.
158.Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Полированная пластина из углеродистой стали в газообразном хлоре при Т>398К;
б/ гальванопара Al/Hg находится в нейтральной водной среде.
159.Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Полированная пластина из углеродистой стали в сухих парах брома при Т>320К;
б/ Какой из двух металлов (Pb/Cu), контактирующих в конструкции, будет подвергаться разрушению? Металлическое изделие находится в растворе FeCl2;
160.Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Полированная алюминиевая пластина в насыщенном кислородом керосине при Т=298К;
б/ стальное изделие, паянное оловом эксплуатируется в среде соляной кислоты.
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Комплексными соединениями называются химические соединения, образованные сочетанием отдельных компонентов и представляющие собой сложные ионы или молекулы, способные существовать как в кристаллическом, так и в растворенном состоянии.
По координационной теории Вернера в каждом комплексном соединении различают внутреннюю и внешнюю сферы. При написании химических формул комплексных соединений внутреннюю сферу (или, по-другому, комплексный ион) заключают в квадратные скобки. Например, в комплексном соединении K2[Cd(CN)4] внутренняя сфера (комплексный ион) представлена ионом [Cd(CN)4]2-, а внешняя сфера – двумя положительно заряженными ионами К+.
Центральный атом внутренней сферы комплексного соединения (обычно положительно заряженный), вокруг которого группируются ионы или молекулы, называется комплексообразователем. Комплексообразователями являются ионы металлов, имеющие достаточное число свободных орбиталей. К ним относятся ионы p-, d- и f-элементов В данном примере это ион кадмия Cd2+ (d-элемннт)..
Частицы, непосредственно связанные с комплексообразователем, называются лигандами. Лигандами могут быть как противоположно заряженные ионы (например, Cl-, CN-, OH- и т.д.), так и нейтральные молекулы (например, Н2О, NH3, CO и т.д.). В приведенном выше примере это ионы CN-.
Количество лигандов, присоединенных к комплесообразователю, называется координационным числом комплексообразователя. Координационное число показывает число мест во внутренней сфере комплексного соединения или число мест вокруг комплексообразователя, на которых могут размещаться лиганды. В комплексном соединении K2[Cd(CN)4] координационное число равно 4, т.к. комплексообразователь Cd2+ присоединяет четыре иона CN-.
ПРИМЕР 1.Определите заряд комплексного иона и степень окисления комплесообразователя в соединении [Cr(H2O)4(NH3)Cl]Cl2.
РЕШЕНИЕ:
1) Заряд комплексного иона численно равен суммарному заряду иона внешней сферы и противоположен ему по знаку.
Во внешней сфере данного комплексного соединения находятся два отрицательно заряженных иона Cl-. Следовательно, комплексный ион имеет два положительных заряда - [Cr(H2O)4(NH3)Cl]2+.
2) Степень окисления комплексообразователя определяется так же, как степень окисления атома в любом ионе, исходя из того, что сумма степеней окисления всех атомов в ионе равна заряду иона. Заряды нейтральных молекул равны нулю, заряды кислотных остатков определяют из формул соответствующих кислот.
В комплексном ионе [Cr(H2O)4(NH3)Cl]2+ нейтральные молекулы Н2О и NH3 имеют заряд равный нулю, а хлорид ион имеет заряд Cl-1. Исходя из этого, определяем степень окисления хрома: х = 4·0 + 0 + (-1) = +2. Отсюда, х = +3. Т.е. степень окисления комплексообразователя равна +3 (Cr+3).
ПРИМЕР 2. Напишите координационную формулу комплексного соединения BiJ3·KJ. Координационное число висмута равно четырем.
РЕШЕНИЕ. Согласно координационной теории Вернера комплексообразователем будет ион Bi3+, т.к. он является р-элементом. Лиганды - противоположно заряженные ионы J-. Следовательно, внутренняя сфера комплексного соединения имеет вид: [BiJ4]-. Внешней сферой является ион К+. Напишем координационную формулу комплексного соединения: К[BiJ4]-.
В зависимости от заряда внутренней сферы различают:
1) катионные комплексы – комплексные соединения с положительным зарядом внутренней сферы. Например, [Cu(NH3)4]SO4;
2) анионные комплексы – комплексные соединения с отрицательным зарядом внутренней сферы. Например, K3[Cr(NO2)6];
3) нейтральный комплекс – комплексное соединение, представленное только одной внутренней сферой, которая является электронейтральной. Например, [Cr(H2O)3Cl3]. Нейтральные комплексы являются неэлектролитами.
Комплексные соединения, содержащие ионы внешней сферы, являются сильными электролитами, т.к. в водном растворе они диссоциируют на ионы внешней сферы и комплексный ион.
K2[PtCl6] → 2K+ + [PtCl6]2- (1)
Комплексный ион диссоциирует лишь в незначительной степени (данный процесс обратимый), т.к. проявляет свойства слабого электролита :
[PtCl6]2- ↔ Pt4+ + 6Cl- (2)
Обратимый процесс (2) характеризуется константой равновесия, которая называется константой нестойкости комплексного иона (Кнест):
Кнест = [Pt4+] [Cl-]6 / [PtCl62-] (3)
Значения констант нестойкости различных комплексных ионов колеблются в широких пределах и могут служить мерой устойчивости комплекса. Чем меньше величина Кнест, тем устойчивее комплексный ион, т.е., тем меньше в растворе относительные концентрации комплексообразователя и лигандов. И наоборот.
ПРИМЕР 3. Константы нестойкости комплексных ионов [Co(NH3)6]3+, [Fe(CN)6]3- соответственно равны 6,2·10-36 и 1,0·10-44. Какой из этих ионов является более прочным? Напишите для этого иона уравнение диссоциации и выражение для константы нестойкости.
РЕШЕНИЕ. Зная, что константа нестойкости служит мерой устойчивости комплексного иона, сравним значения Кнест данных ионов. Наиболее прочным ионом будет ион [Fe(CN)6]3-, т.к. для него значение Кнест является наименьшим. Напишем уравнение диссоциации и выражение для Кнест этого иона:
[Fe(CN)6}3- ↔ Fe3+ + 6CN-
Кнест = [Fe3+] [ CN-]6 / [Fe(CN)63-]
ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ
161. Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях: [Cr (NH3)5Cl]Cl2, K2[Cu(CN)6]. Напишите уравнения диссоциации этих соединений в водных растворах и выражения для Кнест.
162. Из раствора комплексной соли PtCl4·6NH3 нитрат серебра осаждает весь хлор в виде хлорида серебра, а из раствора соли PtCl4·3NH3 – только 1/4 часть входящего в ее состав хлора. Написать координационные формулы этих солей, уравнения диссоциации и выражения для константы нестойкости.
163.Константы нестойкости комплексных ионов [HgCl4]2-, [HgBr4]2- и [HgJ4]2- соответственно равны 8,5·10-18, 1,0·10-21 и 1,5·10-30. Какой из указанных ионов обладает меньшей устойчивостью? Запишите для него уравнение диссоциации и выражение для Кнест, а также координационную формулу соединения, содержащего этот комплексный ион.
164. Составьте координационные формулы следующих соединений серебра: AgCl·2NH3, AgCN·KCN. Координационное число серебра равно двум. Напишите уравнения диссоциации этих соединений в водном растворе и выражения для Кнест.
165. Напишите координационную формулу комплексного иона, в котором комплексообразователем с координационным числом, равным 6, является ион Fe3+, а лигандами – ионы F-. Чему равен заряд этого иона? Напишите для него уравнение диссоциации и выражение для Кнест.
166. Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях: [Zn(NH3)4]SO4, K4[Fe(CN)6]. Напишите уравнения диссоциации этих соединений в водных растворах и выражения для Кнест.
167. Из раствора комплексной соли CoCl3·6NH3 нитрат серебра осаждает весь хлор, а из раствора соли CoCl3·5NH3 – только две трети хлора. Написать координационные формулы этих солей, уравнения диссоциации и выражения для константы нестойкости.
168. Константы нестойкости комплексных ионов [CdBr4]4-, [Cd(NH3)4]2+ и [CdCl4]2- соответственно равны 2·10-4, 8·10-8 и 8·10-2. Укажите, в каком растворе, содержащем эти ионы в равной молярной концентрации, содержится меньше ионов Cd2+? Запишите для него уравнение диссоциации и выражение для Кнест, а также координационную формулу соединения, содержащего этот комплексный ион.
169. Составьте координационные формулы следующих соединений кобальта: 3NaNO2·Co(NO2)3, 2KNO2·NH3·Co(NO2)3. Координационное число кобальта равно шести. Напишите уравнения диссоциации этих соединений в водном растворе и выражения для Кнест.
170. Напишите координационную формулу комплексного иона, в котором комплексообразователем с координационным числом, равным 4, является ион Cu2+ , а лигандами – молекулы воды. Чему равен заряд этого иона? Напишите для него уравнение диссоциации и выражение для Кнест.
171. Гидроксид алюминия растворяется в избытке щелочи, образуя гидроксосоединение с координационным числом 6. Какова формула этого соединения? Напишите для него уравнение диссоциации и выражение для Кнест.
172. По какому пути преимущественно пойдет реакция растворения хлорида серебра в растворе, содержащем ионы Br-, CN- и молекулы NH3, концентрация которых одинаковые, если константы нестойкости комплексных ионов [Ag(NH3)2]+, [AgBr2]- и [Ag(CN)2]- соответственно равны 6,8·10-8, 7,8·10-8 и 1,0·10-21? Напишите для этого иона уравнение диссоциации и выражение для Кнест.
173. Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях: [Ag(NH3)2]Cl, K3[Al(OH)6] Напишите уравнения диссоциации этих соединений в водных растворах и выражения для Кнест.
174. Из раствора комплексной соли CrCl3·6H2O нитрат серебра осаждает все хлорид- ионы, а из раствора соли CrCl3·5H2O – только две трети части, входящих в ее состав хлорид-ионов. Написать координационные формулы этих солей, уравнения диссоциации и выражения для константы нестойкости.
175. Константы нестойкости комплексных ионов [Ag(CNS)2]-, [Ag(S2O3)2]3- и [Ag(NO2)2]- соответственно равны 2·10-11, 1,0·10-13 и 1,3·10-3. Укажите, в каком растворе, содержащем эти ионы в равной молярной концентрации, содержится больше ионов Ag+? Запишите для него уравнение диссоциации и выражение для Кнест, а также координационную формулу соединения, содержащего этот комплексный ион.
176. Составьте координационные формулы следующих соединений платины: PtCl2·3NH3, PtCl2·NH3·KCl. Координационное число платины равно четырем. Напишите уравнения диссоциации этих соединений в водном растворе и выражения для Кнест.
177. Гидроксид никеля (II) растворяется в избытке водного раствора аммиака, образуя аммиачный комплекс с координационным числом 6. Какова формула этого соединения? Напишите для него уравнение диссоциации и выражение для Кнест.
178. По какому пути преимущественно пойдет реакция растворения бромида серебра в растворе, содержащем ионы J-, CN- и молекулы NH3, концентрация которых одинаковые, если константы нестойкости комплексных ионов [Ag(NH3)2]+, [AgJ4]3- и [Ag(CN)2]- соответственно равны 6,8·10-8, 1,8·10-14 и 1,0·10-21? Напишите для этого иона уравнение диссоциации и выражение для Кнест.
179. Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях: [Cr(NH3)4Cl2]Cl, K2[HgJ4] Напишите уравнения диссоциации этих соединений в водных растворах и выражения для Кнест.
180. Напишите координационную формулу комплексного иона, в котором комплексообразователем с координационным числом, равным 6, является ион Fe2+ , а лигандами – ионы CN-. Чему равен заряд этого иона? Напишите для него уравнение диссоциации и выражение для Кнест.
