Реакции электрофильного замещения
Пятичленные гетероциклы вступают в реакции электрофильного замещения. К ним относятся реакции нитрования, сульфирования, галогенирования, ацилирования и алкилирования.
Для пятичленных гетероциклов они протекают в более мягких условиях, чем для бензола, так как пиррол, фуран и тиофен являются электроноизбыточными системами, что способствует электрофильному замещению. В связи с повышенной чувствительностью пятичленных гетероароматических соединений к сильным кислотам для реакции электрофильного замещения применяют модифицированные электрофильные реагенты, при использовании которых исключается кислая среда. С использованием таких реагентов реакции с пятичленными гетероциклами протекают в мягких условиях и с хорошими выходами. Реакции замещения идут в положение 2 (5) цикла.
Атака в положение 2:

Атака в положение 3:

В первом случае σ-комплекс более стабилен (3 резонансные структуры), во втором случае менее стабилен (2 резонансные структуры).
Рассмотрим реакции электрофильного замещения отдельно для каждого гетероцикла.
Электрофильное замещение в тиофене и его гомологах.
1) Хлорирование тиофена производится хлористым сульфурилом:

2) Сульфирование. Сульфируется тиофен 96%-ной серной кислотой с образованием 2-тиофенсульфокислоты:

3) Нитрование осуществляется ацетилнитратом
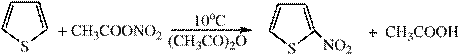
Ацетилнитрат может быть получен при взаимодействии азотной кислоты или медных солей с уксусным ангидридом.
4) Ацилирование. Тиофен легко ацилируется

5) Формилирование проводят диметилформамидом в присутствии POCl3
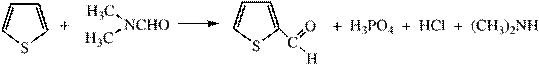
Получение ртутных производных

Бромирование
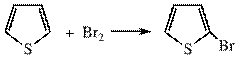
В качестве катализатора можно использовать LiBr. Для бромирования тиофена также можно использовать N-бромсукцинимид:

Йодирование

В качестве растворителя используют диоксан или водорастворимые спирты.
Для α-замещенных характерны реакции:
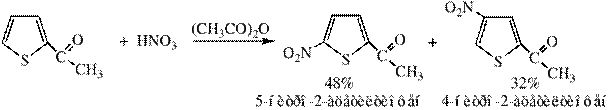
Использование различных условий позволяет изменить соотношение изомеров. Если реакцию проводить в сильнокислой среде, то будет образовываться 25% 5-нитро-2-ацетилтиофена и 75% 4-нитро-2-ацетилтиофена.
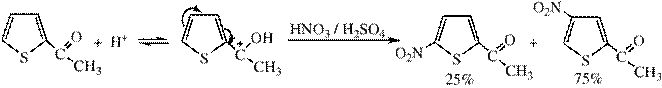
Электрофильное замещение в фуране и его производных
Реакции протекают в более мягких условиях, чем для тиофена. Часто эти реакции сопровождаются реакцией присоединения.
Бромирование

Сульфирование

Ацилирование

Нитрование
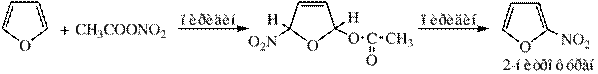
Образование ртутных производных
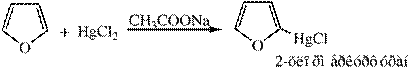
Реакции электрофильного замещения в пирроле
1) Нитрование. Пиррол нитруется ацетилнитратом

Сульфирование

3) Ацилирование пиррола проводят уксусным ангидридом при комнатной температуре
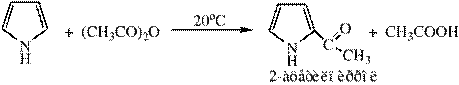
4)Взаимодействие пиррола с хлороформом и гидроксидом калия приводит к образованию альдегида:
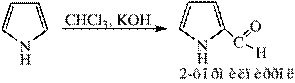
40.Шестичленные азотсодержащие гетероциклические соединения: строение, номенклатура, изомерия, основные методы синтеза, физические и химические свойства.
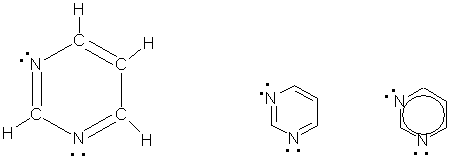
Пиридин C5H5N - простейший шестичленный ароматический гетероцикл с одним атомом азота. Его можно рассматривать как аналог бензола, в котором одна группа СН заменена на атом азота:

Пиримидин C 4H 4N 2 - шестичленный гетероцикл с двумя атомами азота. Его можно рассматривать как аналог бензола, в котором две группы СН заменены на атомы азота:
Благодаря наличию в кольце двух электроотрицательных атомов азота пиримидин еще менее активен в реакциях электрофильного замещения, чем пиридин. Его основные свойства также выражены слабее, чем у пиридина.
Основное значение пиримидина состоит в том, что он является родоначальником класса пиримидиновых оснований.
Строение:
ПИРИДИН. По электронному строению пиридин напоминает бензол. Все атомы углерода и атом азота находятся в состоянии sp2-гибридизации. Шесть электронов (по одному от каждого атома), находящихся на негибридных орбиталях, образуют p-электронную ароматическую систему. Из трех гибридных орбиталей атома азота две вступают в образование σ-связей C-N, а третья содержит неподеленную пару электронов .
пиримидин – шестичленный цикл, подобный пиридину, который отличается от него наличием в молекуле еще одного гетероатома (азота) вместо группы СН.
Номенклатура:
Названия ароматических гетероциклов, как правило, тривиальные, и они приняты номенклатурой ИЮПАК (см. схему 13.1).

В моноциклических соединениях нумерация атомов всегда начинается от гетероатома (примеры нумерации приведены выше). В гетероциклах с несколькими одинаковыми гетероатомами эти атомы получают наименьшие номера. Если имеются два атома азота с различным электронным строением (-N= и -NH-), то нумерацию ведут от фрагмента -NH-, как показано на примерах пиразола и имидазола. В гетероциклах с разными гетероатомами старшим считается кислород, далее сера и затем азот.
В конденсированных гетероциклах нумерацию ведут от одной из вершин бициклической структуры так, чтобы гетероатом полу- чил наименьший номер (см. примеры хинолина и изохинолина). Однако имеются исключения из этого правила, как, например, пурин (см. схему 13.1), для которого сохранена исторически сложившаяся нумерация.
Производные гетероциклов называют по общим правилам заместительной номенклатуры, где в качестве названий родоначальных структур приняты тривиальные названия гетероциклов. В приведенных примерах в скобках указаны также тривиальные названия некоторых производных.
Изомерия:
?????????????????????????7
Основные методы синтеза:
ПИРИДИН выделяют из каменноугольной смолы, в которой его содержание 0,08%. В лабораторных условиях пиридин можно синтезировать из синильной кислоты и ацетилена:
2HC≡CH + HC≡N 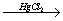 C5H5N.
C5H5N.
ПИРИМИДИН получают Из барбитуровой кислоты

Физические свойства:
Пиридин — бесцветная жидкость, немного легче воды, с характерным неприятным запахом; с водой смешивается в любых отношениях.
Пиримидин — бесцветные кристаллы с характерным запахом.
Химические свойства:
Химические свойства пиридина определяются наличием ароматической системы и атома азота с неподеленной электронной парой.
ПИРИДИН
1. Пиридин — более слабое основание, чем алифатические амины (Кb = 1,7.10-9). Его водный раствор окрашивает лакмус в синий цвет:

При взаимодействии пиридина с сильными кислотами образуются соли пиридиния:
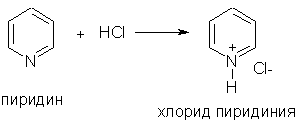
2. Ароматические свойства. Подобно бензолу, пиридин вступает в реакции электрофильного замещения, однако его активность в этих реакциях ниже, чем бензола, из-за большой электроотрицательности атома азота. Пиридин нитруется при 300 °С с низким выходом:

Атом азота в реакциях электрофильного замещения ведет себя как заместитель 2-го рода, поэтому электрофильное замещение происходит в мета-положение.
В отличие от бензола, пиридин способен вступать в реакции нуклеофильного замещения, поскольку атом азота оттягивает на себя электронную плотность из ароматической системы, и орто-пара-положения по отношению к атому азота обеднены электронами. Так, пиридин может реагировать с амидом натрия, образуя смесь орто- и пара-аминопиридинов (реакция Чичибабина):
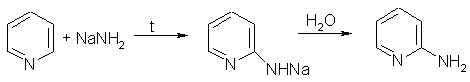
3. При гидрировании пиридина образуется пиперидин, который представляет собой циклический вторичный амин и является гораздо более сильным основанием, чем пиридин:

Пиримидин по химическим свойствам сходен с пиридином, но еще больше отличается от бензола. Имеет пониженную электронную плотность в положениях 2, 4, 6. Менее обеднено электронной плотностью положение 5.
1. Нуклеофильное замещение протекает легко. Лучше реакция идет при наличии заместителя в пиримидиновом кольце
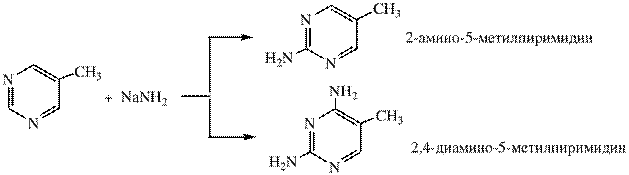
2. Электрофильное замещение в пиримидине происходит только при наличии сильного электронодонорного заместителя в кольце (ОН, NH2)
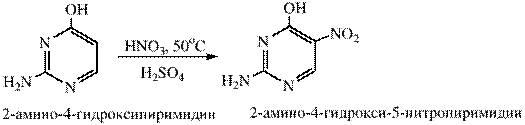
Галогенирование
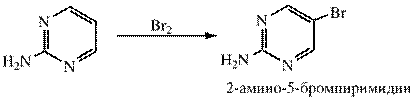
4. Гомологи пиридина по свойствам похожи на гомологи бензола. Так, при окислении боковых цепей образуются соответствующие карбоновые кислоты:

Никотиновая кислота и ее амид — важные лекарственные препараты
41. Нуклеиновые кислоты, нуклеотиды, нуклеозиды. Строение, свойства, источники. Роль в биохимических процессах.
Нуклеи́новая кисло́та (от лат. nucleus — ядро) — высокомолекулярное органическое соединение, биополимер (полинуклеотид), образованный остатками нуклеотидов.
Нуклеоти́ды — фосфорные эфиры нуклеозидов, нуклеозидфосфаты.
Нуклеозиды — это гликозиламины, содержащие азотистое основание, связанное с сахаром (рибозой или дезоксирибозой).
Строение:
Полимерные формы нуклеиновых кислот называют полинуклеотидами. Цепочки из нуклеотидов соединяются через остаток фосфорной кислоты (фосфодиэфирная связь). Поскольку в нуклеотидах существует только два типа гетероциклических молекул, рибоза и дезоксирибоза, то и имеется лишь два вида нуклеиновых кислот — дезоксирибонуклеиновая (ДНК) и рибонуклеиновая (РНК). Мономерные формы также встречаются в клетках и играют важную роль в процессах передачи сигналов или запасании энергии. Наиболее известный мономер РНК — АТФ, аденозинтрифосфорная кислота, важнейший аккумулятор энергии в клетке.
Нуклеотиды являются сложными эфирами нуклеозидов и фосфорных кислот. Нуклеозиды, в свою очередь, являются N-гликозидами, содержащими гетероциклический фрагмент, связанный через атом азота с C-1 атомом остатка сахара.
В природе наиболее распространены нуклеотиды, являющиеся β-N-гликозидами пуринов или пиримидинов и пентоз — D-рибозы или D-2-дезоксирибозы. В зависимости от структуры пентозы различают рибонуклеотиды и дезоксирибонуклеотиды, которые являются мономерами молекул сложных биологических полимеров (полинуклеотидов) — соответственно РНК или ДНК[1].
Фосфатный остаток в нуклеотидах обычно образует сложноэфирную связь с 2'-, 3'- или 5'-гидроксильными группами рибонуклеозидов, в случае 2'-дезоксинуклеозидов этерифицируются 3'- или 5'-гидроксильные группы.
Большинство нуклеотидов являются моноэфирами ортофосфорной кислоты, однако известны и диэфиры нуклеотидов, в которых этерифицированы два гидроксильных остатка — например, циклические нуклеотиды циклоаденин- и циклогуанин монофосфаты (цАМФ и цГМФ). Наряду с нуклеотидами — эфирами ортофосфорной кислоты (монофосфатами) в природе также распространены и моно- и диэфиры пирофосфорной кислоты (дифосфаты, например, аденозиндифосфат) и моноэфиры триполифосфорной кислоты (трифосфаты, например, аденозинтрифосфат).
Нуклеозиды - природные гликозиды, молекулы которых состоят из остатка пуринового или пиримидинового основания, связанного через атом N с остатком D-рибозы или 2-дезок-си-D-рибозы в фуранозной форме; в более широком смысле-природные и синтетические соединения, в молекулах которых гетероцикл через атом N или С связан с любым моносахаридом, иногда сильно модифицированным.
Свойства:
Нуклеиновые кислоты хорошо растворимы в воде, практически не растворимы в органических растворителях. Очень чувствительны к действию температуры и критическим значениям уровня pH. Молекулы ДНК с высокой молекулярной массой, выделенные из природных источников, способны фрагментироваться под действием механических сил, например при перемешивании раствора. Нуклеиновые кислоты фрагментируются ферментами — нуклеазами.
Нуклеотиды - ???
Нуклеозиды -кристаллич. в-ва, имеют характерные рН-зависимые УФ спектры . Обладают слабыми основными св-вами; их разл. склонность к протонированию используют для разделения нуклеозидов методами ионообменной хроматографии и электрофореза.
Источники:
Описаны многочисленные методики выделения нуклеиновых кислот из природных источников. Основными требованиями, предъявляемыми к методу выделения, являются эффективное отделения нуклеиновых кислот от белков, а также минимальная степень фрагментации полученных препаратов. Классический метод выделения ДНК был описан в 1952 году и используется в настоящее время без значительных изменений. Клеточные стенки исследуемого биологического материала разрушаются одним из стандартных методов, а затем обрабатываются анионным детергентом. При этом белки выпадают в осадок, а нуклеиновые кислоты остаются в водном растворе. ДНК может быть осаждена в виде геля осторожным добавлением этанола к её солевому раствору. Концентрацию полученной нуклеиновой кислоты, а также наличие примесей (белки, фенол) обычно определяют спектрофотометрически по поглощению на А260 нм. Нуклеиновые кислоты легко деградируют под действием особого класса ферментов — нуклеаз. В связи с этим при их выделении важно обработать лабораторное оборудование и материалы соответствующими ингибиторами. Так, например, при выделении РНК широко используется такой ингибитор рибонуклеаз как DEPC.
Нуклеиновые кислоты поступают с пищей в виде нуклеопротеидов, расщепление белковой части которых начинается уже в желудке и завершается в тонком кишечнике. Высвобождающиеся нуклеиновые кислоты расщепляются в тонком кишечнике до мононуклеотидов под действием рибонуклеаз и дезоксирибонуклеаз панкреатического сока. Кроме того, стенкой кишечника выделяются ферменты полинуклеотидазы и фосфодиэстеразы, которые также участвуют в расщеплении нуклеиновых кислот до мононуклеотидов.
Природные нуклеозиды получают преим. ферментативным гидролизом ДНК или щелочным гидролизом РНК с послед. ферментативным дефосфорилированием образующейся смеси нуклеотидов (нуклеозидфосфатов) и хроматографич. разделением. Существующие эффективные методы хим. синтеза используются гл. обр. для получения неприродных Н., однако постепенно, становясь все более экономичными, они распространяются на синтез природных Н. Обычно синтез Н. осуществляют взаимод. пертриметилсилилир. основания с перацилир. моносахаридом или ацилгалогенозой (глико-зидная группа ОН заменена на галоген, др. группы ОН ацилированы), оглавлением основания с перацетилир. моносахаридом или же конденсацией основания с ацилгалогенозой в присут. солей ртути. Др. путь синтеза-достройка гетероцикла в составе фрагмента, содержащего рибозу, с использованием подходящего синтона (см. Органический синтез); этот подход чаще всего используется в синтезе Н. с С-гликозидной связью. Синтетически получено множество Н., модифицированных по основанию и моносахариду (в т. ч. с линейной формой последнего вместо циклической), с a-конфигурацией N-гликозидной связи и т. д.
Роль в биохимических процессах:
Нуклеиновые кислоты ДНК и РНК присутствуют в клетках всех живых организмов и выполняют важнейшие функции по хранению, передаче и реализации наследственной информации.
Свободные нуклеотиды, в частности АТФ, цАМФ, АДФ, играют важную роль в энергетических и информационных внутриклеточных процессах, а также являются составляющими частями нуклеиновых кислот и многих коферментов.
Нуклеозиды используют как исходные в-ва в искусств. синтезе фрагментов ДНК (РНК) и синтезе нуклеотидов, в качестве лигандов в аффинной хроматографии, в химиотерапии вирусных, онкологич. и нек-рых др. заболеваний (напр., 3-азидо-3'-дезокситимидин, или азидотимидин,- против синдрома приобретенного иммунодефицита, рибоксин-при ишемической болезни сердца, l-b-D-арабинофуранозилцито-зин, или цитарабин,-противоопухолевый препарат).
