Растворы. Способы выражения концентраций
Титр раствора Т(В)веществаВ показывает массу растворенного вещества (г), содержащегося в 1 мл раствора.
Растворимостьюназывают способность одного вещества растворятся в другом с образованием насыщенного раствора. Чаще всего растворимость выражают числом r растворенного вещества на 100г или на 100 мл растворителя или раствора.
Растворимость газов зависит и от давления. Эта зависимость выражается законом Генри: масса газа, растворяющегося при данной температуре в жидкости данного объема, прямо пропорциональна давлению газа.
Раствор –это сложная однородная (гомогенная) система, состоящая из двух и более компонентов, относительные количества которых могут манятся в широких пределах без нарушения однородности.
Масса раствора складывается из суммы растворителя (А) и растворенного вещества (В):
M=m(A)+m(B)
Молярная концентрация эквивалентов 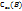 показывает сколько моль эквивалентов растворенного вещества В содержится в 1000мл или 1л раствора. Из определения следует аналогичное соотношение.
показывает сколько моль эквивалентов растворенного вещества В содержится в 1000мл или 1л раствора. Из определения следует аналогичное соотношение.
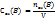
Где V – объем раствора, л.
Т.к. в одной ФЕ (формульной единице) вещества В может содержаться Z(B) Эквивалентов этого вещества, то: 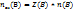 , где
, где 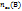 – это число моль – эквивалентов вещества В, n(B) число моль вещества В, Z(B)- число эквивалентности растворов вещества В.
– это число моль – эквивалентов вещества В, n(B) число моль вещества В, Z(B)- число эквивалентности растворов вещества В.
Например, молярная концентрация эквивалентов водного раствора KMn 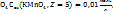 где Z – эквивалентное число
где Z – эквивалентное число 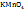 либо 0,01H раствор
либо 0,01H раствор 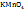 .
.
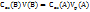
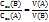
Основной характеристикой раствора является его состав, который определяет раствор качественно (из каких компонентов состоит раствор) и количественно (выражается концентрацией). Под концентрацией раствора понимают содержание растворенного вещества в определенном объеме (массе) раствора. К концентрированным растворам относятся растворы, в которых количество растворенного вещества сравнимо с количеством растворителя. К разбавленным относятся растворы, содержащие очень малое количество растворенного вещества по сравнению с количеством растворителя.
Массовая доля ω(В) растворенного вещества В – есть отношение массы растворенного вещества к общей массе раствора, выраженное в процентах. Массовая доля растворенного вещества показывает сколько грамм растворенного вещества содержится в 100г раствора.
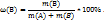
Можно также выражать массовую долю растворенного вещества 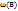 в долях единицы.
в долях единицы.
Пример. Общая масса раствора m = 6 кг. Масса растворенного вещества m(B) равна 1,5 кг.
Сольваты (гидраты, если растворитель – вода) представляют собой в большинстве случаев непрочные соединения, легко разлогающиеся при выделении их в свободном состоянии. Но иногда сольваты представляют собой прочные соединения, которые можно легко выделить из раствора путем кристаллизации. Кристаллические вещества, содержащие молекулы растворителя, называются кристаллосольватами (кристаллогидратами, если растворитель - вода). Примеры кристаллогидратов: 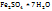 – железный купорос; Cu
– железный купорос; Cu 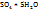 – медный купорос;
– медный купорос; 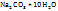 – сода и т.д. Вода, входящая в состав кристаллогидратов, называется кристаллизационной водой.
– сода и т.д. Вода, входящая в состав кристаллогидратов, называется кристаллизационной водой.
Примеры решения типовых задач
Пример 3.1. 17,5г 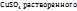 в 420мл воды. Рассчитайте массовую долю, моляльную, молярную концентрации и титр полученного раствора, если его плотность
в 420мл воды. Рассчитайте массовую долю, моляльную, молярную концентрации и титр полученного раствора, если его плотность 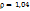 г/мл.
г/мл.
Решение. Расчет концентрации можно производить на основе определений соответствующих способов выражения состава растворе.
Определение массовой доли ω( 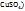 в %
в %
1. Найдем массу полученного раствора.
Т.к. 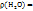 1 г/мл, то m(
1 г/мл, то m(  ) =
) =  *V = 1 г/мл * 420мл = 420г.
*V = 1 г/мл * 420мл = 420г.
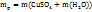 =17,5+420=437,5г
=17,5+420=437,5г
2. Рассчитаем массовую долю 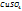 , %, в полученном растворе:
, %, в полученном растворе:
в 437,5г растворе содержится 17,5г 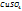
в 100г -----‘’----- x г 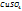
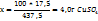
Т.е. массовая доля ω 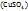 =4,0%
=4,0%
