ПСКР Концентрацию веществ в растворах можно выразить разными способами.
ПСКР Концентрацию веществ в растворах можно выразить разными способами.
Массовая доля – это безразмерная величина равная отношению массы растворенного вещества к общей массе раствора. W= m(в)/m(р)
Молярная концентрация – показывает столько моль растворенного вещества содержится в 1 литре раствора. С=n/V = m/M*V
М – молярная масса р.в [гр/моль]
Нормальность раствораобозначает число грамм – эквивалентов данного вещества в одном метре раствора или число миллиграмм – эквивалент в 1л. Грамм-эквивалент вещества наз-ся кол-во граммов в-ва, численно равное его эквиваленту.
Э (основания) = М(осн.)/число зам. В реакциях ОН группы Э (к-ты) = М (к-ты)/число зам атомов Н
Э (соли) = М(соли)/произв. числа катионов на его заряд
Мольные доли вещества –концентрация выраженная отношениями числа молей в-ва к общему числу молей всех в-в, имеющих в растворе.
Х=n/∑n
Моляность в-ва –кол-во раст вещества (число молей) в единице объема р-ра
См = n/V
Молялность – кол-во раст вещесвтва (число моль) в 1000гр растворителя
С= n/m
3) ЧПСТ Современное содержание этой теории можно свести к следующим трем положениям:1. Электролиты при растворении в воде распадаются(диссоциируют) на ионы положительные и отрицательные. простые ионы(Na+, Mg2+, Аl3+ и т.д.) сложные ионы (NО3—, SO2-4,РОЗ-4и т.д.).2.Под действием электрического тока ионы приобретают направленное движение: положитель заряженные ионы движутся к катоду, отрицательно заряженные — к аноду. Поэтому первые называются катионами, вторые — анионами.3. Диссоциация обратимый процесс:параллельно с распадом молекул на ионы(диссоциация)протекает процесс соединения ионов (ассоциация).Сильные электролиты все хорошо растворимые соли,сильные кислоты (HCl, HBr, HI HClO4, H2SO4, HNO3) и сильные основания(LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2, Sr(OH)2,Ca(OH)2). Слабые электролиты К слабым электролитам относятся:1) почти все органические кислоты (CH3COOH, C2H5COOH и др.); 2) некоторые неорганические кислоты (H2CO3, H2S и др.); 3) почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2;Cu(OH)2;Al(OH)3; NH4OH);4) вода.Активная концентрацияили активность иона Х –это эффективная(действующая)концентрация,соответственно которой ион действует в химической реакции.Активностьи равновесная концентрацияиона Х связаны выражением: a(Х) = f (Х) [X]
ПСРС
Вещества, подвергающиеся при взаимодействии с растворителем диссоциации на ионы и сообщающие раствору способность проводить электрический ток, называются электролитами.выделяют:– сильные электролиты – слабые электролиты
степенью диссоциации a, Для любого электролита:
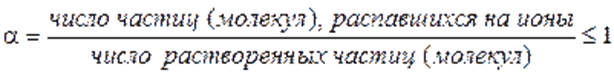
равновесие диссоциации слабого электролита
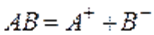 ,например
,например 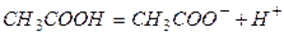
Константа диссоциации равна: 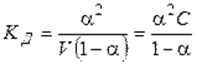
называют законом разведения Оствальда для бинарных электролитов.Проанализируем уравнение Оствальда: 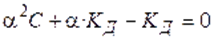
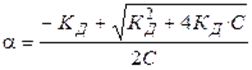
1). 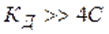
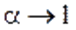 ;
;
2). 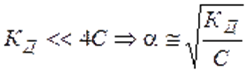 , т. е. степень диссоциации возрастает обратно пропоционально корню квадратному из концентрации электролита.
, т. е. степень диссоциации возрастает обратно пропоционально корню квадратному из концентрации электролита.
ДОПХ
Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.Предметом химической кинетики является изучение всех факторов, влияющих на скорость как суммарного процесса, так и всех промежуточных стадий. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: природа реагирующих веществ, наличие катализатора, температура (правило Вант-Гоффа) и площадь поверхности раздела фаз.
Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ. Это положение сформулировано в 1867 году норвежскими учёными К. Гульдбергом и П. Вааге. Для элементарной химической реакции:
{\displaystyle \nu _{1}\mathrm {A} _{1}+\nu _{2}\mathrm {A} _{2}+\nu _{3}\mathrm {A} _{3}\rightarrow \mathrm {B} }закон действующих масс может быть записан в виде кинетического уравнения вида:
ОВТН
скорость реакции с повышением температуры увеличивается. Если при повышении температуры не меняется механизм реакции, то увеличение скорости реакции определяется увеличением константы скорости реакции.
Для характеристики зависимости скорости химической реакции от температуры было введено понятие температурного коэффициента скорости (γ), равного отношению константы скорости при температуре (Т + 10) к константе скорости при температуре Т (т.е. γ показывает, во сколько раз изменяется константа скорости при увеличении температуры на 10 градусов):
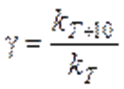 Экспериментально установлено, что повышение температуры на 10 К в области обычных температур (≈ 300 К) увеличивает скорость большинства гомогенных реакций в 2 ‑ 4 раза, т. е γ = (2 ‑ 4). Это правило называется правилом Вант–Гоффа.В общем случае отношение констант скорости реакции k2 и k1, определенных при двух различных температурах Т2 и Т1,равно
Экспериментально установлено, что повышение температуры на 10 К в области обычных температур (≈ 300 К) увеличивает скорость большинства гомогенных реакций в 2 ‑ 4 раза, т. е γ = (2 ‑ 4). Это правило называется правилом Вант–Гоффа.В общем случае отношение констант скорости реакции k2 и k1, определенных при двух различных температурах Т2 и Т1,равно 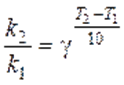
ПОКТ
Ката́лиз избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), Типы катализаКатализ бывает гомогенным и гетерогенным Гомогенный катализПримером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:H2О2 + I → H2О + IOH2О2 + IO → H2О + О2 + I Гетерогенный катализПри гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.Ингибитор общее название веществ, подавляющих или задерживающих течение физиологических и физико -химических (главным образом ферментативных) процессов. Катализа́тор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции. ФЕРМЕНТАТИВНЫЙКАТАЛИЗ (биокатализ),ускорени биохим. р-ций при участии белковых макромолекул, называемых ферментами. В простейшем случае ур-ние р-ции с участием фермента имеет вид: 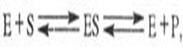
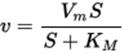 Превращение субстрата в продукт происходит в комплексе Михаэлиса. ОБРАЗЕТковалентные связи
Превращение субстрата в продукт происходит в комплексе Михаэлиса. ОБРАЗЕТковалентные связи
ДХКЩ
Соотношение кислоты и щелочи в каком-либо растворе называется кислотно-щелочным равновесием (КЩР), рН,или показатель кислотно-щелочного равновесия.0 — сильнейшая кислота, 14 — сильнейшая щелочь, 7 – нейтральное вещество.ещё кислотным сдвигом.или щелочной сдвиг.Наш организм имеет слабощелочную среду. Кислотно-щелочной баланс в нашем организме постоянно поддерживается на одном стабильном уровне и в очень узком диапазоне: от 7,26 до 7,45. И даже незначительное изменение рН крови, выходящее за эти границы, может привести к болезням.
Бу́ферные систе́мы кро́ви физиологические системы и механизмы, обеспечивающие заданные параметры кислотно-основного равновесия в крови[1]. Буферные системы крови слагаются следующими системами:
· Бикарбона́тная бу́ферная систе́ма;
· фосфа́тная бу́ферная систе́ма;
· белко́вая бу́ферная систе́ма;
· гемоглоби́новая бу́ферная система
· эритроциты
Гомеоста́з саморегуляция, способность открытой системы сохранять постоянство своего внутреннего состояния посредством скоординированных реакций, направленных на поддержание динамического равновесия.
ЧПСБ.
Буферные системы – растворы, способные сохранять приблизительно постоянное значение рН
Классификация буферных растворов:I Буферные растворы индивидуальных веществ: KHC4H4O6; KHC8H4O4Na2B4O7*10H2O II.Буферные растворы смеси веществ: ( CH3COOH + CH3COONa); (HCOOH + HCOONa); NH3*H2O + NH4Cl
2. Буферные системы из смеси различных веществ: ( KH2PO4 + Na2HPO4 HCl + NH2CH2COOH NaOH + KHC8H4O4 Механизмы действия Буферных систем. 1.Кислотный буфер Ацетатный буфер (CH3COOH +CH3COONa) . Механизм действия: - При добавлении сильной кислоты к буферной смеси, кислота реагирует с солью, 2. Основной буфер Аммиачный буфер( NH3*H2O + NH4Cl ). Механизм действия:- При добавлении сильной кислоты к буферной смеси, кислота реагирует со слабым основанием по реакции нейтрализация NH4OH+HCl = NH4Cl + H2O
· Буферная ёмкость раствора — способность раствора сохранять постоянной концентрацию определённых ионов
КСРЭ
Электролиты – это вещества, растворы которых проводят электрический ток посредством ионов на которые они распадаются под действием полярных молекул растворителя.
Коллигативными называются свойства растворов, которые не зависят от природы растворенного вещества. Зако́ны Ра́уля — общее название открытых французским химиком Ф. М. Раулем в 1887 году Первый закон Рауля связывает давление насыщенного пара над раствором с его составом; он формулируется следующим образом.
Растворы, для которых выполняется закон Рауля, называются идеальными.
Изотонический коэффициент – это не что иное, как параметр, который будет характеризовать поведение вещества в каком-либо растворе. Таким образом, изотонический коэффициент будет представлять собой смесь разных растворов каждого типа частиц. Если рассмотреть раствор хлорной извести, то можно увидеть, что он состоит из трех видов частиц: катионы кальция, гипохлорит, а также хлорид – анионы. Изотонический коэффициент будет показывать, что в растворе электролита имеется больше частиц, нежели в растворе неэлектролита. Коэффициент будет напрямую зависеть от того, может ли вещество распадаться на ионы – это не что иное, как свойство диссоциации.
ДПХР
Химическое равновесие — состояние химической системы, в которой протекает одна или несколько химических реакций, причём скорости в каждой паре прямой-обратной реакции равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.А2 + В2 ⇄ 2AB.
При́нцип Ле Шателье́ — Бра́уна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.Анри Ле Шателье (Франция) сформулировал этот термодинамический принцип подвижного равновесия, позже обобщённый Карлом Брауном .Принцип применим к равновесию любой природы: механическому, тепловому, химическому, электрическому (эффект Ленца, явление Пельтье).Если внешние условия изменяются, это приводит к изменению равновесных концентраций веществ. В этом случае говорят о нарушении или смещении химического равновесия.
НСВХ
Электролитами называют вещества, которые в полярных растворителях или в расплавленном виде распадаются на ионы и проводят электрический ток.
Сольвата́ция (от лат. solvo «растворяю») — электростатическое взаимодействие между частицами (ионами, молекулами) растворенного вещества и растворителя. Сольватация в водных растворах называется гидратацией. Образующиеся в результате сольватации молекулярные агрегаты называются сольватами. В
Гидратация (от др.-греч. ὕδωρ — вода) — присоединение молекул воды к молекулам или ионам. Гидратация является частным случаем сольватации — присоединения к молекулам или ионам веществ молекул органического растворителя. В отличие от гидролиза гидратация не сопровождается образованием водородных или гидроксильных ионов. Гидратация в водных растворах приводит к образованию стойких и нестойких соединений воды с растворенным веществом (гидратов);
• Гидратация непредельных углеводородов в присутствии концентрированной серной кислоты:
СН2=СН2 + Н2O → СН3—СН2—ОН
CH2=CH−CH3 + Н2O → CH3−CH(OH)−CH3
ДОСИ
электролиты в растворах распадаются на ионы вследствие электростатического взаимодействия с полярными молекулами растворителя.КtnАnm = nKtm+ +mAnn–
Cтепень диссоциации α равна отношению числа продиссоциировавших молекул n дисс к общему числу молекул n общ:
Степень диссоциации (ионизации) α – это число, показывающее, какая часть от общего количества молекул растворенного электролита распадается на ионы. константой электролитической диссоциации Кд. КtАn = Kt+ + An–[Kt+] и [An–] – равновесные концентрации продуктов диссоциации – ионов Kt+ + An–. [KtAn] – равновесная концентрация недиссоциированных молекул KtAn в растворе.cильные электролиты (α > 30%);
• средние электролиты (5% < α < 30%);
• слабые электролиты (α < 5%).
Если диссоциации подвергаются молекулы слабой кислоты, то константу диссоциации называют константой кислотности (Ка).Если диссоциации подвергаются молекулы слабого основания, то константу диссоциации называют константой основности (Кb):Величина константы диссоциации Кд характеризует способность электролита диссоциировать на ионы.Чем выше значениеКд, тем более сильным является электролит и в большей степени электролит распадается на ионы.
ЧПСК
Коллигативные свойства растворов — это свойства растворов, обусловленные только самопроизвольным движением молекул, то есть они определяются не химическим составом, а числом кинетических единиц — молекул в единице объёма или массы. К таким коллигативным свойствам относятся:
· ПОНИЖЕНИЕ ДАВЛЕНИЯ  насыщенного пара,
насыщенного пара,
· Повышение температуры кипения растворов,
· Понижение температуры замерзания растворов,
· Возникновение осмотического давления.
Первый закон РауляПар, находящийся в равновесии с жидкостью, называют насыщенным. Давление такого пара над чистым растворителем (p0)называют давлением или упругостью насыщен ного пара чистого растворителя.p = p0 · χр-ль,
Δp = i · p0 · χв-ваВторой закон Рауляповышение температуры кипения раствора равно и понижение температуры замерзания ΔTкип/зам= Kэб/кр · mв-ва
Правило Вант-ГоффаВант-Гофф считал, что скорость химической реакции – это закономерное изменение концентрации реагирующих веществ в единицу времени.
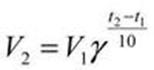
Правило Вант-Гоффа применимо только в температурном диапазоне 10-400оС.
Не подчиняются правилу Вант-Гоффа и реакции, в которых участвуют большие молекулы.
ДОХБ
Биогенные элементы подразделяют на три блока: s-, р-, d– блока. Химические элементы, в атомах которых заполняются электронами, s-подуровень внешнего уровня, называют s-элементами. Строение их валентного уровня ns1-2. Небольшой заряд ядра, большой размер атома способствуют тому, что атомы s-элементов – типичные активные металлы; показателем этого является невысокий потенциал их ионизации.Применение в медицине:
Хлорид натрия (NaCl) - раствор хлорида натрия (0,9% - физиологический раствор) применяется для внутривенных вливаний при больших кровопотерях. Гидрокарбонат натрия – NaHCO3 - Применяется в порошках, таблетках и растворах при повышенной кислотности желудочного сока, Виннокаменная соль КНС4Н4О6 –Применяется в микстурах и порошках как легкое слабительное.
Ацетат калия СН3СООК–является мочегонным средством, хорошо действует при сердечных и почечных отеках. Иодид калия используется для лечения глазных заболеваний – катаракты, глаукомы. Карбонат лития – применяют при лечении психических заболеваний и шизофрении. Магний - один из основных активаторов ферментативных процессов. Кальций –Кальций нужен для роста костей и зубов, образования молока у кормящих женщин, регулирования нормального ритма сокращения сердца, осуществления процесса свертывания крови.
ОБРК
1.Биологическая роль кислорода
Основной функцией кислорода является его участие как окислителя В покое организм взрослого человека потребляет 1,8-2,4 г кислорода в минуту.
2.Кислород необходим для дыхания живых организмов, для окисления углеводов, жиров и белков. Применяется в медицине для облегчения дыхания.Озон – очень сильный окислитель. Поэтому его используют для обеззараживания питьевой воды и отбеливания тканей. 3.Перекись водорода обладает универсальным противомикроб ным действием. Противомикробное действие Н2О2 связано с ее высокой окислительной активностью. Выделяющийся при ее раз-ложении микробными и тканевыми протеазами кислород окисляет сульфгидрильные и гидроксильные группы белков и ли-пидов, вызывая гибель микробов.озон вполне обеспечивает обеззаражива ние воды от бактерий, если вода предварительно осветлена или если. мутность природной воды ниже 3 мг/л. Это условие не является характерной чертой озонирования, так как предварительная очистка мутных вод обязательна при любых методах обеззараживания (при хлорировании, бактерицидном облучении и т. д.)
ДХМБ
Являются в организме человека в основном микроэлементами.Наряду с ферментами,гормонами,витаминами и другими биологически активными веществами микроэлементы участвуют в процессах обмена нуклеиновых кислот, белков,жиров и углеводов.Из d-элементов важную роль в организме играют железо,кобальт,цинк и молибден.Биологические функции микроэлементов в живом организме связаны главным образом с процессом комплексообразования между аминокислотами,белками, нуклеиновыми кислотами и ионами соответствующих металлов.Соединения d-элементов используются в качестве лекарственных препаратов, в избыточных концентрациях они ядовиты(это связано с тем, что d-элементы образуют с белками нерастворимые соединения).
ЧПСК
По координационной теории Вернера в каждом комплексном соединении различают внутреннюю и внешнюю сферы.
Несмотря на то что комплексные соединения известны были более двух столетий, понять причину их образования стало возможным благодаря исследованиям швейцарского ученого А. Вернера, предложившего в 1893 г. теорию, которая вошла в химию как координационная теория Вернера. Рассматривая строения комплекса железа Кз[Ре(СМ)б], мы практически познакомились с основными положениями этой теории, которые можно сформулировать следующим образом.
Координационная теория Вернера является руководящей в химии комплексных соединений и в настоящее время Согласно этой теории комплексное соединение состоит из внутренней и внешней сфер. Во внутреннюю сферу комплексного соединения входят комплексо образователь (центральный атом) и лиганды — атомы или их фуппы (молекулы или ионы), которые координированы центральным атомом. Внутренняя сфера может быть положительно или отрицательно заряженной (тогда внешняя сфера представляет собой простой анион или катион) или нейтральной (тогда внешней сферы нет вообше) встречаются соединения, когда и катион и анион одновременно являются комгшексными ионами.
ДКСВ
В растворах комплексные соединения могут подвергаться первичной и вторичной диссоциации. В водных растворах первичная диссоциация комплексных соединений обусловлена разрывом ионной связи между внутренней и внешней сферами, она практически необратима:
K3[Fe(CN)6] ® 3K+ + [Fe(CN)6]3–
Na[Al(OH)4] ® Na+ + [Al(OH)4]–
[Cu(NH3)4]SO4 ® [Cu(NH3)4]2+ + SO42–
[Pt(NH3)4Cl2]Cl2 ® [Pt(NH3)4Cl2]2+ + 2Cl–
Образующийся комплексный ион ведет себя как целая самостоятельная частица с характерными для нее свойствами. Процесс комплексообразования можно выразить и через так называемыесуммарные константы устойчивости –
| M + L↔[ML] | β1 = K1 = [ML]/([M]·[L]) |
| M+2L↔[ML2] | β2= K1·K2 =[ML2]/([M]·[L]2) |
| M+nL↔[MLn] | βn =K1·K2·…·Kn =[MLn]/([M]·[L]n) |
Константы устойчивости характеризуют прочность комплекса в растворе, которая увеличивается с ростом их значения.Процесс диссоциации также можно охарактеризовать с помощью констант, называемых константами нестойкости комплексов:
| [MLn] ↔ MLn-1 + L | Kn = ([MLn-1]·[L])/[MLn] |
| [MLn-1] ↔ MLn-2 + L | Kн2 =1/Kn1 =([MLn2 ]·[L])/ [MLn-1] |
| [ML] ↔ M + L | Kнn =1/K1 =([M]·[L])/[ML] |
ЧТИИ
Изомерия — явление, заключающееся в существовании химических соединений — изомеров, — одинаковых по атомному составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.
Согласно номенклатуре комплексных соединений, название комплексного аниона начинают с указания состава внутренней сферы *. Во внутренней сфере прежде всего называют анионы, прибавляя к их названию окончание -о. Например: Cl– (хлоро-), CN– (циано-), OH– (гидроксо-) и т.д. Далее называют нейтральные лиганды
Классификация комплексных соединений
Основываясь на различных принципах, комплексные соединения можно классифицировать различными способами:
1) По электрическому заряду: катионные, анионные и нейтральные комплексы.
2) По количеству комплексообразователей
3) По типу лиганда
4) По химическим свойствам: кислоты, основания, соли, неэлектролиты
5) По количеству мест, занимаемых лигандом в координационной сфере
ДОХО
Окисли́тельно-восстанови́тельные реа́кции, также редокс— восстановление-окисление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления и не более 2-х атомов, входящих в состав реагирующих веществ (или ионов веществ), реализующимся путём перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем (донором).
Классификация
Все окислительно-восстановительные реакции можно разделить на 3 группы:
1. Реакции межатомного и межмолекулярного окисления-восстановления
2. Реакции внутримолекулярного окисления-восстановления.
3. Реакции диспропорционирования (реакции самоокисления-самовосстановления)
ЧТДС
| Дисперсная система — это система, в которой мелкие частицы одной или нескольких веществ равномерно распределены между частицами другого вещества. |
Коллоидные частицы имеют сложное строение. Они состоят из ядер и адсорбированных и притянутых ионов. 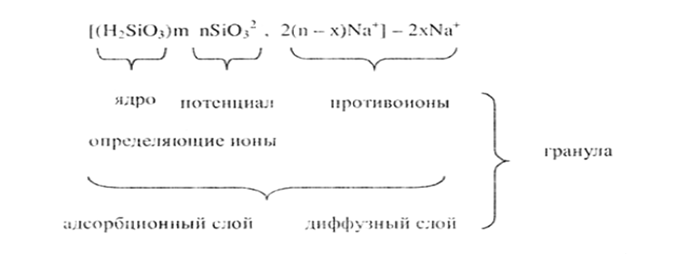 |
Методы диспергирования.Для измельчения жидкостей и твердых тел крайне важно совершить работу. Эта работа тем больше, чем меньше размер частиц дисперсной фазы.Конденсационные методы.Взаимодействие ионов и молекул с образованием частиц коллоидных размеров должна быть достигнута физическими и химическими методами.При химической конденсации образуются гидролизFeCl3 +3H2O=Fe(OH)3(T)+3HClОбмен AgNO3 +KI=Agl (T) +KNO3восстановление2HAuCl4 +3H2O2=2Au Т +8HC1+3O2окисление2H2S(P)+O2=2S(T)+2H2O
23. Что представляет собой координационная теория А.Вернера. Напишите структуру комплексных соединений.Координационная теория — теория комплексных соединений, предложенная в 1893 г. А. Вернером. Согласно Координационной теории в молекуле любого комплексного соединения один из ионов, обычно положительно заряженный, занимает центральное место и называется комплексообразователем. Вокруг него в непосредственной близости расположено (координировано) некоторое число противоположно заряженных ионов или электронейтральных молекул, называемых лигандами (или аддендами), они образуют внутреннюю координационную сферу соединения. Остальные ионы, находящиеся на более далеком расстоянии от центрального иона, образуют внешнюю координационную сферу. Напр., в комплексной соли K2[PtCl6] ион платины является комплексообразователем, ионы хлора — аддендами, во внешней координационной сфере находятся ионы калия.
Структура комплексных соединений
Большинство комплексных соединений имеют внутреннюю и внешнюю сферы. Записывая химические формулы комплексных соединений, внутреннюю сферу заключают в квадратные скобки. Например, в комплексных соединениях К[Al(OH)4] и [Ca(NH3)8]Cl2, внутренней сферой являются группы атомов (комплексы) — [Al(OH)4]— и [Ca(NH3)8]2+, а внешней сферой — ионы К+ и Сl– соответственно.
Центральный атом или ион внутренней сферы называют комплексообразователем.Обычно, в качестве комплексообразователей выступают атомы или ионы металлов с достаточным количеством свободных орбиталей – это p-, d-, f- элементы: Cu2+, Pt2+, Pt4+, Ag+, Zn2+, Al3+и др. Но это может быть и атомы элементов, образующих неметаллы. Заряд комплексообразователя обычно положительный, но также может быть отрицательным или равным нулю и равен сумме зарядов всех остальных ионов. В приведенных выше примерах комплексообразователями являются ионы Al3+и Ca2+.
Комплексообразователь окружен и связан сигма-связью с ионами противоположного знака или нейтральными молекулами, так называемыми лигандами. В качестве лигандов в комплексных соединениях могут выступать такие анионы, как F– , OH–, CN–, CNS–, NO2–, CO32–, C2O42–и др., или нейтральные молекулы Н2О, NН3, СО, NО и др. В наших примерах это – ионы OH— и молекулы NH3. Количество лигандов в различных комплексных соединениях лежит в пределах от 2 до 12. А само число лигандов (число сигма-связей) называется координационным числом (к.ч.) комплексообразователя. В рассматриваемых примерах к.ч. равно 4 и 8.
Заряд комплекса (внутренней сферы) определяется как сумма зарядов комплексообразователя и лигандов.
Внешнюю сферу образуют ионы, связанные с комплексом ионной или межмолекулярной связью и имеющие заряд, знак которого противоположен знаку заряда комплексообразователя. Числовое значение заряда внешней сферы совпадает с числовым значением заряда внутренней сферы. В формуле комплексного соединения записываются они за квадратными скобками. Внешняя сфера может и вовсе отсутствовать, в случае, если внутренняя сфера нейтральна. В приведенных примерах, внешнюю сферу образуют 1 ион K+ и 2 иона Cl— соответственно.
БЛОК
Билет 31
Органические соединения, органические вещества — класс химических соединений, в состав которых входит углерод (за исключением карбидов, угольной кислоты, карбонатов, оксидов углерода и цианидов). Органические соединения, кроме углерода, чаще всего содержат элементы водород, кислород, азот, значительно реже — серу, фосфор, галогены и некоторые металлы (порознь или в различных комбинациях)
Функциональная группа — это совокупность атомов, определяющая характерные химические свойства целого класса веществ.
Иногда к понятию функциональной группы относят также понятие радикал (метил, этил, пропил и т. д.). Однако хотя это и близкие понятия, но отличительным свойством функциональной группы является наличие одинаковых химических свойств, характерных для всего класса веществ, имеющих такую группу в своей структуре. С этой точки зрения алкильные радикалы такими свойствами не обладают.
По типу функциональных групп органические соединения делят на следующие классы (R-предельный углеводородный радикал):
| Функциональна группа | Класс соединений | Общая формула |
| Отсутствует | Углеводороды | R–H |
| Галоген –F, –Cl, –Br, –I | Галогеноводороды | R–Hal |
| Гидроксильная –OH | Спирты | R–OH |
| фенолы | Ar–OH (Ar=C6H5C6H5-) | |
| Алкоксильная –OR | Простые эфиры | R–O–R' |
| Амино –NH2–NH2, –NH–, =N0 | Амины | R–NH2,R2NH,R3NR–NH2,R2NH,R3N |
| Нитро –NO2–NO2 | Нитросоединения | R–NO2R–NO2 |
| Карбонильная >C=O | Альдегиды | 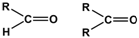 |
| Кетоны | ||
Карбоксильная 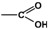 (-COOH) (-COOH) | Карбоновые кислоты | 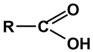 |
Алкоксикарбонильная 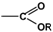 (-COOR) (-COOR) | Сложные эфиры | 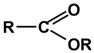 |
Карбоксамидная  (-CONH2CONH2) (-CONH2CONH2) | Амиды карбоновых кислот | 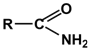 |
| Тиольная –SH | Тиолы | –RSH |
| Сульфо –SO3H–SO3H | Сульфоновые кислоты | –RSO3H |
Билет 32
СПИРТЫ(алкоголи) – класс органических соединений, содержащих одну или несколько группировок С–ОН, при этом гидроксильная группа ОН связана с алифатическим атомом углерода (соединения, у которых атом углерода в группировке С–ОН входит в состав ароматического ядра, называются фенолами)
Классификация спиртов разнообразна и зависит от того, какой признак строения взят за основу.
1. В зависимости от количества гидроксильных групп в молекуле спирты делят на:
а) одноатомные (содержат одну гидроксильную ОН-группу), например, метанол СН3ОН, этанол С2Н5ОН, пропанол С3Н7ОН
б) многоатомные (две и более гидроксильных групп), например, этиленгликоль
HO–СH2–CH2–OH, глицерин HO–СH2–СН(ОН)–CH2–OH, пентаэритрит С(СН2ОН)4.
Соединения, в которых у одного атома углерода 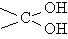 есть две гидроксильных группы, в большинстве случаев нестабильны и легко превращаются в альдегиды, отщепляя при этом воду: RCH(OH)2 ® RCH=O + H2O
есть две гидроксильных группы, в большинстве случаев нестабильны и легко превращаются в альдегиды, отщепляя при этом воду: RCH(OH)2 ® RCH=O + H2O
Спирты, содержащие три группы ОН у одного атома углерода 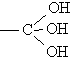 , не существуют.
, не существуют.
2. По типу атома углерода, с которым связана группа ОН, спирты делят на:
а) первичные, у которых ОН-группа связана с первичным атомом углерода. Первичным называют атом углерода (выделен красным цветом), связанный всего с одним углеродным атомом. Примеры первичных спиртов – этанол СH3–CH2–OH, пропанол СH3–CH2–CH2–OH.
б) вторичные, у которых ОН-группа связана с вторичным атомом углерода. Вторичный атом углерода (выделен синим цветом) связан одновременно с двумя атомами углерода, например, вторичный пропанол, вторичный бутанол (рис. 1).
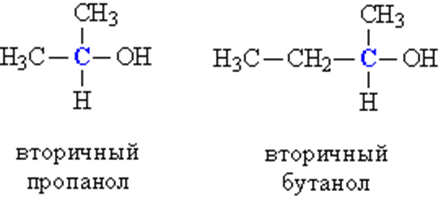
Рис. 1. СТРОЕНИЕ ВТОРИЧНЫХ СПИРТОВ
в) третичные, у которых ОН-группа связана с третичным атомом углерода. Третичный углеродный атом (выделен зеленым цветом) связан одновременно с тремя соседними атомами углерода, например, третичный бутанол и пентанол (рис. 2).
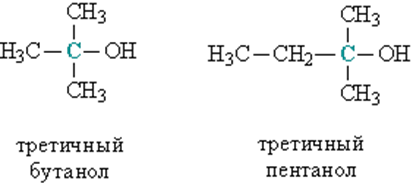
Рис. 2. СТРОЕНИЕ ТРЕТИЧНЫХ СПИРТОВ
В соответствии с типом углеродного атома присоединенную к нему спиртовую группу также называют первичной, вторичной или третичной.
У многоатомных спиртов, содержащих две или более ОН-групп, могут присутствовать одновременно как первичные, так и вторичные НО-группы, например, в глицерине или ксилите (рис. 3).

Рис. 3. СОЧЕТАНИЕ В СТРУКТУРЕ МНОГОАТОМНЫХ СПИРТОВ ПЕРВИЧНЫХ И ВТОРИЧНЫХ ОН-ГРУПП.
3. По строению органических групп, связанных ОН-группой, спирты подразделяют на предельные (метанол, этанол, пропанол), непредельные, например, аллиловый спирт СН2=СН–СН2–ОН, ароматические (например, бензиловый спирт С6Н5СН2ОН), содержащие в составе группы R ароматическую группу.
Непредельные спирты, у которых ОН-группа «примыкает» к двойной связи, т.е. связана с атомом углерода, участвующим одновременно в образовании двойной связи (например, виниловый спирт СН2=СН–ОН), крайне нестабильны и сразу же изомеризуются (см.ИЗОМЕРИЗАЦИЯ) в альдегиды или кетоны:
CH2=CH–OH ® CH3–CH=O
Номенклатура спиртов.Для распространенных спиртов, имеющих простое строение, используют упрощенную номенклатуру: название органической группы преобразуют в прилагательное (с помощью суффикса и окончания «овый») и добавляют слово «спирт»:
| СН3ОН | метиловый спирт |
| С2Н5ОН | этиловый спирт |
| (Н3С)2СНОН | изопропиловый спирт |
| С4Н9ОН | бутиловый спирт |
В том случае, когда строение органической группы более сложное, используют общие для всей органической химии правила. Названия, составленные по таким правилам, называют систематическими. В соответствии с этими правилами, углеводородную цепь нумеруют с того конца, к которому ближе расположена ОН-группа. Далее используют эту нумерацию, чтобы указать положение различных заместителей вдоль основной цепи, в конце названия добавляют суффикс «ол» и цифру, указывающую положение ОН-группы (рис. 4):
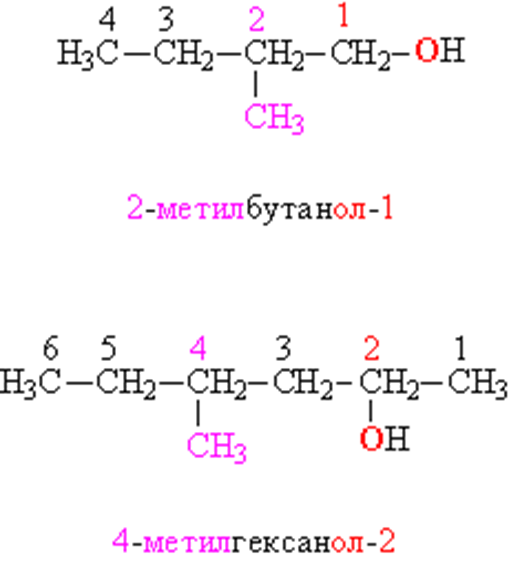
СИСТЕМАТИЧЕСКИЕ НАЗВАНИЯ СПИРТОВ. Функциональные (ОН) и замещающие (СН3) группы, а также соответствующие им цифровые индексы выделены различающимися цветами.
Систематические названия простейших спиртов составляют по тем же правилам: метанол, этанол, бутанол. Для некоторых спиртов сохранились тривиальные (упрощенные) названия, сложившиеся исторически: пропаргиловый спирт НСєС–СН2–ОН, глицерин HO–СH2–СН(ОН)–CH2–OH, пентаэритрит С(СН2ОН)4, фенетиловый спирт С6Н5–CH2–CH2–OH.
Физические свойства спиртов.Спирты растворимы в большинстве органических растворителей, первые три простейших представителя – метанол, этанол и пропанол, а также третичный бутанол (Н3С)3СОН – смешиваются с водой в любых соотношениях. При увеличении количества атомов С в органической группе начинает сказываться гидрофобный (водоотталкивающий) эффект, растворимость в воде становится ограниченной, а при R, содержащем свыше 9 атомов углерода, практически исчезает.
Благодаря наличию ОН-групп между молекулами спиртов возникают водородные связи.

Фенолы
Важнейшим представителем фенолов является фенол (гидроксобензол, старые названия - гидроксибензол, оксибензол) C6H5—OH.
Физические свойства фенола: твердое бесцветное вещество с резким запахом; ядовит; при комнатной температуре заметно растворим в воде, водный раствор фенола называют карболовой кислотой.
Химические свойства
1. Кислотные свойства. Кислотные свойства фенола выражены сильнее, чем у воды и предельных спиртов, что связано с большей полярностью O—H связи и с большей устойчивостью образующегося при ее разрыве фенолят-иона. В отличие от <
