Энтропия. 2 закон термодинамики. 3 закон термодинамики.
Энтропия (S) – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы. Больцман определил энтропию как термодинамическую вероятность состояния (беспорядок) системы W. Размерность энтропии 1 моля вещества совпадает с размерностью газовой постоянной R и равна Дж∙моль–1∙K–1. Изменение энтропии в необратимых и обратимых процессах передается соотношениями ΔS > Q / T и ΔS = Q / T. Например, изменение энтропии плавления равно теплоте (энтальпии) плавления ΔSпл = ΔHпл/Tпл Для химической реакции изменение энтропии аналогично изменению энтальпии. Энтропия вещества или системы тел при определенной температуре является абсолютной величиной. Энтропия зависит от:
1. Агрегатного состояния вещества. Энтропия увеличивается при переходе от твердого к жидкому и особенно к газообразному состоянию (вода, лед, пар).
2. Изотопного состава (H2O и D2O).
3. Молекулярной массы однотипных соединений (CH4, C2H6, н-C4H10).
4. Строения молекулы (н-C4H10, изо-C4H10).
5. Кристаллической структуры (аллотропии) – алмаз, графит.
стремление системы к беспорядку проявляется тем больше, чем выше температура. Произведение изменения энтропии системы на температуру TΔS количественно оценивает эту тенденцию и называется энтропийным фактором. S возрастает при переходе в-ва из кристаллического состояния в жидкое и из жидкого в газообразное, при растворении кристаллов, при расширении газов, при хим.взаимодействиях, приводящих к увеличению числа частиц, и прежде всего частиц в газообразном состоянии. Напротив, все процессы в результате которых упорядоченность системы возрастает(конденсация, полимеризация, сжатие, уменьшения числа частиц), сопровождаются уменьшением энтропии.
В изолированных системах энтропия самопроизвольно протекающего процесса увеличивается ΔS > 0 (второй закон термодинамики).
Энтропия равна нулю только у идеального кристалла при абсолютном нуле (третий закон термодинамики).
3. Электролиз. Электролиз водных растворов и расплавов. Законы Фарадея. Практическое применение элеткролиза.
Электролиз - окислительно-восстановительный процесс протекающий на электродах при прохождении эл тока через расплав или раствор электролита.
Сущность электролиза состоит в том, что за счет эл энергии осуществляется реакция, которая не может протекать самопроизвольно.
ФАРАДЕЯ ЗАКОНЫ, основные законы электролиза, отражающие общий закон сохранения в-ва в условиях протекания злектрохим. р-ции. Установлены M. Фарадеем в 1833-34. Согласно 1-му закону, масса в-ва т, прореагировавшего в процессе электролиза, прямо пропорциональна силе тока I и времени электролиза t, т. е. кол-ву пропущенного электричества Q = It. Согласно 2-му закону, для разных электродных процессов при одинаковом кол-ве пропущенного электричества Q массы прореагировавших в-в относятся друг к другу так же, как молярные массы эквивалентов этих в-в. Оба Ф. з. объединяются одним ур-нием:
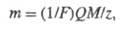
где Mz - мол. м. эквивалента в-ва, участвующего в электролизе. F - Фарадея постоянная, равная 96500 Кл/моль.
Билет 11
1. Понятие о квантовой механике. Квантовый характер излучения и поглощения энергии. Уравнение Планка. Атомные спектры как характеристики энергетических уровней электронов. Корпускулярно-волновая природа электрона. Уравнение де Бройля.
Распределение электронов в многоэлектронных атомах основано на трех положениях: принципе минимума энергии, принципе Паули, правиле Хунда.
Принцип Паули: в атоме не может быть электронов ,имеющих одинаковый набор всех четырех квантовых чисел (на одной орбитали может быть не более двух электронов с различными спинами). Каждый подуровень содержит 2l + 1 орбитали, на которых размещаются не более 2(2l + 1) электронов. Отсюда следует, что емкость s-орбиталей – 2, p-орбиталей – 6, d-орбиталей – 10 и f-орбиталей – 14 электронов. Два электрона, находящихся на одной орбитали и обладающих противоположно направленными спинами , называют спаренными, электроны ,расположенные по одному на орбиталях- неспаренные. Принцип минимума энергии: Электрон в основном (невозб.) состоянии в атоме занимает такое положение, чтобы енергия была бы минимальной. Энергия электрона главным образом определяется суммой (n+l ). Правило Клечковского: 1) В первую очередь заполняется та орбиталь где (n+l ) min
2) Если (n+l ) для нескольких орбиталей одинаковы, то в первую очередь заполняется та орбиталь, где n- меньше.
1s<2s<2p<3s<3p<4s<3d <4p<5s<4d<5p<6s<4f<5d<6p<7s<5f<6d<7p
Каждый период в таблице Менделеева начинается с заполнения нового эн. уровня.
На внешнем эн. уровне не может быть больше 8 электронов. У всех благородных газов ( кроме Не ) внешн.эн. уровень заполнен полностью - состояние этой оболочки самое устойчивое. В хим. реакциях атомы стремятся принять или отдать электроны так, чтобы на внешней оболочке было 8 электронов, при этом образуются ионы. Правило Хунда: При данном значении l ( в пределах одного подуровня ) электрон занимает такое положение, чтобы суммарный спин был бы макс.
Квантовые числа электрона.
Движение электрона в атоме описывается квантовыми числами: главным – n, побочным – l, магнитным – m и спиновым – s. Квантовое число n – главное. Оно определяет энергию электрона в атоме водорода и одноэлектронных системах (He+, Li2+ и т. д.). n принимает значения от 1 до ∞. Чем меньше n, тем больше энергия взаимодействия электрона с ядром. При n = 1 атом водорода находится в основном состоянии, при n > 1 – в возбужденном. В многоэлектронных атомах электроны с одинаковыми значениями nобразуют слой или уровень, обозначаемый буквами K, L, M, N, O, P и Q. Буква K соответствует первому уровню, L – второму и т. д.
Орбитальное квантовое число l характеризует форму орбиталей и принимает значения от 0 до n– 1. Кроме числовых l имеет буквенные обозначения
| l | = | … | |||||
| l | = | s | p | d | f | g | … |
Электроны с одинаковым значением l образуют подуровень. Квантовое число l определяет квантование орбитального момента количества движения электрона в сферически симметричном кулоновском поле ядра.
Квантовое число ml называют магнитным. Оно определяет пространственное расположение атомной орбитали и принимает целые значения от –l до +lчерез нуль, то есть 2l+ 1 значений. Расположение орбитали характеризуется значением проекции вектора орбитального момента количества движения Mz на какую-либо ось координат (обычно ось z). Орбитали одного подуровня (l = const) имеют одинаковую энергию. Такое состояние называют вырожденным по энергии. Так p-орбиталь – трехкратно, d – пятикратно, а f– семикратно вырождены. Квантовые числа n, lи mlне полностью характеризуют состояние электрона в атоме. Экспериментально установлено, что электрон имеет еще одно свойство – спин. Упрощенно спин можно представить как вращение электрона вокруг собственной оси. Спиновое квантовое число s имеет только два значения s= ±1/2, представляющие собой две проекции углового момента электрона на выделенную ось. Итак, четыре квантовых числа описывают состояние электрона в атоме и характеризуют энергию электрона, его спин, форму электронного облака и его ориентацию в пространстве. При переходе атома из одного состояния в другое происходит перестройка электронного облака, то есть изменяются значения квантовых чисел, что сопровождается поглощением или испусканием атомом квантов энергии. Орбиталь- функция, описывающая ост. электронов в атоме или молекуле и явл. обычной математ.функцией.
СПЕКТР - в физике, совокупность всех значений какой-либо физической величины, характеризующей систему или процесс. Чаще всего пользуются понятиями частотного спектра колебаний (в частности, электромагнитных и акустических), спектра энергий, импульсов и масс частиц (см. Спектроскопия, Масс-спектрометрия). Спектр может быть непрерывным и дискретным.
