Повышение температуры кипения растворов
Жидкость кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. Если растворённое вещество нелетуче (то есть давлением его насыщенных паров над раствором можно пренебречь), то общее давление насыщенного пара над раствором равно парциальному давлению паров растворителя. В этом случае давление насыщенных паров над раствором при любой температуре будет меньше, чем над чистым растворителем, и равенство его внешнему давлению будет достигаться при более высокой температуре. Таким образом, температура кипения раствора нелетучего вещества Tb всегда выше, чем температура кипения чистого растворителя при том же давлении T°b.
§ Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора
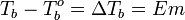
О́смос (от греч. ὄσμος — толчок, давление) — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества (меньшей концентрации растворителя).
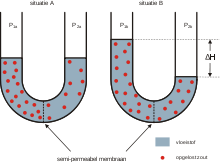
Рассмотрим ситуацию, при которой частично проницаемая мембрана (т. е., такая, через которую могут проходить лишь мелкие объекты, например, молекулы растворителя, но не крупные — например, молекулы растворённого вещества) разделяет чистый растворитель и раствор (или два раствора с разными концентрациями). Тогда молекулы растворителя находятся практически в равных физических условиях по обе стороны мембраны, однако в более насыщенном растворе некоего вещества их концентрация, разумеется, меньше, чем в более разбавленном (в котором меньше места в растворе занимают молекулы растворённого вещества). Следовательно, со стороны менее насыщенного раствора через мембрану диффундирует большее число молекул, чем с противоположной стороны. А это значит, что растворитель попросту переходит из менее насыщенного раствора в более насыщенный, разбавляя его (выравнивая концентрации обоих растворов) и создавая давление на мембрану. Процесс этот (он называется осмосом) можно прекратить, оказав определённое давление на более насыщенный раствор (например, при помощи поршня) —— это давление и называется осмотическим давлением.
Растворы с одинаковым осмотическим давлением называются изотоническими.
Определить осмотическое давление раствора можно по формуле, полученной в 1886 году Я. Х. Вант-Гоффом:
π = CMв-ва · R · T, где
CMв-ва — молярная концентрация раствора, выраженная в 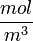 , а не в
, а не в 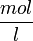 , как обычно;
, как обычно;
R — универсальная газовая постоянная;
T — термодинамическая температура системы.
Растворы электролитов
Законы Рауля не выполняются для растворов (даже бесконечно разбавленных), которые проводят электрический ток — растворов электролитов. Для учёта этих отклонений Вант-Гофф внёс в приведённые выше уравнения поправку — изотонический коэффициент i, неявно учитывающий диссоциацию молекул растворённого вещества:
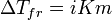 ;
; 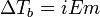
Неподчинение растворов электролитов законам Рауля и принципу Вант-Гоффа послужили отправной точкой для создания С. А. Аррениусом теории электролитической диссоциации.
Изоосмия, изотония (от изо... и греч. osmós — толчок, tónos — напряжение), относительное постоянство осмотического давления в жидких средах и тканях организма, обусловленное поддержанием на данном уровне концентраций содержащихся в них веществ: электролитов, белков и т. д. И. — одна из важнейших физиологических констант организма, обеспечиваемых механизмами саморегуляции (см. Гомеостаз). Отклонение осмотического давления от нормального физиологического уровня " 0,76—0,81 Мн/м2(7,6—8,1 ат) влечёт за собой нарушение обменных процессов между кровью и тканевой жидкостью.
Роль осмоса: явление переноса из раствора с меньшей С в большую. Так осуществляется обмен молекулами между клеткой и внешней средой)
Гемолиз- разрушение- лопаются клетки в гипотоническом растворе
Плазмолиз-сморщивание клеток)
12.
Для неэктролитов i=1,Для электролитов I больше 1, причем с разбавлением раствора I растет , приближаясь к целым числам
До Арениуса:диссоциация на ионы под действием i
Арениус: диссоциация молекул электролитов на ионы происходит уже в процессе растворения.
Диссоциация обратима: наряду с распадом на ионы-обратный процесс рекомбинации: образование из ионов молекул = устанавливается ионное равновесие)
Сильные электролиты: практически полностью диссоциируют: альфа = 30%
Слабые электролиты не полностью : альфа равна 3-5%
Kp= 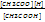
CH3COOHóCH3COO + H
Закон Оствальда:
Kd 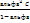
Альфа: 1.8 *10 в – 9
KD = 1.8 * 10 d -16
Активность)
Эффективная конц. в соответсвии с кислотой участвует в различных процессах
А= 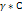
Гамма- коэффицет активности
Ионная сила раствора) -I
I– полусумма произведений концентраций всех ионов раствора на квадрат заряда I=1/2 ECn*Z(в квадрате)n
Биологические жидкости сожержат много элементов NaCl KCL HCL CaCl2 NaH2PO4
Организм теряет воду и электролиты с мочей, при этом конц. элементов примерно постоянна( ионный гомеостаз)
Слюна как электролит является сложной биохим. Средой: вода, мин. Соли, орг. Вещ-ва
13. Основные положения протолитической теории кислот и оснований Бренстеда-Лоури, сопряженная протолитическая пара, амфолиты. Теория Льюиса.
В соответствии с положениями протолитической теории кислота – молекула или ион – донор протонов (НВ), основание – молекула или ион – акцептор протонов (В). Молекула или ион (2 иона), отличающиеся по составу на один протон, называются сопряженной кислотно-основной парой. В Водных растворах кислот и оснований всегда имеются 2 сопряженные пару, одну из которых образует вода.
Сила кислот определяется их способностью отдавать протон. Мерой этой способности служит константа кислотности ka. Ka=c(B-)c(H3O+)/c(HB). Чем больше константа кислотности, тем сильнее кислота.
Сила оснований определяется их способностью принимать протон. Kb – константа основности. Kb=с(OH-)c(OB+)/c2(B)
Частицы, способные взаимодействовать как с кислотами, так и с основаниями, называются амфолитами. Типичный пример амфолитов – аминокислоты.
Электронная теория Льюиса допускает, что участие в кислотно-основном равновесии протона необязательно, поэтому ее называют апротонной. Согласно апротонной (электронной) теории, кислотой называется вещество, способное присоединять электронную пару, а основанием – вещество, способное отдавать электронную пару.
Ни кислота, ни основание протонов не содержат.
Эта концепция расширяет границы веществ, проявляющих кислотно-основные свойства, включая в себя протонотдающие и протонприсоединяющие системы.
В периоде сила кислородсодержащей кислоты растет с увеличением заряда и с уменьшением радиуса иона кислотообразующего элемента.
Для одного и того же элемента константа диссоциации различных кислот возрастает по мере увеличения степени окисления кислотообразующего элемента примерно на пять порядков каждый раз.
В пределах одной группы элементов сила кислоты уменьшается по мере увеличения радиуса кислотообразующего элемента:
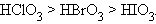 |
Для многоосновных кислот способность к депротонизации уменьшается по мере увеличения отрицательного заряда аниона:
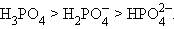 |
При этом константа диссоциации каждой последующей ступени уменьшается примерно на пять порядков:
| K1 : K2 : K3 = 1 : 10–5 : 10–10. |
На состояние динамического равновесия, в котором находится раствор слабого электролита, сильно влияет присутствие одноименного иона. Так, диссоциация уксусной кислоты протекает по схеме
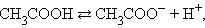 |
и для этой реакции
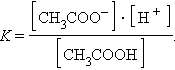 |
14.Автопротолиз воды. Константа автопротолиза воды. Водородный показатель.
Автопротолиз – обратимый процесс образования равного числа катионов и анионов из незаряженных молекул жидкого индивидуального вещества за счет передачи протона от одной молекулы к другой.
H2O + H2O= H3O+ + OH–
Это равновесие называется равновесием автопротолиза воды.
Константа автопротолиза для воды обычно называется ионным произведением воды и обозначается как Kw. Ионное произведение численно равно произведению равновесных концентраций ионов гидроксония и гидроксид-анионов. Обычно используется упрощенная запись:
При стандартных условиях ионное произведение воды равно 10-14. Оно является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. Автопротолиз воды объясняет, почему чистая вода, хоть и плохо, но всё же проводит электрический ток.
pH — это водородный показатель— мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм концентрации водородных ионов, выраженной в молях на литр:
pH = -log[H+].
Т.е. рН определяется количественным соотношением в воде ионов Н+ и ОН-, образующихся при диссоциации воды. (Моль — единица измерения количества вещества.)
Если в воде пониженное содержание свободных ионов водорода [H+] (рН > 7) по сравнению с ионами гидроксида [ОН-], то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н+ (рН < 7) - кислую. В идеально чистой дистиллированной воде эти ионы будут уравновешивать друг друга и в нейтральной воде рН=7. При растворении в воде различных химических веществ этот баланс может быть нарушен, что приводит к изменению значения рН.
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию.
для сильной кислоты:
pH = -log[H+]
для слабой кислоты:
pH = ½ (рКа – lgСкисл)
или pH = ½ (-lgKкисл – lgСкисл)
для сильного основания:
pH = 14- pOH; (pOH=-lg[OH]; [OH]=Cоснования; C= m / MV)
или если дано Kb,тогда pOH= ½ (pKb - Cоснования) (pKb=-lgKb; pOH= ½ (-lgKb - Cоснования; pH=14-pOH)
для слабого основания :
pH = 14 - ½pKb + ½ lgC
15. Типы протолитических реакций. Понятие о гидролизе. Роль гидролиза в биохимических процессах. Ацидиметрия и алкалиметрия.
К протолитическим реакциям относят кислотно−основные реакции и реакции нейтрализации и гидролиза.
В соответствии с протолитической теорией кислот и оснований кислоты представляют собой атомно−молекулярные частицы, способные в обычных условиях к внутримолекулярной или межмолекулярной, полной или неполной передаче протона, а основания − частицы, способные в этих же условиях к присоединению протона, например:
NH3(осн.1) + H2O(кисл.2) = NH4+ (кисл.2)+ OH−(осн.2)
Сродство к протону ‒ энергия, высвобождающаяся в газофазной реакции между протоном и молекулой с образованием соответствующей сопряженной кислоты
Реакция гидролиза - необратимая химическая реакция взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц (относится к протолитическим реакциям). Реакции гидролиза записывают в виде:
а) молекулярного уравнения: KNO2 + H2O ↔ KOH + HNO2
б) ионного уравнения:
NO2− + H2O ↔ HNO2 + OH−
NH4+ + H2O = NH4ОН + Н+ [образующийся ион водорода обусловливает кислотную среду раствора, т. е. (рН) < 7].
Уравнение реакции гидролиза соли (гидролиз иона) на примере FeCl3 выглядит как (FeCl3 = Fe3+ + 3Cl−)
Гидролиз солей это реакции между составными частями воды и солей, сопровождающиеся образованием малодиссоциированных соединений. Гидролизу могут подвергаться не только соли, но и другие растворенные вещества (углеводы, белки, жиры, эфиры и т.д.). Реакция гидролиза часто сопровождается изменением рН раствора. Если вместо воды используется иной растворитель, то процесс носит название сольволиз.
Гидролизу подвергаются соли, являющиеся производными слабых кислот или оснований. Соли, образованные сильными кислотами и основаниями, гидролизу не подвергаются.
1)Гидролиз солей, образованных сильной кислотой и слабым основанием (гидролиз по катиону). Для характеристики полноты протекания реакции используют понятие степень гидролиза (β) – отношение концентрации молекул, подвергшихся гидролизу (сгидр) к исходной концентрации растворенной соли (сисх):
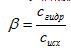 (7.37)
(7.37)
Степень гидролиза зависит от: 1)химической природы ионов, составляющих соль; 2)концентрации соли; 3)температуры. Степень гидролиза увеличивается с уменьшением константы диссоциации слабой кислоты или основания, уменьшением концентрации соли и повышением температуры.
Гидролиз протекает в заметной степени только в разбавленных растворах 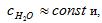 , тогда следовательно
, тогда следовательно 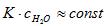 ,Это произведение называется константой гидролиза (Кг):
,Это произведение называется константой гидролиза (Кг):
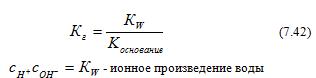
Из выражения (7.42) следует, что уменьшение силы основания ведет к увеличению константы гидролиза, а следовательно, и степени гидролиза.
Степень гидролиза увеличивается с уменьшением силы основания и концентрации соли. Повышение температуры сопровождается увеличением КW, что также ведет к росту β.
2)Гидролиз солей, образованных слабой кислотой и сильным основанием (гидролиз по аниону).
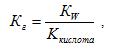 где Ккислота – константа диссоциации слабой кислоты.
где Ккислота – константа диссоциации слабой кислоты.
3)Гидролиз солей, образованных слабой кислотой и слабым основанием (гидролиз по аниону и катиону)
Константа гидролиза в этом случае определяется константой диссоциации слабой кислоты и слабого основания:

Реакции гидролиза играют важную роль в природных и производственных процессах. В водоочистке для удаления грубодисперсных и коллоидных примесей используют осадки гидроксидов алюминия и железа, получаемые гидролизом сульфатов железа (FeSO4.7H2O; Fe2(SO4)3.9H2O), алюминия Al2(SO4)3.18H2O), или хлорида железа (FeCl3.6H2O). Для обеспечения полноты протекания гидролиза растворы подщелачивают. Важной стадией процесса пищеварения является гидролиз пищи в желудочно-кишечном тракте. Энергия в живых организмах запасается, в основном, в виде АТФ (аденозинтрифосфорная кислота) и выделяется при ее гидролизе.
Алкалиметрия и ацидиметрия — важнейшие титриметрические методы определения кислот или же оснований, основанные на реакции нейтрализации:
Н+ + ОН− = Н2О
Титрование раствором щелочи называется алкалиметрией, а титрование раствором кислоты — ацидиметрией.
