Периодическая система химических элементов
Таблица – Форма электронных облаков
Таким образом, магнитное квантовое число ml может принимать (2l + 1) значений; столько же существует облака относительно ядра атома. Например, три p-электронных облака с ml = -1; 0; +1 располагаются в пространстве перпендикулярно друг другу.вариантов ориентации электронного
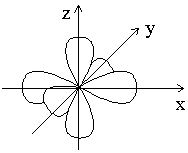
| Рисунок–Расположение p-электронных облаков в пространстве |
Атомные орбитали
Состояние электрона в атоме, характеризующееся тремя квантовыми числами n, l, ml , называется атомной орбиталью. Часто орбиталь также определяют как область пространства, в которой наиболее вероятно нахождение электрона.
Совокупность орбиталей с одним и тем же значением главного квантового числа n образует энергетический уровень. Орбитали некоторого энергетического уровня, характеризующиеся одним и тем же значением орбитального квантового числа l, образуют энергетический подуровень.
Очевидно, что число орбиталей на подуровне равно числу значений магнитного квантового числа ml, которые оно может принимать при данном l. Так, на любом энергетическом уровне может находиться только одна s-орбиталь; она и образует s-подуровень. Если некоторый энергетический уровень образован также орбиталями другого типа, то p-орбиталей всегда будет три; они образуют p-подуровень. d-подуровень образован пятью d-орбиталями, а семь f-орбиталей образуют f-подуровень.
Например, показанные ниже орбитали все вместе образуют третий энергетический уровень, так как все они характеризуются одним и тем же значением главного квантового числа n = 3. Третий энергетический уровень делится на три подуровня, несколько различающихся по энергии: s-орбитали имеют более низкую энергию, чем p-орбитали, а p-орбитали, более низкую энергию, чем d-орбитали. Каждый подуровень образован орбиталями с одинаковым значением орбитального квантового числа l. 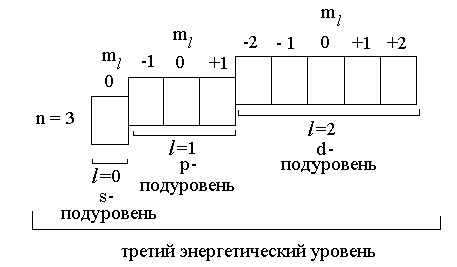
Спиновое квантовое число(4-ое)Исследование атомных спектров показало, что помимо квантовых чисел n, l, ml, электрон характеризуется ещё одной квантованной величиной, не связанной с движением электрона вокруг ядра, а определяющей его собственное движение. Эта величина получила название спинового квантового числа (ms). У электрона спиновое квантовое число может принимать два значения: ms = +1/2 и ms = -1/2 . Схематическое изображение:
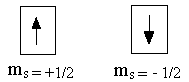
Четыре квантовых числа n, l, ml, ms однозначно определяют состояние электрона в атоме.
Принцип Паули
Согласно принципу Паули в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы. Из этого следует, что на каждой атомной орбитали, характеризующейся определёнными значениями n, l, ml ,может находиться не более двух электронов, причём спины этих электронов должны быть противоположно направлены (только в этом случае спиновые квантовые числа электронов будут отличаться:у одного электрона ms = +1/2, у другого ms = -1/2). 
Обозначение неспаренного электрона на атомной орбитали:
 Обозначение двух спаренных электронов с противоположными спинами, находящихся на одной атомной орбитали:
Обозначение двух спаренных электронов с противоположными спинами, находящихся на одной атомной орбитали:
№3
П.З. открыт Менделеевым в 1869 году. Первон. форм-ка: св-ва элементов, а также св-ва, образуемых ими простых вещ-в и соединений нах-ся в периодической зависимости от величины атомных масс элементов.
Открытие ПЗ дало Менделееву основу для классиф. хим-их элементов и создания периодич. системы. До Менделеева нек. делали попытки для систематизации хим. элементов. Менделеев смог создать объективную основу для классиф. хим. элементов. Этой основой оказалась атомная масса хим. элементов, которая в то время дост.изучена. Он расположил известные в то время 63хим. элемента в порядке атомных масс .И обратил внимание на то, что в рядах через опред-ое кол-во хим. элементов св-ва повторяются. Расположив столбцами группы элементов Менделеев обнаружил сходство элементов друг с другом. При этом были учтены хим-ие и физ-ие св-ва, а также простых и сложных вещ-в. в результате чего, он получил таблицу, которая выражала периодичность изменения св-в элементов и их соединений.Эту таблицу он и назвал ПЕРИОДИЧЕСКАЯ ТАБЛИЦА, в которой каждый элемент занимал определённое место.
На основе ПЗ Менделеев смог указать в Пер. системе места ещё не известных тогда 12хим. элементов, а также описать их физические и химические св-ва, а также образуемых ими простых в-в и соединений.Эти предсказания подтвердились. С 1894-1898были открыты инертные газы(8гр: неон, криптон…)
Восстановлением называется процесс присоединения электронов. Вещество, в состав которого входит элемент, принимающий электроны и, вследствие этого, понижающий свою степень окисления, называется окислителем.
Таким образом, окислитель принимает электроны и восстанавливается, а восстановитель отдаёт электроны и окисляется. Разумеется, что в любой окислительно-восстановительной реакции число электронов, отданных восстановителем, равно числу электронов, принятых окислителем.
| -1 |
| -1 |
| 2 e– |
2 KI (восстановитель) + Cl2 (окислитель) ® I2 + 2 KCl
Если атом некоторого элемента находится в высшей степени окисления, то он не может отдавать электроны и далее повышать степень окисления, т.е. он не может быть восстановителем. Атомы в высшей степени окисления могут быть только окислителями. Например, азотная кислота во всех окислительно-восстановительных реакциях ведёт себя как окислитель, т.к. атом азота в молекуле HNO3 находится в высшей степени окисления +5. Если атом некоторого элемента находится в низшей степени окисления, то он не может принимать электроны и далее понижать степень окисления, т.е. он не может быть окислителем. Атомы в низшей степени окисления могут быть только восстановителями. Например, иодид калия проявляет за счёт иодид иона только восстановительные свойства, т.к. атом йода имеет низшую степень окисления – минус 1. Если степень окисления элемента промежуточная, то в зависимости от условий реакции этот элемент может проявлять как свойства восстановителя, так и свойства окислителя. Некоторые вещества, содержащие в своём составе атомы в промежуточной степени окисления, могут в одной и той же реакции выступать как в роли окислителя, так и в роли восстановителя. Наиболее характерна эта реакция для неметаллов. Например, в реакции
| +5 |
| -1 |
3 Cl2 + 6 NaOH ® NaClO3 + 5 NaCl + 3 H2O
хлор, находясь в промежуточной степени окисления (0), сам себя окисляет и восстанавливает. Поэтому такие окислительно-восстановительные реакции носят название реакций самоокисления-самовосстановления (или диспропорционирования).
Окислительно-восстановительная активность соединения определяется не только характером степени окисления, но и устойчивостью элемента в данной степени окисления. Если атом находится в неустойчивой степени окисления, то вещество, в состав которого входит этот атом тоже будет неустойчивым; такое вещество будет легко вступать в реакции, в результате которых степень окисления элемента изменится на более устойчивую.
Составление уравнений окислительно-восстановительных реакций ионно-электронным методом (методом полуреакций)
Существуют два основных способа уравнивания окислительно-восстановительных реакций: метод электронного баланса и ионно-электронный метод (метод полуреакций). Метод электронного баланса рассматривает изменение степени окисления каждого атома, изменяющего свою валентность:
4 Fe + 3 O2 ® 2 Fe2O3 Fe ® Fe3+ + 3e (× 4) O2 + 4e ® 2 O2– (× 3).
В принципе, этот метод, позволяет уравнять любую окислительно-восстановительную реакцию. Однако при его практическом использовании выявляются два серьёзных недостатка. Во-первых, в некоторых случаях атомам приходится приписывать необычные или даже дробные степени окисления (KO3–1/3, Na2S2+2O3, Na2S4+2,5O6, Fe3+8/3O4), что затрудняет понимание химизма процессов. Во-вторых, во многих случаях, например, при расчете величины окислительно-восстановительного потенциала в аналитической химии, необходимо знать, в виде каких реальных частиц (атомов, ионов, молекул) и с какой концентрацией присутствуют в растворе реагирующие вещества. Например, в растворе K2Cr2O7 имеются ионы Cr2O72– но не ионы Cr+6 .
Ионно-электронный метод уравнивания окислительно-восстановительных реакций учитывает те реальные частицы, которые находятся в растворе, и именно этот метод используется при изучении последующих химических дисциплин – аналитической, физической и коллоидной химии.
Для уравнивания окислительно-восстановительных реакций ионно-электронным методом следует придерживаться определённой поcледовательности действий.
1) Определить, какие элементы изменяют степень окисления.
2) Сделать запись схемы реакции в ионно-молекулярном виде (сильные электролиты при этом записываются в виде ионов, а слабые электролиты, неэлектролиты, газы и осадки – в виде молекул) и выяснить, таким образом, в составе каких реальных частиц участвуют в окислительно-восстановительной реакции атомы этих элементов; записать процесс превращения исходных веществ в конечные продукты.
3) Уравнять, если это требуется, в левой и правой частях составляемого уравнения число атомов, меняющих степень окисления.
4) Уравнять число атомов кислорода и водорода, используя водород- и кислородсодержащие частицы, имеющиеся в водном растворе – H2O, H+, OH–; для уравнивания атомов кислорода и водорода существуют определённые правила (см. ниже примеры реакций).
5) Уравнять суммы зарядов ионов в левой и правой частях уравнений процессов окисления (восстановления), добавляя в ту или иную сторону требуемое число электронов.
6) Составить ионно-молекулярное уравнение окислительно-восстановительной реакции, предварительно уравняв число отданных и принятых электронов.
7) Записать уравнение реакции в молекулярном виде.
Ниже этот порядок действий рассматривается на примерах конкретных химических реакций. Na2SO3+KMnO4+H2SO4 ® Na2SO4+MnSO4+K2SO4+H2O
1) Mn+7 ® Mn+2 (восстановление); S+4– ® S+6 (окисление).
2)2 Na++SO32–+K++MnO4– + 2 H+ + SO42–® Na+ + SO42– +Mn2+ +SO42– +2K++SO42– +H2O
MnO4– ® Mn2+ SO32– ® SO42–
3) Число атомов Mn и S не требует уравнивания.
4) В правой части реакции восстановления MnO4– ® Mn2+ имеет место недостаток четырёх атомов кислорода, который можно устранить, добавив туда 4 H2O, а в левую часть 8 H+. Аналогично, в реакции окисления SO32– ® SO42– недостаток одного атома кислорода в левой части уравнения можно устранить, записав влево одну молекулу H2O, а вправо – два иона H+: MnO4– + 8 H+ ® Mn2+ + 4 H2O SO32– + H2O ® SO42– + 2 H+.
Если в какой-либо части составляемого ионно-электронного уравнения реакции, протекающей в кислой среде, имеется недостаток атомов кислорода, то в эту часть уравнения на каждый недостающий атом кислорода следует записать одну молекулу Н2О, а в другую – два иона Н+.
№6
Раствором называется твёрдая или жидкая гомогенная физико-химическая система, состоящая из двух или более компонентов, количества которых могут изменяться в широких пределах. Гомогенной называется система, состоящая из одной фазы (например, только жидкой, только твёрдой, или только газообразной фазы). Фаза – это часть системы, отделённая от других частей этой же системы поверхностью раздела, при переходе через которую свойства изменяются скачком. Гетерогенная система состоит из нескольких фаз, отделённых друг от друга поверхностью раздела.
Примеры гомогенных систем: любая газовая смесь, раствор сахара в воде. Примеры гетерогенных систем: вода со льдом, насыщенный раствор с осадком (жидкая фаза и твёрдая фаза), угольная пыль в атмосфере (твёрдая фаза и газовая фаза), смесь песка и мела (твёрдая фаза песка и твёрдая фаза мела), смесь подсолнечного масла и воды (жидкая фаза масла и жидкая фаза воды).
Всякий раствор состоит из растворённых веществ и растворителя, т.е. среды, в которой эти вещества равномерно распределены в виде молекул или ионов. Растворителем обычно считают тот компонент, который в чистом виде существует в том же агрегатном состоянии, что и полученный раствор (например, в случае водного раствора соли растворителем является вода). Если оба компонента до растворения находились в одинаковом агрегатном состоянии (например, спирт и вода), то растворителем считается компонент, находящийся в большем количестве.
Однородность растворов делает их сходными с химическими соединениями. Выделение теплоты при растворении некоторых веществ также указывает на химическое взаимодействие между растворителем и растворяемым веществом. Отличие растворов от химических соединений состоит в том, что состав раствора может изменяться в широких пределах.В свойствах раствора можно обнаружить многие свойства его отдельных компонентов, чего не наблюдается в случае химического соединения. Непостоянство состава растворов сближает их с механическими смесями, но от смесей они отличаются своей гомогенностью. Таким образом, растворы занимают промежуточное положение между механическими смесями и химическими соединениями. Наиболее важный вид растворов – жидкие растворы, которые рассматриваются далее более подробно.
Растворение кристалла твёрдого вещества в жидкости протекает следующим образом. Когда кристалл вносят в жидкость, в которой он может растворяться, от его поверхности отрываются отдельные молекулы или ионы, которые вследствие диффузии равномерно распределяются по всему объёму растворителя. Отделение молекул или ионов от твёрдого тела вызвано, с одной стороны, их собственным колебательным движением, а с другой – притяжением к молекулам растворителя. Этот процесс должен был бы продолжаться до полного растворения любого количества кристаллов, если бы одновременно не происходил обратный процесс – кристаллизация. Перешедшие в раствор молекулы или ионы, сталкиваясь с поверхностью ещё нерастворившегося вещества, снова притягиваются к нему и входят в состав его кристаллов. Выделение молекул или ионов из раствора будет происходить тем быстрее, чем больше их концентрация в растворе. Так как концентрация по мере растворения увеличивается, то наступит момент химического равновесия, когда скорость растворения равна скорости кристаллизации. Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором.
При растворении кристаллов происходит их разрушение, что требует затраты энергии, поэтому растворение должно было бы всегда протекать с поглощением теплоты. Однако, как было ранее отмечено, некоторые вещества, находящиеся в кристаллическом состоянии, растворяются в жидкостях с выделением теплоты. Это позволяет предположить, что одновременно с разрушением кристаллов твёрдого тела при его растворении происходит какое-то химическое взаимодействие между растворителем и растворяемым веществом, и в результате этого взаимодействия энергии выделяется больше, чем её расходуется на разрушение кристаллической решётки.
В настоящее время установлено, что при растворении многих веществ, их молекулы или ионы связываются с молекулами растворителя, образуя соединения, называемые сольватами. Процесс взаимодействия растворяющегося вещества с растворителем называется сольватацией. В частном случае, когда растворителем является вода, эти соединения называются гидратами, а процесс их образования – гидратацией.
Пример образования гидратированного катиона показан на рис. 6.1. При растворении веществ с ионной структурой полярные молекулы воды, являющиеся диполями, удерживаются около ионов силами электростатического притяжения (ион-дипольное взаимодействие).
Предположение о существовании в водных растворах гидратов было высказано и обосновано в восьмидесятых годах XIX века Д.И. Менделеевым, который считал, что растворение – не только физический, но и химический процесс.
Гидраты, как правило, – это неустойчивые соединения, во многих случаях разлагающиеся при выпаривании растворов. Но иногда гидраты настолько прочны, что выделяющиеся из раствора кристаллы растворённого вещества содержат определённое количество молекул воды. Этот факт также является подтверждением химизма процессов растворения. Такие вещества, в состав кристаллов которых входят молекулы воды, называются кристаллогидратами, а содержащаяся в них вода – кристаллизационной. Примеры кристаллогидратов: CuSO4·5H2O, Na2SO4·10H2O, FeSO4·7H2O, Na2CO3·10H2O.
Прочность связи между веществом и кристаллизационной водой в кристаллогидратах различна. Некоторые из них (например, Na2CO3·10H2O) теряют кристаллизационную воду («выветриваются») уже при комнатной температуре. Для обезвоживания других кристаллогидратов (CuSO4·5H2O) требуется более сильное нагревание.
Под концентрацией раствора понимают содержание растворённого вещества в определённом объёме или массе раствора или растворителя. Растворы с большой концентрацией растворённого вещества называются концентрированными, с малой – разбавленными.
Существует много различных способов выражения концентрации растворов. Один из наиболее употребительных в химии и технике способов – это выражение концентрации растворённого вещества в виде массовой доли (процентной концентрации).
Массовая доля (процентная концентрация) показывает, сколько массовых частей растворённого вещества содержится в 100 массовых частях раствора. Если в качестве единицы массы выбрать грамм, то определение массовой доли можно также записать следующим образом: массовая доля (процентная концентрация) показывает, сколько граммов растворённого вещества содержится в 100 граммах раствора.
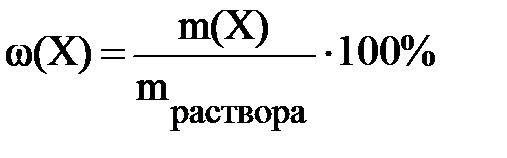
(6.1 а)
В формуле 6.1 а ω(X) – массовая доля растворённого вещества X; m(X) – масса растворённого вещества X; mраствора – масса раствора.
Если в формуле (6.1 а) не использовать множитель 100%, то массовая доля будет выражена не в процентах, а в долях единицы.
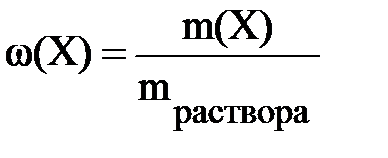
Понятно, что в этом случае, 30% раствору, например, будет соответствовать массовая доля ω = 0,3 .
Другим важнейшим способом выражения содержания растворённого вещества в растворе является молярная концентрация (молярность). Молярная концентрация показывает, сколько моль растворённого вещества содержится в 1 литре (т.е. 1 дм3) раствора.
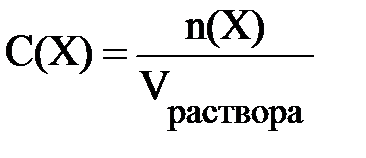 В формуле 6.2 C(X) – молярная концентрация вещества X в растворе (моль/л); n(X) – количество растворённого вещества Х (моль); Vраствора – объём раствора (л).
В формуле 6.2 C(X) – молярная концентрация вещества X в растворе (моль/л); n(X) – количество растворённого вещества Х (моль); Vраствора – объём раствора (л).
В технологических регламентах производственных процессов концентрацию растворов очень часто выражают массой растворённого вещества содержащегося в 1 литре раствора. Так, запись «концентрация сульфата натрия в растворе равна 25 г/л» означает, что в 1 литре раствора содержится 25 граммов растворённого Na2SO4.
Пример 6.1 Рассчитать молярную концентрацию 10% раствора ортофосфорной кислоты; плотность раствора 1,1 г/мл.
Массовая доля раствора 10 % означает, что в 100 граммах раствора содержится 10 граммов H3PO4. Следовательно,
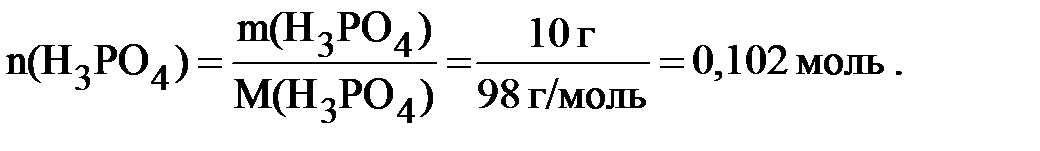
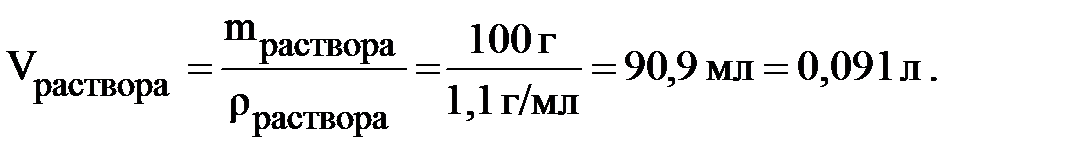
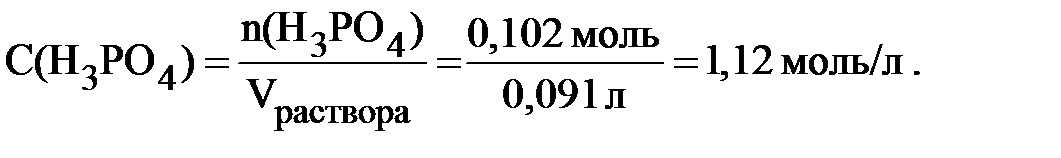 Этот же расчёт можно выполнить и другим способом.
Этот же расчёт можно выполнить и другим способом. 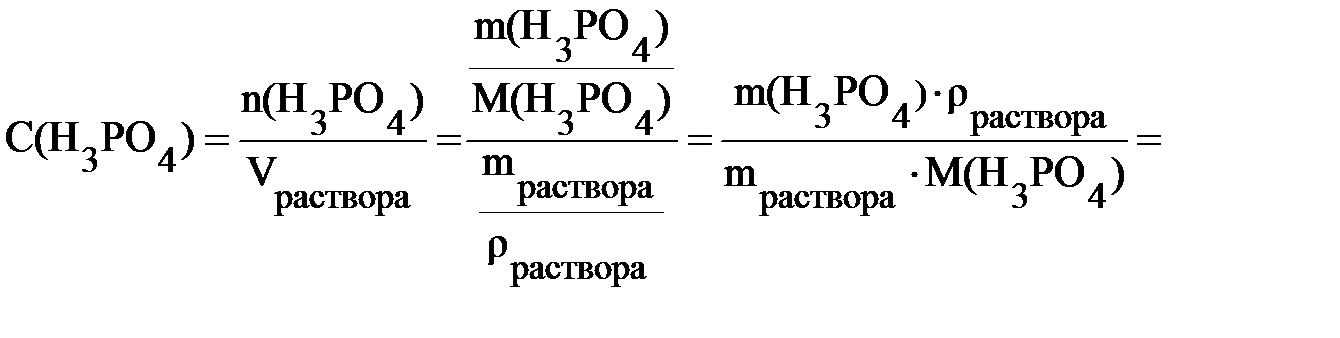
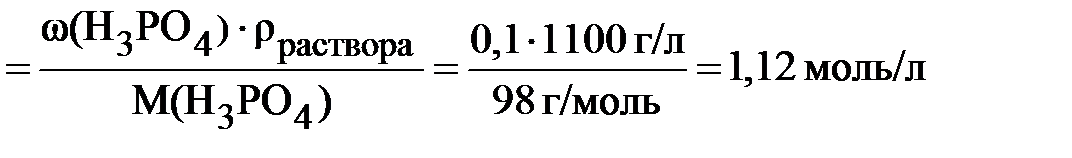
При выполнении расчёта вторым способом массовую долю следует выражать не в процентах, а в долях единицы, а плотность в г/л (1 г/мл = 1000 г/л).
Растворимостью называется способность вещества растворяться в том или ином растворителе. Количественной мерой растворимости вещества при данных условиях служит концентрация его насыщенного раствора. Поэтому растворимость может быть выражена в виде процентной, молярной концентрации растворённого вещества в насыщенном растворе. Очень часто растворимость выражают также числом граммов растворённого вещества, насыщающих 100 граммов растворителя (например, воды).
Растворимость разных веществ в воде может очень сильно различаться. Если в 100 граммах воды растворяется более 10 граммов вещества, то такое вещество считается хорошо растворимым; если растворяется менее 1 грамма вещества – малорастворимым, если менее 0,01 грамма вещества – практически нерастворимым. Следует, отметить, что абсолютно нерастворимых веществ не существует.
Принципы, позволяющие количественно предсказать растворимость вещества, в настоящее время неизвестны. Однако ещё со времён алхимиков известно правило «подобное растворяется в подобном», которое отражает тот факт, что вещества, состоящие из полярных молекул, и вещества с ионным типом связи (HCl, NaCl, H2SO4, K2SO4) лучше растворяются в полярных растворителях (вода, спирты, жидкий аммиак), а неполярные вещества (например, галогены) – в неполярных растворителях (бензол, сероуглерод и т.п.).
Растворение большинства твёрдых тел сопровождается тепловым эффектом: кристалл + растворитель ⇆ раствор ± Q .
Применяя принцип Ле-Шателье к равновесию растворения, легко спрогнозировать, что если вещество растворяется с поглощением тепла, то увеличение температуры приведёт к увеличению растворимости. Если же образование раствора сопровождается выделением тепловой энергии, растворимость с ростом температуры уменьшается.
Растворение газов в воде представляет собой экзотермический процесс, поэтому растворимость газов с повышением температуры уменьшается. Так, кипячением воды можно удалить растворённый в ней воздух, сероводород, аммиак и другие газы.
Если растворимость вещества уменьшается при понижении температуры, то при охлаждении насыщенных растворов избыток растворённого вещества обычно выделяется. Однако, если охлаждение проводить осторожно и медленно, не допуская попадания в раствор твёрдых частиц извне, то выделения избытка растворённого вещества может не произойти. В этом случае образуется раствор, содержащий значительно больше растворённого вещества, чем его требуется для насыщения при данной температуре. Такие растворы называются пересыщенными. В спокойном состоянии они могут длительное время оставаться без изменения. Но при попадании в пересыщенный раствор извне твёрдых частиц растворённого вещества и при встряхивании раствора, весь избыток растворённого вещества быстро выкристаллизовывается.
№7
Все химические реакции можно разделить на 2 группы: реакции необратимые, т.е. протекающие до полного израсходования одного из реагирующих веществ, и реакции обратимые, в которых ни одно из реагирующих веществ не расходуется полностью. Это связано с тем, что необратимая реакция протекает только в одном направлении. Обратимая же реакция может протекать как в прямом, так и в обратном направлении. Например, реакция Zn + H2SO4 ® ZnSO4+ H2протекает до полного исчезновения либо серной кислоты, либо цинка и не протекает в обратном направлении: металлический цинк и серную кислоту невозможно получить, пропуская водород в водный раствор сульфата цинка. Следовательно, эта реакция необратимая.
Классическим примером обратимой реакции может служить реакция синтеза аммиака из азота и водорода: N2 + 3 H2 ⇆ 2 NH3 .
Для понимания природы химического равновесия необходимо рассмотреть вопрос о скоростях прямой и обратной реакций. Под скоростью химической реакции понимают изменение концентрации исходного вещества или продукта реакции за единицу времени. При изучении вопросов химического равновесия концентрации веществ выражают в моль/л; эти концентрации показывают, сколько моль данного реагирующего вещества содержится в 1 литре сосуда. Например, утверждение «концентрация аммиака равна 3 моль/л» означает, что в каждом литре рассматриваемого объёма содержится 3 моль аммиака.
Химические реакции осуществляются в результате столкновений между молекулами, поэтому, чем больше молекул находится в единице объёма, тем чаще происходят столкновения между ними, и тем больше скорость реакции. Таким образом, чем больше концентрации реагирующих веществ, тем больше скорость реакции.
| Рис. 5.1 – Изменение скоростей прямой и обратной реакций во времени. |
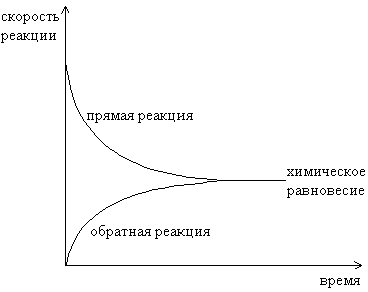 шаются, следовательно, уменьшается и скорость прямой реакции. Концентрация же продукта реакции постепенно возрастает, следовательно, возрастает и скорость обратной реакции. Через некоторое время скорость прямой реакции становится равна скорости обратной. Это состояние системы называется состоянием химического равновесия (рис. 5.1).
шаются, следовательно, уменьшается и скорость прямой реакции. Концентрация же продукта реакции постепенно возрастает, следовательно, возрастает и скорость обратной реакции. Через некоторое время скорость прямой реакции становится равна скорости обратной. Это состояние системы называется состоянием химического равновесия (рис. 5.1). В состоянии химического равновесия в системе не наблюдается никаких видимых изменений.
Например, концентрации всех веществ могут сколь угодно долго оставаться неизменными, если на систему не оказывать внешнего воздействия. Это постоянство концентраций в системе, находящейся в состоянии химического равновесия, совсем не означает отсутствия взаимодействия и объясняется тем, что прямая и обратная реакции протекают с одинаковой скоростью. Такое состояние также наз-т истинным химическим равновесием.Истинное химическое равновесие является динамическим равновесием.
От истинного равновесия следует отличать равновесие ложное. Постоянство параметров системы (концентраций веществ, давления, температуры) является необходимым, но недостаточным признаком истинного химического равновесия. Это можно пояснить следующим примером. Взаимодействие азота и водорода с образованием аммиака, как и разложение аммиака, протекает с заметной скоростью при высокой температуре (около 500 °С). Если при комнатной температуре смешивать в любых соотношениях водород, азот и аммиак, то реакция N2 + 3 H2 ⇆ 2 NH3 протекать не будет, и все параметры системы будут сохранять постоянное значение. Однако в данном случае равновесие является ложным, а не истинным, т.к. оно не является динамическим; в системе отсутствует химическое взаимодействие: скорость как прямой, так и обратной реакции равна нулю.
При дальнейшем изложении материала термин «химическое равновесие» будет использоваться применительно к истинному химическому равновесию.
Количественной характеристикой системы в состоянии химического равновесия является константа равновесия K.
Для общего случая обратимой реакции a A + b B + ... ⇆ p P + q Q + ...
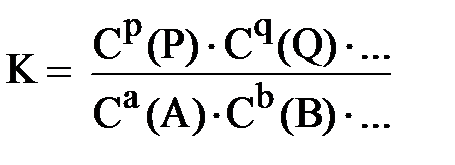 константа равновесия выражается следующей формулой: (5.1)
константа равновесия выражается следующей формулой: (5.1)
В формуле 5.1 С(А), С(B), С(P) С(Q) – равновесные концентрации (моль/л) всех веществ-участников реакции, т.е. концентрации, которые устанавливаются в системе в момент химического равновесия; a, b, p, q – стехиометрические коэффициенты в уравнении реакции.
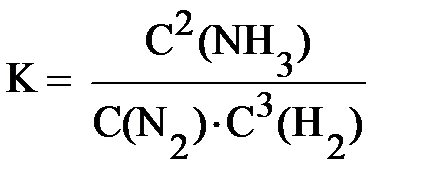 Выражение константы равновесия для реакции синтеза аммиака N2+3H2⇆2NH3 имеет следующий вид: (5.2)
Выражение константы равновесия для реакции синтеза аммиака N2+3H2⇆2NH3 имеет следующий вид: (5.2)
Таким образом, численная величина константы химического равновесия равна отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, причём концентрация каждого вещества должна быть возведена в степень, равную стехиометрическому коэффициенту в уравнении реакции.
Константа равновесия выражается через равновесные концентрации, но не зависит от них; напротив, соотношение равновесных концентраций участвующих в реакции веществ будет таким, чтобы соответствовать константе равновесия. Константа равновесия зависит от природы реагирующих веществ и температуры и представляет собой постоянную (при постоянной температуре) величину.
Если K >> 1, то числитель дроби выражения константы равновесия во много раз превышает знаменатель, следовательно, в момент равновесия в системе преобладают продукты реакции, т.е. реакция в значительной мере протекает в прямом направлении.
Если K << 1, то знаменатель во много раз превышает числитель, следовательно, в момент равновесия в системе преобладают исходные вещества, т.е. реакция лишь в незначительной степени протекает в прямом направлении.
Если К ≈ 1, то равновесные концентрации исходных веществ и продуктов реакции сопоставимы; реакция в заметной степени протекает как в прямом, так и в обратном направлении.
Следует иметь в виду, что в выражение константы равновесия входят концентрации только тех веществ, которые находятся в газовой фазе или в растворённом состоянии (если реакция протекает в растворе). Если в реакции участвует твёрдое вещество, то взаимодействие происходит на его поверхности, поэтому концентрация твёрдого вещества принимается постоянной и не записывается в выражение константы равновесия.
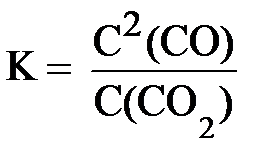 CO2 (газ) + C (тв.) ⇆ 2 CO (газ)
CO2 (газ) + C (тв.) ⇆ 2 CO (газ)
CaCO3 (тв.) ⇆ CaO (тв.) + CO2 (газ) K = C(CO2)
Ca3(PO4)2 (тв.) ⇆ 3Ca2+ (раствор) + 2PO43–(раствор) K = C3(Ca2+)·C2(PO43–)
№8
Система, находящаяся в состоянии химического равновесия, будет пребывать в нём до тех пор, пока внешние условия остаются постоянными. Если же изменить внешние условия (концентрации веществ, давление, температуру), то система выйдет из состояния равновесия, т.к. скорости прямой и обратной реакций изменятся неодинаково.
Процесс изменения концентраций веществ, вызванный нарушением равновесия, называется смещением равновесия. Если при этом происходит увеличение скорости прямой реакции, то принято говорить о смещении равновесия вправо, т.е. в сторону прямой реакции. Разумеется, что в результате смещения равновесия вправо происходит увеличение концентрации продуктов реакции. Если в результате смещения равновесия увеличивается скорость обратной реакции, то говорят, что равновесие смещается влево, т.е. в сторону обратной реакции; при смещении равновесия влево увеличивается концентрация исходных веществ.
Одним из способов смещения равновесия является изменение концентраций участвующих в реакции веществ за счёт введения в систему извне дополнительного количества реагента или его удаления из системы. Пусть H2, N2 и NH3 находятся в равновесии при определённых температуре и давлении. Если в систему ввести дополнительно некоторое количество исходного вещества, например, азота, и тем самым увеличить его концентрацию, то увеличится скорость прямой реакции, что приведёт к смещению равновесия вправо. В результате преимущественного протекания прямой реакции – взаимодействия азота с водородом – в системе начнёт увеличиваться концентрация аммиака, что повлечёт за собой постепенное увеличение скорости обратной реакции. Через некоторое время скорости прямой и обратной реакции снова сравняются, и установится новое состояние равновесия. Но при этом новая равновесная концентрация аммиака будет больше, чем она была до смещения равновесия, а концентрация водорода меньше. Естественно, что концентрация азота в результате смещения равновесия вправо тоже несколько уменьшится, но новая равновесная концентрация N2 будет большей, чем прежняя равновесная концентрация, которая наблюдалась до введения в систему дополнительного количества азота. Важно понимать, что увеличение концентрации аммиака и уменьшение концентрации водорода вызвано смещением равновесия вправо; более высокая новая равновесная концентрация азота объясняется введением в систему извне большого количества азота для смещения равновесия.
Сказанное можно проиллюстрировать следующим примером. Пусть в состоянии равновесия находятся азот, водород и аммиак в следующих концентрациях: С(N2) = 2 моль/л, С(H2) = 1 моль/л, С(NH3) = 0,5 моль/л.
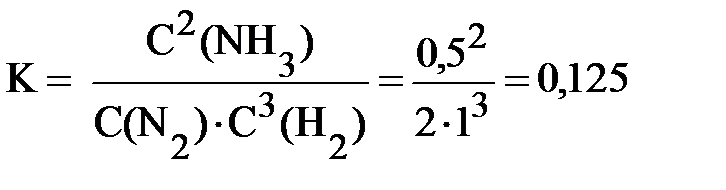
Предположим, в систему ввели дополнительно 1 моль/л азота. Если бы система никак не отреагировала на это внешнее воздействие, то концентрации всех участников реакции были бы следующими: C(N2) = 2 + 1 = 3 моль/л, C(H2) = 1 моль/л, C(NH3) = 0,5 моль/л. На самом же деле произойдёт смещение равновесия вправо, и концентрации всех веществ изменятся. Расчёты показывают, что новые равновесные концентрации будут таковы: C(N2) = 2,9766 моль/л; C(H2) = 0,9298 моль/л; C(NH3) = 0,5468 моль/л. В справедливости сделанных выводов можно убедиться, рассчитав константу равновесия для новых равновесных концентраций.
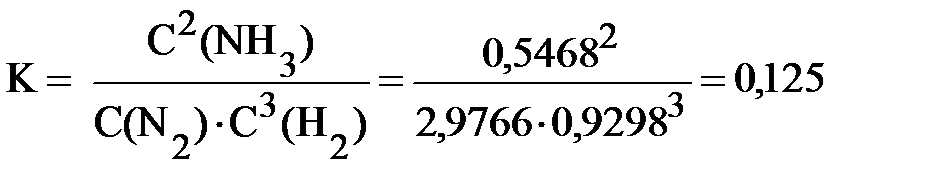
Как и должно быть, константа равновесия осталась неизменной. Из приведённого расчёта видно, что вследствие смещения равновесия вправо концентрация азота уменьшается от 3 до 2,9766 моль/л, но оказывается выше, чем была (2 моль/л) до введения в систему дополнительного количества азота.
Если из системы удалить некоторое количество азота, и тем самым уменьшить его концентрацию, то уменьшится скорость прямой реакции. Вследствие этого скорость обратной реакции окажется больше скорости прямой. Равновесие, таким образом, сместится влево. В результате преимущественного протекания обратной реакции – разложения аммиака – в системе будут увеличиваться концентрации азота и водорода, что повлечёт за собой постепенное увеличение скорости прямой реакции. Через некоторое время скорости прямой и обратной реакции снова сравняются, и установится новое состояние равновесия. При этом новая равновесная концентрация аммиака будет меньше, чем она была до смещения равновесия, а водорода больше. Концентрация азота в результате смещения равновесия влево тоже несколько увеличится, т.е. потеря азота будет частично скомпенсирована, но новая равновесная концентрация N2 будет меньшей, чем прежняя, которая наблюдалась до удаления азота из системы.
При увеличении концентрации какого-либо из веществ, участвующих в реакции, равновесие смещается в сторону расходования этого вещества, а при её уменьшении – в сторону образования этого вещества.
Если в реакции участвуют газообразные вещества, то в ряде случаев изменение давления также може
