Строение гидроксильной группы
Свойства спиртов и фенолов определяются строением гидроксильной группы, характером ее химических связей, строением углеводородных радикалов и их взаимным влиянием.
Связи О–Н и С–О – полярные ковалентные. Это следует из различий в электроотрицательности кислорода (3,5), водорода (2,1) и углерода (2,4). Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
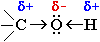
Дипольный момент связи С–О составляет 0,70D, а связи О–Н – 1,51D. Разрыв таких связей происходит преимущественногетеролитически (по ионному механизму).
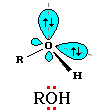 Атому кислорода в спиртах свойственна sp3-гибридизация. В образовании его связей с атомами C и H участвуют две 2sp3-атомные орбитали, валентный угол C–О–H близок к тетраэдрическому (около 108°). Каждая из двух других 2sp3-АО кислорода занята неподеленной парой электронов.
Атому кислорода в спиртах свойственна sp3-гибридизация. В образовании его связей с атомами C и H участвуют две 2sp3-атомные орбитали, валентный угол C–О–H близок к тетраэдрическому (около 108°). Каждая из двух других 2sp3-АО кислорода занята неподеленной парой электронов.
В фенолах под влиянием π-электронной системы бензольного кольца для атома кислорода предпочтительней sp2-гибридизация. При этом одна из неподеленных электронных пар находится на негибридной р-орбитали и может участвовать в сопряжении с ароматической π-системой.
Электронные эффекты ОН-группы. Гидроксигруппа проявляет отрицательный индуктивный эффект (–I-эффект) по отношению к углеводородному радикалу и в спиртах выступает как электроноакцепторный заместитель. В фенолах, где ОН-группа находится при sp2-атоме углерода, кроме того, она проявляет положительный мезомерный эффект (+M), предоставляя неподеленную электронную пару кислорода в π-систему сопряжения бензольного кольца (анимация, 6 Kб). Вследствие большей подвижности p-электронов +М-эффект сильнее, чем -I-эффект, т.е. гидроксигруппа в фенолах является электронодонорным заместителем (отрицательный заряд на атоме кислорода в феноле ниже, чем в предельных одноатомных спиртах).
Сравните распределение электронной плотности (зарядов на атомах) в молекулах метанола и фенола.
Билет 26.
АЛЬДЕГИДЫ И КЕТОНЫ
Альдегиды и кетоны относятся к карбонильным органическим соединениям.
Карбонильными соединениями называют органические вещества, в молекулах которых имеется группа >С=О (карбонил или оксогруппа).
Общая формула карбонильных соединений:
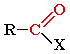
В зависимости от типа заместителя Х эти соединения подразделяют на:
альдегиды ( Х = Н );
кетоны ( Х = R, R' );
карбоновые кислоты ( Х = ОН )
и их производные ( Х = ОR, NH2, NHR, Hal и т.д.).
Альдегиды – органические соединения, в молекулах которых атом углерода карбонильной группы (карбонильный углерод) связан с атомом водорода.
Общая формула: R–CН=O или
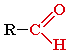 | R = H, алкил, арил |
Функциональная группа –СН=О называется альдегидной.
Кетоны – органические вещества, молекулы которых содержат карбонильную группу, соединенную с двумя углеводородными радикалами.
Общие формулы: R2C=O, R–CO–R' или
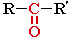 | R, R' = алкил, арил |
Примеры:
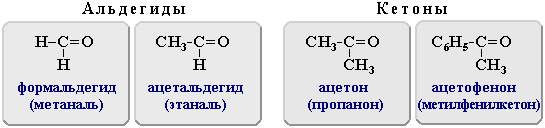
| Модели простейших карбонильных соединений | ||
| Название | Формула | Модель |
| Формальдегид (метаналь) | H2C=O |  |
| Ацетальдегид (этаналь) | СH3-CH=O |  |
| Ацетон (пропанон) | (СH3)2C=O |  |
Строение карбонильной группы C=O
Свойства альдегидов и кетонов определяются строением карбонильной группы >C=O.
Атомы углерода и кислорода в карбонильной группе находятся в состоянии sp2-гибридизации. Углерод своими sp2-гибридными орбиталями образует 3 σ-связи (одна из них – связь С–О), которые располагаются в одной плоскости под углом около 120° друг к другу. Одна из трех sp2-орбиталей кислорода участвует в σ-связи С–О, две другие содержат неподеленнные электронные пары.
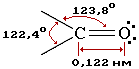
π-Связь образована р-электронами атомов углерода и кислорода.
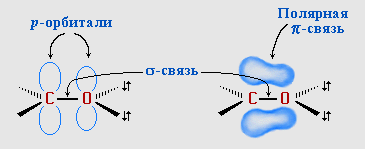
Связь С=О сильно полярна. Ее дипольный момент (2,6-2,8D) значительно выше, чем у связи С–О в спиртах (0,70D). Электроны кратной связи С=О, в особенности более подвижные π-электроны, смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд (см. распределение зарядов).
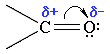
Поэтому углерод подвергается атаке нуклеофильными реагентами, а кислород - электрофильными, в том числе Н+.
В молекулах альдегидов и кетонов отсутствуют атомы водорода, способные к образованию водородных связей. Поэтому их температуры кипения ниже, чем у соответствующих спиртов. Метаналь (формальдегид) – газ, альдегиды С2-C5 и кетоны С3-С4 – жидкости, высшие – твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает.
