Влияние концентрации на скорость химической реакции
Зависимость скорости реакции от концентрации реагирующих веществ сформулирована в законе действующих масс:“При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам”
Например: для реакции mA+nB→pAB
математическое выражение закона действующих масс:
υ = k [A]m ∙ [B]n (иначе– кинетическое уравнение реакции),
где [A] и [B] - концентрации реагирующих веществ А и В;mиn– стехиометрические коэффициенты;k– коэффициент пропорциональности, названный константой скорости.
Физический смысл константы скорости заключается в том, что при концентрациях реагирующих веществ равных 1,0 моль/л([A]=[B] = 1моль/л), скорость химической реакции равна константе скорости (υ=k). Константа скорости зависит только от природы реагирующих веществ и от температуры, но не зависит от концентрации веществ.
Математическая запись закона действующих масс для гомогенных и гетерогенных систем имеет некоторые отличия. Для гетерогенных реакций в кинетическое уравнение входят концентрации только тех веществ, которые находятся в системе в растворе или в газовой фазе. Концентрация же веществ, находящихся в твердом состоянии на поверхности в течение реакции остается постоянной, поэтому ее величина учитывается в константе скорости реакции.
Например: для гомогенной реакции2H2(г)+O2(г)= 2H2O(г)
выражение закона: υ = k∙ [H2]2∙ [O2];
для гетерогенной реакцииС(тв)+O2(г)=СО2(г)
выражение закона υ = k эф∙ [O2]
Элементарной называют реакцию прямого превращения молекул исходных веществ в молекулы продуктов реакции. Элементарная реакция состоит из большого числа однотипных элементарных актов химического превращения.
Число молекул, участвующих в элементарном акте химического превращения, называют молекулярностьюреакции 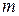 . Если в результате элементарного акта химического превращения изменение претерпевает одна молекула, реакцию называют мономолекулярной (
. Если в результате элементарного акта химического превращения изменение претерпевает одна молекула, реакцию называют мономолекулярной ( 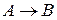 ), 2 – бимолекулярной (
), 2 – бимолекулярной ( 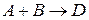 ), 3 – тримолекулярной (
), 3 – тримолекулярной ( 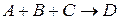 ). Элементарных химических актов с одновременным участием 4 молекул не бывает, так как вероятность одновременного столкновения четырех молекул ничтожно мала.
). Элементарных химических актов с одновременным участием 4 молекул не бывает, так как вероятность одновременного столкновения четырех молекул ничтожно мала.
Молекулярность реакции равна сумме стехиометрических коэффициентов, выражающих число молекул, участвующих в элементарном акте химического превращения. Так для бимолекулярной реакции (210) 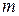 определиться как
определиться как
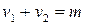 .
.
Таким образом, молекулярность реакции равна: 1, 2 и реже 3.
Если реакция (210) выражает элементарный акт химического взаимодействия, то скорость реакции можно выразить:
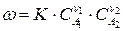 , (211)
, (211)
Большинство химических реакций являются сложными и включают несколько элементарных стадий химического превращения, каждая из которых может быть моно-, би- или реже тримолекулярной. Стадии могут сильно различаться по своим скоростям. Самая медленная стадия химической реакции определяет скорость процесса и называетсялимитирующей. Лимитирующая стадия может быть одна, или их может быть несколько, когда две или несколько стадий протекают с близкими скоростями.
Если механизм реакции не изучен и лимитирующая стадия не выявлена, то закон действия масс (211) применяют формально для описания скорости сложных реакции. Если уравнение (210) отражает протекание сложной реакции, то ее скорость можно выразить:
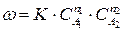 , (212)
, (212)
где 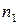 ,
, 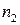 – эмпирические коэффициенты, которые называют частными порядками химической реакции по данному веществу;
– эмпирические коэффициенты, которые называют частными порядками химической реакции по данному веществу;
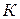 – константа скорости реакции.
– константа скорости реакции.
Сумму частных порядков 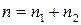 – называют порядком химической реакции. Частные порядки реакции в общем случае не равны стехиометрическим коэффициентам и могут совпадать с ними лишь для элементарных реакций. Частные порядки и общий порядок реакции определяются только экспериментально. Порядок реакции может принимать значения целые, дробные, отрицательные и может быть равен нулю.
– называют порядком химической реакции. Частные порядки реакции в общем случае не равны стехиометрическим коэффициентам и могут совпадать с ними лишь для элементарных реакций. Частные порядки и общий порядок реакции определяются только экспериментально. Порядок реакции может принимать значения целые, дробные, отрицательные и может быть равен нулю.
