Лабораторная работа № 7. «Идентификация фенолов»
Цель: изучить методы идентификации фенолов
Формируемые умения:
· осуществлять цветную реакцию фенолов с хлоридом железа (III)
· осуществлять взаимодействие фенола с бромом в водном растворе
· получать и разлагать феноляты
· проводить реакцию фенола с азотистой кислотой.
Реактивы и оборудование: фенол, 1% раствор хлорида железа(III), 1% раствор пирокатехина, 1% раствор резорцина, 1% раствор гидрохинона и 1% спиртовой раствор 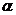 -нафтола, бромная вода, 2М раствор гидроксида натрия, 2 М раствор карбоната натрия, 2 М раствор серной кислоты, 2 М раствор гидрокарбоната натрия, 5% раствор фенола, 5% раствор нитрит натрия, концентрированная серная кислота, раствор иодида калия, бензол, пипетки, штатив с пробирками, спиртовка, держатель для нагревания пробирки.
-нафтола, бромная вода, 2М раствор гидроксида натрия, 2 М раствор карбоната натрия, 2 М раствор серной кислоты, 2 М раствор гидрокарбоната натрия, 5% раствор фенола, 5% раствор нитрит натрия, концентрированная серная кислота, раствор иодида калия, бензол, пипетки, штатив с пробирками, спиртовка, держатель для нагревания пробирки.
Методика
1. Качественные реакции обнаружения фенолов: цветная реакция с хлоридом железа (III).
В пробирку поместите 3 капли «жидкого» фенола и добавьте 1 каплю 1%-го раствора хлорида железа(III). Появляется фиолетовое окрашивание.
Аналогичные опыты проделайте с 1%-ми растворами пирокатехина, резорцина, гидрохинона и 1%-м спиртовым раствором 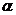 -нафтола (или
-нафтола (или 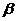 -нафтола). Отметьте в каждом случае появление характерного окрашивания.
-нафтола). Отметьте в каждом случае появление характерного окрашивания.
Почему эта реакция служит качественной пробой для обнаружения? Объясните, почему для обнаружения нафтолов используются не водные, а спиртовые растворы.
2. Взаимодействие фенола с бромом в водном растворе
В пробирку внесите 1 каплю «жидкого» фенола и 2 капли воды. К возникшей при встряхивании эмульсии добавьте 6-7 капель бромной воды. Выпадает обильный белый осадок 2,4,6-трибромофенола. При добавлении в пробирку еще 2-3 капель бромной воды. 2,4,6-трибромофенол окисляется в так называемый «тетрабромофенол» (2,4,4,6-тетрабромоциклогексадиен-2,5-он), о чем свидетельствует превращение белого осадка в светло-желтый.
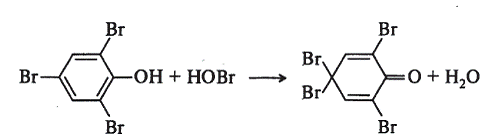
Доказательство образования «тетрабромофенола». Для удаления избытка брома содержимое пробирки прокипятите в течение 1 мин и охладите. При этом растворившийся при кипячении осадок «тетрабромофенола» вновь выпадает после охлаждения пробирки. К суспензии добавьте 2 капли 10%-го раствора иодида калия, 0,5 мл бензола и энергично встряхните. Происходит экстракция бензолом выделившегося иода, и бензольный слой приобретает красно-фиолетовую окраску.
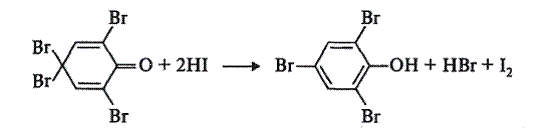
Почему реакция бромирования служит качественной для обнаружения фенолов. Объясните легкость бромирования фенола.
3. Реакция фенола с азотистой кислотой.В пробирку помещают 0,5 мл концентрированной серной кислоты и при охлаждении добавляют 2—3 капли раствора фенола. К полученному бесцветному раствору при охлаждении прибавляют каплю раствора нитрита натрия. Образуется интенсивно окрашенная смесь. При растворении ее в разбавленной кислоте появляется розовая окраска, а при растворении в щелочи — зелено-синяя. Напишите уравнение реакции.
4. Образование и разложение фенолятов. К 0,1—0,3 г фенола прибавляют 1—2 мл раствора гидроксида натрия. Постепенно происходит растворение фенола. Смесь нагревают до получения однородной жидкости. К охлажденному раствору приливают разбавленную серную кислоту. Наблюдается помутнение раствора.
Напишите уравнение образования фенолята натрия. Объясните причину помутнения смеси при взаимодействии с серной кислотой.
Литература для самостоятельной работы
Органическая химия: Учебник для вузов: В 2 кн./В.Л. Белобородов, С.Э. Зурабян, А.П. Тюкавкина; Под ред. Н.А. Тюкавкиной. - М.: Дрофа, 2002. – Кн. 1: Основной курс. – 620с. (С. 363 – 390)
