Лабораторно-практическое занятие № 7. «Электронная строение атомов органогенов и химической связи» (2ч)
Цель:сформировать умения определять тип гибридизации атомов органогенов, давать характеристику химической связи и изображать схематически электронное строение молекул
Вопросы для обсуждения:
1. Электронная конфигурация атома углерода. Виды гибридизации атомных орбиталей атомов-органогенов.
2. Понятие о изоэлектронных структурах.
3. Ковалентная связь: понятие, механизмы образования, типы.
4. Характеристики ковалентных связей и методы их определения.
5. Водородная связь и другие слабые межмолекулярные взаимодействия.
Материалы и примеры для самостоятельного изучения
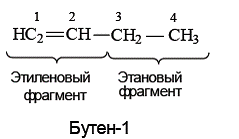
Пример 1. Определите вид гибридизации атомных орбиталей атома углерода в бутене-1 . Какие типы углерод-углеродных связей имеются в соединении?
Решение. Атом углерода в основном (невозбужденном) состоянии имеет четыре валентных электрона, занимающих неравноценные 2s- и 2p-орбитали. В основном состоянии число неспаренных электронов у атома углерода меньше числа образуемых им связей. В то же время из экспериментальных данных известно, что углерод в большинстве органических соединений проявляет валентность, равную четырем, и образует четыре ковалентные связи. Это можно объяснить тем, что при переходе в возбужденное состояние один электрон с 2s-орбитали переходит на свободную 2p-орбиталь.
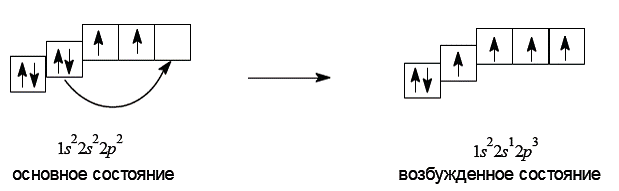
В возбужденном состоянии один электрон занимает сферическую 2s-орбиталь, а три других – 2p-орбитали, имеющие форму гантелей.
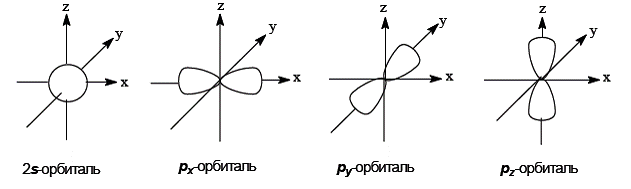
Такая модель не позволяет объяснить, например, равноценность всех четырех связей в метане, образование двойных и тройных углерод-углеродных связей и многие другие экспериментальные факты. Поэтому вводится представление о гибридизацииатомных орбиталей, согласно которому набор из одной s- и трех, двух или одной p-орбиталей заменяется набором соответственно четырех, трех или двух гибридных орбиталей одинаковой формы и энергии. Гибридные орбитали за счет большего перекрывания обеспечивают образование более прочных связей, чем негибридные орбитали. В зависимости от числа участвующих в гибридизации орбиталей атом углерода может находиться в трех видах гибридизации: sр3, sp2, sp.
Первое валентное состояние, sр3-гибридизация. В состоянии sр3-гибридизации четыре атомные орбитали (АО) возбужденного атома углерода (одна s- и три р-) заменяются набором из четырех эквивалентных по энергии sр3-гибридных орбиталей, имеющих форму объемных восьмерок.
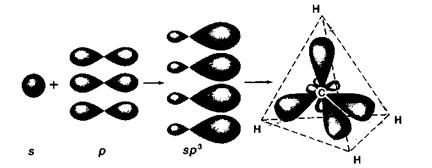
sр2-Гибридные орбитали располагаются в пространстве на максимальном удалении друг от друга, так что их оси симметрии направлены в вершины правильного тетраэдра под углом 109,5° друг к другу (рис. ). Таким образом, атом углерода в sр3-гибридизации имеет тетраэдрическую (тетрагональную) конфигурацию. В sр3-гибридном состоянии атом углерода находится в молекулах алканов.
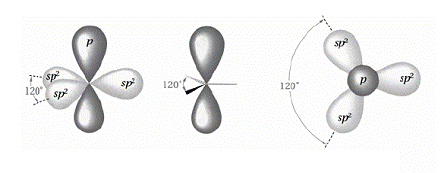
Второе валентное состояние, sр2-гибридизация.В sp2-гибридном состоянии одна 2s АО и две 2р АО заменяются набором из трех одинаковых sp2-гибридных орбиталей, лежащих в одной плоскости под углом 120°.
Четвертая, негибридизованная р-орбиталь располагается перпендикулярно к этой плоскости (рис. ). Атом углерода в sp2-гибридизации имеет плоскостную (тригональную) конфигурацию. В состоянии sp2-гибридизации атом углерода находится в молекулах алкенов, в карбонильной С=О и карбоксильной группах.
Молекулу бутена-1 можно представить состоящей из двух фрагментов – этиленового (C-1 и С-2) и этанового (С-3 и С-4).
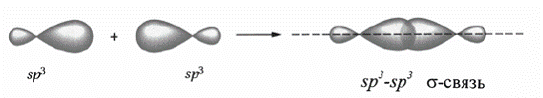
В этановом фрагменте атомы углерода находятся в sр3-гибридизованном состоянии, имеют тетраэдрическую конфигурацию и связаны между собой ординарной σ-связью (рис. ).

σ -связь – это связь, которая образуется при осевом перекрывании АО. Максимум электронной плотности при этом располагается на оси, соединяющей ядра атомов.
Атомы водорода как в этановом фрагменте, так и в этиленовом также связаны с атомами углерода σ- связью (рис. ).
В этиленовом фрагменте атомы углерода находятся в sp2-гибридном состоянии и связаны двойной связью, которая представляет собой комбинацию одной - σ- и одной 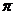 -связи.
-связи. 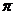 -связь образуется в результате осевого перекрывания двух sp2-гибридных орбиталей атомов углерода (рис. ). Атомы водорода соединены с C-1 и С-2 также σ- связями.
-связь образуется в результате осевого перекрывания двух sp2-гибридных орбиталей атомов углерода (рис. ). Атомы водорода соединены с C-1 и С-2 также σ- связями. 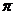 -Связь образуется за счет бокового перекрывания негибридных pz-атомных орбиталей атомов углерода.
-Связь образуется за счет бокового перекрывания негибридных pz-атомных орбиталей атомов углерода.
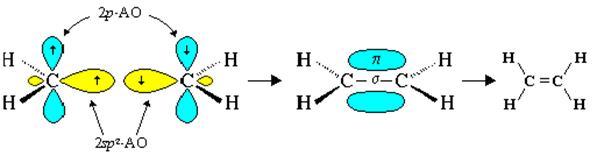
Заключение.Два атома углерода в молекуле бутена-1 (C-1 и С-2) находятся в sp2-гибридном состоянии и связаны двойной связью. Связанные ординарной связью атомы С-3 и С-4 находятся в состоянии sp3-гибридизации.
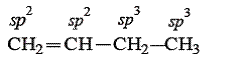
Задачи для самостоятельного решения
Задание 7.1. Укажите тип гибридизации атомов углерода в соединениях:
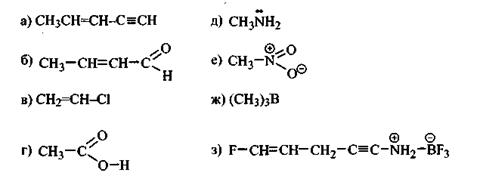
Задание 7.2.Дайте определение понятия «химическая связь». Охарактеризуйте основные типы химической связи. Какие химические связи реализуются в молекулах веществ, структурные формулы которых приведены:
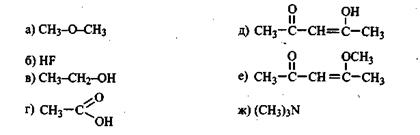
Задание 7.3.Охарактеризуйте понятие «электроотрицательность» атома. Определите, какие из связей неполярные или слабополярные, а какие — полярные и ионные: С—Н, С—С, С—О, 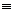 С—Na, С-С1, С-К, C-I.
С—Na, С-С1, С-К, C-I.
Задание 7.4. Дайте характеристику каждой химической связи по следующим параметрам: число электронов связывания; механизм обобществления электронов; тип гибридизации каждого атома-органогена, участвующего в образовании связи; тип перекрывания.
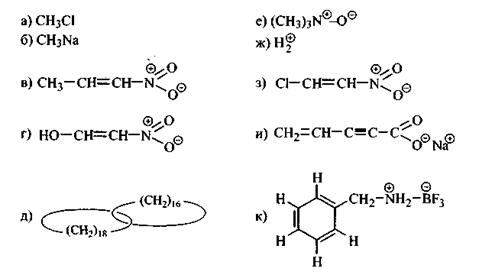
Задание 7.5. Какие виды  -связей и в каком количестве реализуются в молекуле 1,2-дихлорэтана?
-связей и в каком количестве реализуются в молекуле 1,2-дихлорэтана?
Задание 7.6. Охарактеризуйте понятие « 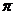 -связь». Какие виды
-связь». Какие виды 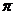 -связей существуют? Нарисуйте схемы образования
-связей существуют? Нарисуйте схемы образования 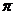 -связей в молекулах этилена С2Н4 и ацетилена С2Н2.
-связей в молекулах этилена С2Н4 и ацетилена С2Н2.
Задание 7.7. Какие виды 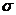 - и
- и 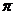 -связей реализуются в молекулах 2-метилбутена-1, пентина-2?
-связей реализуются в молекулах 2-метилбутена-1, пентина-2?
Задание 7.8.Пользуясь представлениями о граничных поверхностях атомных орбиталей и соблюдая валентные углы, изобразите схему строения молекулы метана, этана, этилена, пропена, ацетилена, пропина, циклобутена. Укажите значения валентных углов у каждого атома углерода; определите виды 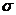 -связей в этих молекулах.
-связей в этих молекулах.
Задание 7.9. В каких соединениях следует ожидать образования водородных связей? Укажите тип.
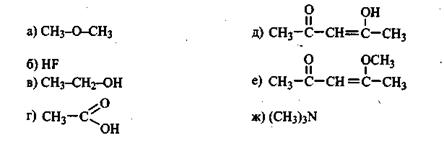
Литература для самостоятельной работы
1. Органическая химия: Учебник для вузов: В 2 кн./В.Л. Белобородов, С.Э. Зурабян, А.П. Тюкавкина; Под ред. Н.А. Тюкавкиной. - М.: Дрофа, 2002. – Кн. 1: Основной курс. – 620с. (С. 39-54)
2. Органическая химия (в вопросах и ответах) / Под ред. Б. А. Ивина и Л. Б. Пиотровского. — СПб.: Наука, 2002. — 510 с. (С. 21-40)
