Окислительно-восстановительные процессы в химии
Тезисы лекции:
Окислительно-восстановительными реакциями (ОВР) называют такие реакции, в ходе которых у атомов или ионов изменяется степень окисления.
Все ОВР в зависимости от того, между какими атомами и каких веществ происходит переход электронов, можно разделить на 4 группы:
межмолекулярные – переход электронов происходит между частицами различных веществ, т.е. окислитель и восстановитель находятся в разных веществах.
внутримолекулярные ОВР – реакции, в которых окислитель и восстановитель входят в состав одной и той же частицы (молекулы, комплексного иона).
реакции диспропорционирования – в таких реакциях происходит самоокисление и самовосстановление атомов одного и того же вида.
Реакции компропорционирования – окислителем и восстановителем являются производные одного и того же элемента, но в разных степенях окисления, в ходе реакции они превращаются в одно и то же вещество.
Для составления уравнений ОВР используют метод полурекций (для гидрохимических процессов) и метод электронного баланса (для твердофазных процессов).
Алгоритм составления уравнений ОВР методом полуреакций:
1. Записывают молекулярную схему процесса
2. Составляют ионную схему процесса, руководствуясь общими правилами составления ионных уравнений, т.е. записывают сильные электролиты в виде ионов, а неэлектролиты, слабые электролиты и осадки – в виде молекул. Не изменяющиеся в результате реакции ионы, в ионную схему не включаются.
3. Составляют электронно-ионное уравнение (полуреакцию) процесса окисления.
4. Составляют электронно-ионное уравнение (полуреакцию) процесса восстановления. Обе полуреакции должны быть сбалансированы по числу атомов каждого сорта и должен соблюдаться закон сохранения зарядов.
5. Коэффициенты в общем ионном уравнении находят суммированием всех электронно-ионных реакций так, чтобы число электронов, отдаваемых восстановителем, равнялось числу электронов, присоединяемых окислителем.
6. Молекулярное уравнение процесса получают добавлением к ионам, входящим в ионное уравнение, необходимого числа противоионов, нейтрализующих их заряд в растворе, но не участвующих в реакции.
Реакции окисления-восстановления могут протекать в различных средах: в кислой, нейтральной и щелочной. ОВР, результат которых зависит от характера раствора, описываются более сложными уравнениями.
Прибор, позволяющий получать ток за счет самопроизвольно протекающих в обычных условиях ОВР, называют гальваническим элементом. Появление электрического тока в гальванических элементах объясняют следующим образом. При погружении пластинки металла в воду, диполи воды «вытягивают» ионы металла в раствор. При этом металл заряжается отрицательно. Гидратированные положительные ионы притягиваются поверхностью пластины, и на границе металла с раствором образуется двойной электрический слой. Когда устанавливается равновесие, на границе металла и раствора, возникает разность потенциалов (скачок потенциала). Эту разность потенциала называют равновесным электродным потенциалом металла.
Гальванический элемент состоит из электродов, или полуэлементов: в одном протекает процесс окисления металла, в другом – процесс восстановления ионов. К окислительно-восстановительным гальваническим элементам относятся такие элементы, которые состоят из двух окислительно-восстановительных электродов. Причем каждый из электродов представляет собой пластинку из благородного металла, опущенную в раствор разнозаряженных ионов. Потенциал, возникающий на границе соприкосновения пластинки с раствором, называется окислительно-восстановительным или редокс-потенциалом. Так как невозможно определить абсолютное значение электродных потенциалов и редокс-потенциалов, определяем только разность потенциалов, относительно нулевого потенциала. Таким нулевым потенциалом считают потенциал водородного электрода. Электродвижущая сила гальванического элемента, состоящего из измеряемого электрода и стандартного водородного электрода, измеренная при 298К, является величиной стандартного электродного потенциала данного электрода. Стандартный электродный потенциал обозначают Е0.
Располагая металлы в порядке возрастания стандартных электродных потенциалов, получают ряд напряжений, или электрохимический ряд активности металлов.
Стандартные электродные и окислительно-восстановительные потенциалы характеризуют окислительно-восстановительную способность веществ по отношению друг к другу в реакциях, протекающих в водных растворах. Чем больше эта величина, тем больше их окислительные свойства.
Если требуется сравнить две окислительно-восстановительные системы друг с другом и выяснить, в каком направлении может протекать реакция между системами, то нужно сопоставить их стандартные потенциалы. Система, характеризующаяся более положительным потенциалом, будет играть роль окислителя, т.е. присоединять электроны. Подобные заключения относятся к стандартным потенциалам, т.е. к окислительно-восстановительным системам, в которых концентрации (активности) окислителей и восстановителей равны. При других отношениях концентраций возможно и обратное течение реакций.
Итак, на основании ряда редокс-потенциалов можно количественно оценить активность окислителя и восстановителя, а также направление окислительно-восстановительной реакции.
В справочниках приводятся стандартные электродные и стандартные редокс-потенциалы. В то же время на величину электродного потенциала существенно влияет температура и концентрация раствора. Эта зависимость выражается уравнением Нернста: Е=Е0 + 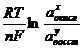 .
.
Основная литература:1-6
Дополнительная литература:11, 12, 14, 16, 17, 20-30
Тема лекции:
