Относительная и абсолютная конфигурации.
Определение абсолютной конфигурации, т.е. истинного расположения в пространстве заместителей у хирального центра, стало возможным только с появлением высокоразрешающих физико-химических методов, в частности рентгеноструктурного анализа. Первым соединенем, для которого в 1951 году удалось определить абсолютную конфигурацию, была (+) –винная кислота.
Установление абсолютной конфигурации – трудоемкий процесс. После выснения абсолютных конфигураций нескольких соединений появилась возможность характеризовать все остальные путем сравнения их конфигураций с конфигурациями эталонных (ключевых ) соединений, т.е. определять относительные конфигурации. По предложению М.А. Розанова в 1906 году (еще задолго до появления реальной возможности установления абсолютной конфигурации) за конфигурационный стандарт был принят глицериновый альдегид.Его право- и левовращающим энантиомерам были приписаны определенные конфигурации, обозначенные как D(+) и L(–) – глицериновые альдегиды.
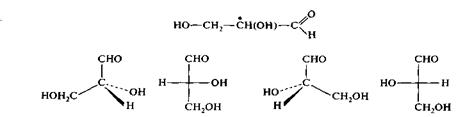 |
Конфигурациооный стандарт
D(+)– глицериновый альдегид L(–) – глицериновый альдегид
Правильность произвольно приписанной (+) – глицериновому альдегиду конфигурации в дальнейшем была подтверждена экспериментально и проибрела силу абсолютной конфигурации, а буквы D и L стали символами стереохимической номенклатуры.
Хиральность характерна для всех природных аминокислот, кроме глицина, поскольку их молекулы содержат асимметричный атом углерода, вокруг которого располагаются четыре различных заместителя (—R, —Н, — СОО-, —NН+3):
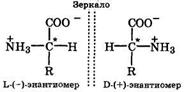 |
Оптические изомеры на примере α-аминокислоты
Оптические изомеры α-аминокислот в соответствии с их истинной конфигурацией обозначаются буквами L и D, а по новой системе — S и R соответственно. Природные α-аминокислоты в подавляющем большинстве относятся к L(S)-энантиомерам ле-вовращающим (-). Использование для построения белков в организме человека только L-энантиомеров имеет важнейшее значение для формирования пространственной структуры белков. С этим непосредственно связана стереоспецифичность действия ферментов. Молекулы ферментов хиральны и вступают во взаимодействие только с теми субстратами, которые также имеют определенную конфигурацию. Поэтому биологической активностью обычно обладает лишь один стереоизомер, а другие значительно менее активны или вообще неактивны.
Связь пространственного строения соединений с их биологической активностью.В организме реакции протекают с участием биокатализаторов – ферментов. Ферменты построены из хиральных молекул α-аминокислот. Поэтому они могут играть роль хиральных реагкнтов, чувствительных к хиральности взаимодействующих с ними субстратов. Таким образом, пространственное строение молекул связано со стереоспецифичностью биохимических процессов.
Стереспецифичность процессов, протекающих в организме, состоит в том, что в реакцию вовлекаются определенные стереизомеры и результатом реакции являются также стереохимически ориентированные продукты.
Стереоспецифичность лежит в основе проявления биологического действия одним из энантиомеров, в то время как другой энантиомер может быть неактивным, а иногда оказывать иное или даже противоположное действие.
Многие лекарственные вещества проявляют фармакологический эффект при взаимодействии с рецепторами клетки. Для этого необходимо, чтобы молекула лекарственного вещества имела такую конфигурацию, которая позволяла бы наиболее полно связываться с рецептором. Изменение конфигурации на противоположную, как правило, снижает степень связывания и ослабляет биологическое действие. Например, из двух энантиомеров адреналина наибольшую гормональную активность проявляет левовращающий адреналин, являющийся (R)-изомером (рис. 5, а). У правовращающего энантиомера — (S)-адреналина — ОН-группа ориентирована в пространстве иначе и не взаимодействует с рецептором (рис. 5, б). Этот энантиомер адреналина способен связываться не с тремя, а только с двумя точками рецептора, что приводит к ослаблению фармакологического действия. Это подтверждается тем фактом, что пониженная активность (+)-адреналина сравнима с активностью, проявляемой дезоксиадреналином, не содержащим ОН-группы.
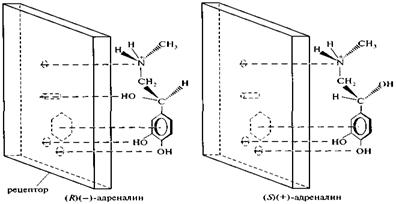
Рис. 5. Схема взаимодействия энантиомеров адреналина с рецептором
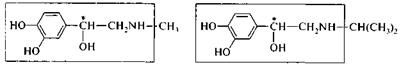 |
Аналогичная картина характерна для ряда лекарственных веществ, родственных по строению адреналину. (+)-Изопропиладреналин (изадрин) проявляет в 800 раз более сильное бронхорасширяющее действие, чем его левовращающий энантиомер. Лекарственное средство противоопухолевого действия (–) сарколизин - является левовращающим энантиомером; (+)-сарколизин не активен.
адреналин изадрин
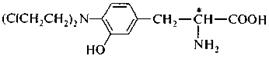 |
сарколизин
Таким образом, биологическое действие биорегуляторов (гормоны, витамины, антибиотики и др.) и лекарственных веществ связано с пространственным строением их молекул.
