Водородный показатель среды рн
Цель работы: определение водородного показателя среды методами рН-метрии и визуального колориметрирования; проведение расчетов рН водных растворов сильных и слабых кислот и оснований.
Водородный показатель среды водного раствора электролита рН равен взятому с обратным знаком десятичному логарифму активности ионов водорода в этом растворе: 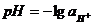
Среда водного раствора электролита может быть кислой, нейтральной или щелочной. Носителями кислотных свойств являются ионы Н+, а основных – ионы ОН-, поэтому в кислых растворах 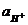 >
> 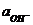 , а в щелочных –
, а в щелочных – 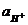 <
< 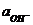 . Растворы, в которых
. Растворы, в которых 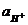 =
= 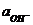 ,называют нейтральными.
,называют нейтральными.
При электролитической диссоциации воды образуется равное количество ионов Н+ и ОН-:
Н2О Û Н+ + ОН-
Константа диссоциации воды при 295 К равна 1,8´10-16, а 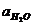 при той же температуре равна примерно 55,56 моль/л:
при той же температуре равна примерно 55,56 моль/л:
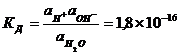
Отсюда 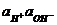 = 1,8´10-16´55,56 = 10-14.
= 1,8´10-16´55,56 = 10-14.
Величина Kw = 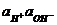 называется ионным произведением воды. При 295 К Kw = 10-14. В нейтральных растворах
называется ионным произведением воды. При 295 К Kw = 10-14. В нейтральных растворах 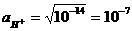 моль/л (рН = 7), в кислых растворах
моль/л (рН = 7), в кислых растворах 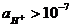 моль/л (рН < 7), в щелочных растворах
моль/л (рН < 7), в щелочных растворах 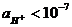 моль/л (рН > 7).
моль/л (рН > 7).
Наряду с показателем рН используется показатель рОН:
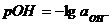
Исходя из значения ионного произведения воды Кw при 295 К
рН + рОН = 14.
При расчете водородного показателя среды водных растворов сильных кислот и оснований следует учитывать необратимость процесса их электролитической диссоциации (a = 1):
НС1 Þ Н+ +Сl-
NaOH Þ Na+ + ОН-
Концентрация ионов Н+ в растворах сильных кислот и концентрация ионов ОН- в растворах щелочей численно равны молярности растворов. Например, сн+ в 0,001 М растворе НС1 равна 0,001 моль/л, а сон- в 0,01 М растворе NaOH равна 0,01 моль/л.
Чтобы вычислить значение водородного или гидроксильного показателя среды (рН или рОН), нужно знать активность ионов Н+ или ОН- ( 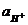 или
или 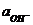 ):
): 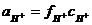 и
и 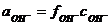 . Коэффициенты активности ионов вычисляют или находят по справочным таблицам как функцию ионной силы раствора.
. Коэффициенты активности ионов вычисляют или находят по справочным таблицам как функцию ионной силы раствора.
При расчете водородного показателя среды водных растворов слабых кислот и оснований следует учитывать обратимость процесса их электролитической диссоциации (α<1):
СН3СООН Û СНзСОО- + Н+
NH4OH Û NН4+ +ОН-
Н2СО3 Û Н+ + НСОз-
Концентрация ионов Н+ в растворах слабых одноосновных кислот и концентрация ионов ОН- в растворах слабых одноосновных оснований численно равны концентрации продиссоциировавших молекул электролита, а не исходной концентрации раствора, как в случае сильных кислот и оснований.
Концентрацию продиссоциировавших на ионы молекул электролита определяют, исходя из степени диссоциации: с = aсо, где со— исходная концентрация молекул, моль/л.
Степень диссоциации рассчитывают на основании закона Оствальда:
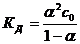
ПРИМЕЧАНИЕ. Чаще пользуются формулой КД = α2со, считая, что α<< 1. В случаях, когда расчет по упрощенному уравнению дает результат α > 0,1, вычисления повторяют, не пренебрегая величиной α в знаменателе дроби.
Определив степень диссоциации α и концентрацию молекул, распавшихся на ионы с, вычисляют рН или рОН раствора электролита, считая, что = 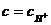 (кислота) или
(кислота) или 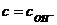 (основание).
(основание).
При вычислении водородного или гидроксильного показателя среды раствора слабой кислоты или слабого основания можно считать, что 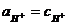 ;
; 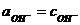 ввиду малых ионных сил (І) растворов (разбавленные растворы).
ввиду малых ионных сил (І) растворов (разбавленные растворы).
