Расчет рН в растворах солей, подвергающихся гидролизу (соль образована от слабой кислоты и слабого основания).
К ним относятся такие соли, как NH4CN, (NH4)2S, Al2S3, (CH3COO)3Fe и др.
Пример:
NH4F + H2O ⇔ NH4OH + HF,
NH4+ + F- + H2O ⇔ NH4OH + HF.
Как видно, в результате гидролиза образуются как ионы водорода, так и ионы гидроксида. Константа гидролиза зави-сит от константы диссоциации как слабого основания (Kb), так и слабой кислоты (Ka):
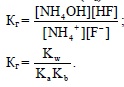 .
.
Степень гидролиза и концентрация ионов водорода в этом случае не зависят от исходной концентрации соли
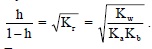 .
.
Так как гидролиз таких солей проходит со степенью гидролиза близкой к 1, то пренебрегать h в выражении (1-h) нельзя.
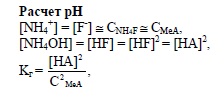
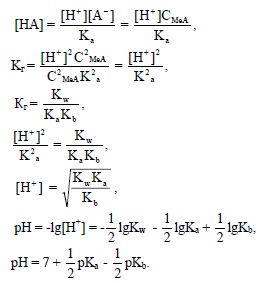
Как видно, в зависимости от соотношения Ka и Kb среда может иметь как кислую (Ka > Kb), основную (Ka < Kb), так и нейтральную (Ka ≅ Kb) реакцию.Так, например, при гидролизе карбоната аммония (NH4)2CO3 реакция среды будет слабо щелочная (KNH4OH = 1,79×10-5, K1,H2CO3 = 4,45×10-7), при гидролизе ацетата аммония NH4CH3COO (KNH4OH=1,79×10-5, KCH3COOH=1,75×10-5) – нейтральная.Некоторые соли, например сульфид алюминия Al2S3 и сульфид хрома Cr2S3, гидролизуются полностью, потому что в результате гидролиза получаются труднорастворимое основа-ние и слабодиссоциирующая кислота.
Al2S3 + 6H2O ⇒ Al(OH)3↓ + 3H2S↑,
2Al3+ + 3S2- + 6H2O ⇒ 2Al(OH)3↓ + 3H2S↑.

42. Коллоидное состояние вещества. Методы получения коллоидов.
В результате диспергирования (дробления) вещества получаются пленочно-, волокнисто- и корпускулярнодисперсные (раздробленные) системы. Если толщина пленок, поперечник волокон или частиц (корпускул) меньше разрешающей способности оптического микроскопа, то они не могут быть обнаружены с его помощью. Такие невидимые в оптический микроскоп частицы называют коллоидными, а раздробленное (диспергированное) состояние веществ с размером частиц от 400—300 нм до 1 нм — коллоидным состоянием вещества – такое состояние вещества, при котором его свойства определяются свойствами поверхностного слоя.
Существует две группы методов получения коллоидных систем:
- конденсационные;
- диспергационные.
Конденсационные методы основаны на образовании новой фазы в условиях пересыщенного состояния веществ; при этом система из гомогенной превращается в гетерогенную. Конденсационный процесс включает в себя две стадии:
1. образование центров конденсации (зародышей);
2. рост зародышей.
Зародыши образуются на уже имеющихся поверхностях раздела (пылинки или другие чужеродные частицы). В тщательно очищенных системах образование новой фазы не происходит даже при очень высоких степенях пересыщения. Рост зародышей происходит в результате отложения их на поверхности вещества из пересыщенной системы.
Виды конденсационных методов:
· физические процессы, протекающие при охлаждении системы: кристаллизация (образование твердой фазы в жидком растворе); конденсация (превращение паров в жидкость); десублимация (переход из газовой фазы в твердую).
· химические процессы (реакции обмена, окисления, гидролиза и др.)
NH3(г) + HCl(г) = NH4Cl(т) образуется дым
SO3(г) + H2O(г) = H2SO4(ж) образуется туман
Диспергационные методы основаны на измельчении (диспергировании) грубых частиц и распределении их в объеме дисперсионной среды.
В зависимости от агрегатного состояния дисперсной фазы диспергирование достигается:
1) в случае твердой фазы – механическим измельчением с последующим перемешиванием в жидкой среде или распылением в газовой;
2) в случае жидкой фазы – интенсивным перемешиванием или разбрызгиванием с помощью специальных устройств;
3) в случае газовой фазы - барботажем через слой жидкости.
