Полипептидная теория химического строения белков и пептидов. Строение и физиологическая роль пептидов.
Полипептидную теорию строения белка разработал и экспериментально обосновал Э. Фишер. Аминокислотный анализ белков позволил ему установить, что белки состоят только из аминокислот (эфирный метод). После этого он пришел к решению ключевого вопроса о характере связей отдельных аминокислот в молекуле белка. Вместо применявшегося ранее исключительно аналитического метода исследования он использовал метод синтеза. Прежде всего он разработал химический метод активации аминокислот по карбоксильной группе, получив хлорангидриды аминокислот. Последние легко вступали в реакцию с другими аминокислотами:
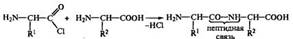
Между двумя аминокислотами возникла пептидная связь, а само соединение получило название дипептид. Полученный хлор-ангидрид дипептида вновь мог вступать в реакцию с новой аминокислотой и давать трипептид:
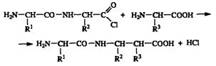
Таким методом синтеза Э. Фишеру удалось получить полипептид, состоящий из 19 аминокислот.
Ныне разработаны более изящные методы синтеза полипептидов. Однако в принципе они аналогичны методу Э. Фишера. Заслуживает восхищения интуиция этого ученого. Именно такой путь активации аминокислот имеет место в живой клетке.
Итак, белки представляют собой полимеры, построенные из α-аминокислот, общую формулу которых можно записать как NH3+CHRCOO- (в водном растворе при значениях pH, близких к нейтральным).
Остатки аминокислот в белках соединены между собой амидными связями между α-амино- и α-карбоксильной группами. Общая структура одной полимерной цепи белковой молекулы может быть представлена в виде
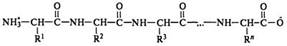
Граница между полипептидами и белками проведена условно. К белкам относят полипептиды с молекулярной массой 6 тысяч и более и числом аминокислотных остатков свыше 50. Такой принцип деления основан на способности к диализу через природные мембраны.
Согласно пептидной теории основой структуры белковой молекулы признана полипептидная цепь. Эта цепь построена из нескольких десятков, а иногда и сотен остатков аминокислот, связанных между собой пептидными связями.
Белковая молекула может состять из одной или нескольких полипептидных цепей. Цепи могут быть соединены между собой ковалентными или нековалентными связями. Белки, состоящие из двух или нескольких полипептидных цепей, не связанных между собой ковалентными связями, называют о л и г о м е р н ы м и. Отдельные полипептидные цепи в таких белках называют п р о т о м е р а м и; функционально активные части белка - с у б ъ е д и н и ц а м и.
Пептиды имеют невысокую молекулярную массу, широкий набор аминокислотных остатков (в их состав входят, например, D-аминокис-лоты) и структурные особенности (циклические, разветвленные). Названия пептидов образуются из названий аминокислотных остатков путем последовательного их перечисления, начиная с КН2-концевого остатка, с добавлением суффикса -ил, кроме С-концевой аминокислоты, название которой остается без изменений. Например:
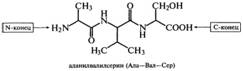
В природе существует два вида пептидов, один из которых синтезируется и выполняет физиологическую роль в процессе жизнедеятельности организма, другой образуется за счет химического или ферментативного гидролиза белков в организме или вне его. Пептиды, образующиеся в процессе гидролиза вне организма (in vitro), широко используются для анализа аминокислотной последовательности белков. С помощью пептидов расшифрована аминокислотная последовательность фермента лизоцима, гормона поджелудочной железы инсулина (Сэнджер), нейротоксина яда кобры (Ю. Овчинников и др.), аспартатаминотрансферазы (А. Браунштейн и др.), пепсиногена и пепсина (В. Степанов и др.), лактогенного гормона быка (Н. Юдаев) и других биологически активных соединений организма.
Ферментативное образование пептидов происходит в желудочно-кишечном тракте человека в процессе переваривания белков пищи. Оно начинается в желудке под действием пепсина, гастриксина и заканчивается в кишечнике при участии трипсина, химотрипсина, амино- и кар-боксипептидаз. Распад коротких пептидов завершается ди- и трипепти-дазами с образованием свободных аминокислот, которые расходуются на синтез белков и других активных соединений. Гидролиз белка в желудочно-кишечном тракте обеспечивает структуру радикалов концевых аминокислот, зависящую от места приложения фермента (свойство специфичности). Так, при разрыве белка пепсином пептиды в качестве N-кон-цевых аминокислот содержат фенилаланин и тирозин, а в качестве С-концевых - глутаминовую кислоту, метионин, цистин и глицин. Пептиды, образующиеся из белка при участии трипсина, в качестве С-конце-вых аминокислот содержат аргинин и лизин, а при действии химотрипсина - ароматические аминокислоты и метионин.
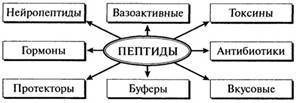
Для многих природных пептидов установлена структура, разработаны методы синтеза и установлена их роль. На рис. 2.8 отображены физиологическое значение и функциональная роль наиболее распространенных групп пептидов, от которых зависят здоровье человека и органолептические и санитарно-гигиенические свойства пищевых продуктов.