Видыокислительно-восстановительныхреакций
Межмолекулярные —реакции, вкоторыхокисляющиесяивосстанавливающиесяатомынаходятсявмолекулахразныхвеществ, например:
Н2S + Cl2 → S + 2HCl
Внутримолекулярные —реакции, вкоторыхокисляющиесяивосстанавливающиесяатомынаходятсявмолекулаходногоитогожевещества, например:
2H2O → 2H2 + O2
Диспропорционирование (самоокисление-самовосстановление) —реакции, вкоторыходинитотжеэлементвыступаетикакокислитель, икаквосстановитель, например:
Cl2 + H2O → HClO + HCl
Репропорционирование (конпропорционирование) — реакции, вкоторыхиздвухразличныхстепенейокисленияодногоитогожеэлементаполучаетсяоднастепеньокисления, например:
NH4NO3 → N2O + 2H2O
22.Сте́пеньокисле́ния (окислительноечисло, формальныйзаряд) —вспомогательнаяусловнаявеличинадлязаписи процессовокисления, восстановления иокислительно-восстановительныхреакций, численнаявеличина электрическогозаряда, приписываемого атому в молекуле впредположении, что электронные пары, осуществляющиесвязь, полностью смещены всторонуболее электроотрицательныхатомов.
Представленияостепениокисленияположенывоснову классификации и номенклатуры неорганическихсоединений.
Окисли́тель — вещество, всоставкотороговходят атомы, присоединяющиевовремяхимическойреакции электроны, инымисловами, окислитель —это акцепторэлектронов.
ВОССТАНОВИТЕЛЬ, вещество, котороевызываетреакцииВОССТАНОВЛЕНИЯ. Восстановлениикислородадляобразованияводы (2Н2+О2>2Н2О) водородявляетсявосстановителем.
Окисление
Окисление - процессотдачиэлектронов, сувеличениемстепениокисления.
При окисле́нии веществаврезультатеотдачи электронов увеличиваетсяего степеньокисления. Атомы окисляемоговеществаназываются донорами электронов, аатомы окислителя — акцепторами электронов.
Внекоторыхслучаяхприокислениимолекулаисходноговеществаможетстатьнестабильнойираспастьсянаболеестабильныеиболеемелкиесоставныечасти (см.Свободныерадикалы). Приэтомнекоторыеизатомовполучившихсямолекулимеютболеевысокуюстепеньокисления, чемтежеатомывисходноймолекуле.
Окислитель, принимаяэлектроны, приобретаетвосстановительныесвойства, превращаясьвсопряжённыйвосстановитель:
окислитель + e− ↔ сопряжённыйвосстановитель.
Восстановление
Привосстановлении атомы или ионы присоединяют электроны. Приэтомпроисходитпонижение степениокисления элемента. Примеры: восстановление оксидовметаллов досвободныхметалловприпомощи водорода, углерода, другихвеществ; восстановление органическихкислот в альдегиды и спирты; гидрогенизация жиров идр.
Восстановитель, отдаваяэлектроны, приобретаетокислительныесвойства, превращаясьвсопряжённыйокислитель:
восстановитель — e− ↔ сопряжённыйокислитель.
Несвязанный, свободныйэлектронявляетсясильнейшимвосстановителем.
23.Методэлектронногобаланса — одинизметодовуравнивания окислительно-восстановительныхреакций (ОВР).ЗаключаетсявтомчтобынаоснованиистепенейокислениярасставитькоэффициентывОВР.Дляправильногоуравниванияследуетпридерживатьсяопределённойпоследовательностидействий:
1. Найтиокислительивосстановитель.
2. Составитьдлянихсхемы (полуреакции) переходовэлектронов, отвечающиеданномуокислительно-восстановительномупроцессу.
3. Уравнятьчислоотданныхипринятыхэлектроноввполуреакциях.
4. Просуммироватьпорозньлевыеиправыечастиполуреакций.
5. Расставитькоэффициентывуравненииокислительновосстановительнойреакции.
МЕТОДЭЛЕКТРОННО-ИОННОГОБАЛАНСА (МЕТОДПОЛУРЕАЦИЙ)
Сегоднямынаучимсярасставлятькоэффициентывокислительно-восстановительныхреакциях (сокращенноОВР) методомэлектронно-ионногобаланса.
Заданиеобычнозвучиттак:
Подберитекоэффициентыкуравнениямокислительно-восстановительнойреакции, используяметодэлектронно-ионногобаланса, укажитеокислительивосстановитель, процессыокисленияивосстановления.
Физическиесвойстваметаллов
Всеметаллы (кромертутии, условно, франция) при нормальныхусловиях находятсяв твёрдомсостоянии, однакообладаютразличной твёрдостью. Нижеприводитсятвёрдостьнекоторыхметалловпо шкалеМооса.
Температурыплавления чистыхметалловлежатвдиапазонеот−39 °C (ртуть) до 3410 °C (вольфрам). Температураплавлениябольшинстваметаллов (заисключениемщелочных) высока, однаконекоторые«нормальные»металлы, например олово и свинец, можнорасплавитьнаобычной электрической или газовойплите.
Взависимостиот плотности, металлыделятналёгкие (плотность 0,53 ÷ 5 г/см³) итяжёлые (5 ÷ 22,5 г/см³). Самымлёгкимметалломявляется литий (плотность 0.53 г/см³). Самыйтяжёлыйметаллвнастоящеевремяназватьневозможно, таккакплотности осмия и иридия — двухсамыхтяжёлыхметаллов —почтиравны (около 22.6 г/см³ —ровновдваразавышеплотностисвинца), авычислитьихточнуюплотностькрайнесложно: дляэтогонужнополностьюочиститьметаллы, ведьлюбыепримесиснижаютихплотность.
Большинствометалловпластичны, тоестьметаллическуюпроволокуможносогнуть, ионанесломается. Этопроисходитиз-засмещенияслоёв атомов металловбезразрыва связи междуними. Самымипластичнымиявляютсязолото, сереброи медь. Иззолотаможноизготовитьфольгутолщиной 0.003 мм, которуюиспользуютдлязолоченияизделий. Однаконевсеметаллыпластичны. Проволокаиз цинка или олова хруститприсгибании; марганец и висмут при деформации вообщепочтинесгибаются, асразу ломаются. Пластичностьзависитиотчистотыметалла; так, оченьчистый хром весьмапластичен, но, загрязнённыйдаженезначительнымипримесями, становитсяхрупкимиболеетвёрдым. Некоторыеметаллытакиекакзолото, серебро, свинец, алюминий, осмиймогутсрастатьсямеждусобой, нонаэтоможетуйтидесяткилет.
Всеметаллыхорошопроводят электрическийток; этообусловленоналичиемвихкристаллическихрешёткахподвижных электронов, перемещающихсяподдействиемэлектрическогополя. Серебро, медьи алюминий имеютнаибольшую электропроводность; поэтойпричинепоследниедваметаллачащевсегоиспользуютвкачествематериаладля проводов. Оченьвысокуюэлектропроводностьимееттакженатрий, вэкспериментальнойаппаратуреизвестныпопыткиприменениянатриевыхтокопроводоввформетонкостенныхтрубизнержавеющейстали, заполненныхнатрием. Благодарямаломуудельномувесунатрия, приравномсопротивлениинатриевые«провода»получаютсязначительнолегчемедныхидаженескольколегчеалюминиевых.
Высокая теплопроводность металловтакжезависитотподвижностисвободныхэлектронов. Поэтомурядтеплопроводностейпохожнарядэлектропроводностейилучшимпроводникомтепла, какиэлектричества, являетсясеребро. Натрийтакженаходитприменениекакхорошийпроводниктепла; широкоизвестно, например, применениенатриявклапанахавтомобильныхдвигателейдляулучшенияихохлаждения.
Гладкаяповерхностьметалловотражаетбольшойпроцент света — этоявлениеназываетсяметаллическимблеском. Однаковпорошкообразномсостояниибольшинствометалловтеряютсвойблеск; алюминийи магний, темнеменее, сохраняютсвойблескивпорошке. Наиболеехорошоотражаютсветалюминий, сереброи палладий — изэтихметалловизготовляют зеркала. Дляизготовлениязеркалиногдаприменяетсяи родий, несмотрянаегоисключительновысокуюцену: благодарязначительнобольшей, чемусеребраилидажепалладия, твёрдостиихимическойстойкости, родиевыйслойможетбытьзначительнотоньше, чемсеребряный.
Цветубольшинстваметалловпримерноодинаковый —светло-серыйсголубоватымоттенком. Золото, медьи цезий соответственножёлтого, красногоисветло-жёлтогоцвета.
26.Ряд напряжений (реже—рядактивностей), последовательностьрасположенияметалловиихионоввпорядкевозрастаниястандартных электродныхпотенциалов врастворахэлектролитов. Электродомсравненияобычнослужитстандартный водородныйэлектрод. ПоэтомувР. н. включаютиводород, электродныйпотенциалкоторогопринимаетсяравнымнулю. ВСССРимногихдругихевропейскихстранахэлектродномупотенциалупринятодаватьзнак, одинаковыйсознакомзарядаэлектродаизданногометаллапоотношениюкстандартномуводородномуэлектроду (вСШАпринятодаватьобратныйзнак). Наибольшиеотрицательныепотенциалыхарактерныдлящелочныхметаллов (около— 3 в), занимиследуютщёлочноземельныеметаллыит. д.; наиболееположительныепотенциалыимеютблагородныеметаллы (около + 1,5 в; численныезначениясм. вст. Металлы, табл. 2 и 3). ВР. н. частовключаютнеметаллы, ионыинекоторыехимическиесоединения. НаиболеераспространённыеметаллырасположенывР. н. вследующейпоследовательности: Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au (см. тамже).
29.Возникновениедвойногоэлектрическогослоянагранице
металл - электролит.
Приконтактеповерхностиметаллическогоэлектродасэлектролитомв
силуВторогозаконатермодинамикинеизбежноначинаетсяпереходионов
металлаисвободныхэлектроноввраствор. Посколькуэнергии
взаимодействияэлектроновиионовметалласмолекуламииионами
растворителяразличны, тоиколичествоперешедшихврастворзарядов
различныхзнаковнеодинаково. Врезультатеповерхностьразделафаз
приобретаетэлектрическийзаряд, которыйпритягиваетизраствора
гидратированныеионыпротивоположногознакаисоответствующим
образомориентируетдиполимолекулрастворителя.
Состоронырастворавозникаетслойзаряженныхгидратированных
частиц, которыйвзаимодействуетсзаряженнойповерхностьюметалла
электрода. Кромеявленийгидратациииэлектростатическоговзаимодействия
ионов, наповерхностиэлектродапроисходитадсорбциякакмолекул
растворителя, такиприсутствующихвраствореионов. Этосоздаетвесьма
сложнуюконфигурациюзаряженныхчастиц, которуюназываютдвойным
электрическимслоем.
Электро́дныйпотенциа́л — разность электрическихпотенциалов между электродом инаходящимсяснимвконтакте электролитом (чащевсегомежду металлом ираствором электролита).
Возникновениеэлектродногопотенциалаобусловленопереносомзаряженныхчастицчерезграницуразделафаз, специфической адсорбцией ионов, априналичииполярных молекул (втомчислемолекулрастворителя) —ориентационнойадсорбциейих. Величинаэлектродногопотенциалавнеравновесномсостояниизависиткакотприродыисоставаконтактирующихфаз, такиоткинетическихзакономерностейэлектродныхреакцийнаграницеразделафаз.
Равновесноезначениескачкапотенциаловнаграницеразделаэлектрод/растворопределяетсяисключительноособенностямиэлектроднойреакцииинезависитотприродыэлектродаиадсорбциинанёмповерхностно-активныхвеществ. Этуабсолютную разностьпотенциалов междуточками, находящимисявдвухразныхфазах, нельзяизмеритьэкспериментальноилирассчитатьтеоретически.
30.Нормальныйводородныйэлектрод представляетсобойплатиновуюпластину, погруженнуюводнонормальныйрастворсильнойкислоты, насыщенныймолекулярнымводородом ( Рн, 1 атм) при 25 С. [1]
Нормальныйводородныйэлектрод состоитизплатиновойпластинки, накоторуюэлектролитическинаносятслойплатиновойчерни. Платиноваячернь, представляющаясобойплатинувтонкодисперсномсостоянии, обладаетспособностьюабсорбироватьгазообразныйводород.
Стандартныйводоро́дныйэлектро́д — электрод, использующийсявкачестве электродасравнения приразличныхэлектрохимическихизмеренияхив гальваническихэлементах. Водородныйэлектрод (ВЭ) представляетсобойпластинкуилипроволокуизметалла, хорошопоглощающегогазообразный водород (обычноиспользуютплатину или палладий), насыщеннуюводородом (приатмосферномдавлении) ипогруженнуюв водныйраствор, содержащий ионыводорода. Потенциалпластинызависит[уточнить] отконцентрацииионовН+ врастворе. Электродявляетсяэталоном, относительнокотороговедетсяотсчетэлектродногопотенциалаопределяемойхимическойреакции. Придавленииводорода 1 атм., концентрациипротоновврастворе 1 моль/литемпературе 298 К потенциалВЭпринимаютравным 0 В. ПрисборкегальваническогоэлементаизВЭиопределяемогоэлектрода, наповерхностиплатиныобратимопротекаетреакция:
2Н+ + 2e− = H2
тоесть, происходитлибо восстановление водорода, либоего окисление — этозависитотпотенциалареакции, протекающейнаопределяемомэлектроде. ИзмеряяЭДСгальваническогоэлектродапристандартныхусловиях (см. выше) определяют стандартныйэлектродныйпотенциал определяемойхимическойреакции.
ВЭприменяютдляизмерениястандартногоэлектродногопотенциалаэлектрохимическойреакции, дляизмерения концентрации (активности) водородныхионов, атакжелюбыхдругих ионов. ПрименяютВЭтакжедляопределенияпроизведениярастворимости, дляопределенияконстантскоростинекоторыхэлектрохимическихреакций.
В электрохимии стандартныйэлектродныйпотенциал, обозначаемый Eo, E0, или EO, являетсямеройиндивидуальногопотенциалаобратимогоэлектрода (вравновесии) в стандартномсостоянии, котороеосуществляетсяврастворахприэффективнойконцентрациив 1 моль/кгивгазахпридавлениив 1 атмосферуили 100 кПа (килопаскалей). Объёмычащевсеговзятыпри 25 °C. Основойдля электрохимическойячейки, такойкак гальваническаяячейка всегдаявляется окислительно-восстановительнаяреакция, котораяможетбытьразбитанадве полуреакции: окисление нааноде (потеряэлектрона) и восстановление накатоде (приобретениеэлектрона). Электричество вырабатываетсявследствиеразличия электростатическогопотенциала двухэлектродов. Этаразностьпотенциаловсоздаётсяврезультатеразличийиндивидуальныхпотенциаловдвухметаллов электродов поотношениюкэлектролиту.
Электрохимическийрядактивности (ряднапряжений, рядстандартныхэлектродныхпотенциалов) металлов — последовательность, вкоторойметаллырасположенывпорядкеувеличенияих стандартныхэлектрохимическихпотенциалов φ0, отвечающихполуреакциивосстановлениякатионаметалла Men+: Men+ + nē → Me
31.Гальвани́ческийэлеме́нт — химическийисточникэлектрическоготока, основанныйнавзаимодействиидвухметаллови (или) ихоксидовв электролите, приводящемквозникновениювзамкнутойцепиэлектрическоготока. Названвчесть ЛуиджиГальвани.
ЭДСгальваническогоэлементаравнаразностиэлектродныхпотенциаловсоставляющихегоэлектродов. ВсоответствииспринятойформойзаписигальваническогоэлементаегоЭДСравнаэлектродномупотенциалуправогоэлектрода (окислителя) минусэлектродныйпотенциаллевогоэлектрода (восстановителя).
32.Концентрационныйэлемент — это гальваническийэлемент, состоящийиздвуходинаковыхметаллических электродов, опущенныхврастворы соли этого металла сразличными концентрациями С1 >С2. Катодомвэтомгальваническомэлементеявляетсяэлектродпогруженныйврастворсбольшейконцентрацией, аанодомсоответственнопогруженнымврастворсменьшейконцентрацией[1].
Вкачествепримераконцентрационногоэлементаможнопривестиконцентрационныйсвинцовый гальваническийэлемент. Электродыэтогоэлементасделаныизсвинца, приэтомодинизэлектродовкоторогопогруженврастворсоли свинца сконцентрацией Pb2+ равной 0,1 моль/л, адругой —врастворсконцентрацией Pb2+ равной 0,01 моль/л.
Схемаданногоэлемента: 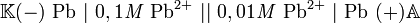
Вданномэлементепроисходят электродныепроцессы:
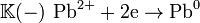 - реакциявосстановления
- реакциявосстановления
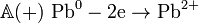 - реакцияокисления
- реакцияокисления
33.электролизрасплавовэлектролитов.Электролизсолевыхрасплавовширокоприменяетсядлящелочных, щелочноземельныхи редкихметаллов, а такжедлямагнияи алюминия. Процессывыделенияметалловиз расплавов, какправило, протекаютбезкинетическихзатруднений. Расплавленныеэлектролитыимеютвысокуюпроводимость, чтопозволяетвестипроцессэлектролизапривысокихкатодныхплотностяхтока. Основныепреимуществапроцессаэлектролизас участиемионныхрасплавовпередпиро- и гидрометаллургическимиметодамизаключаетсяв следующем: электролизионныхрасплавовпозволяетв однуилидвеоперацииполучитьметаллнеобходимойчистоты. Плотностьтокаможетбытьвыше, чемприэлектролизеводныхрастворов (5000А/ми выше). Металлнаходитсяв жидкомсостоянии, егоможносразу жеразливатьв чушки.
Длякатодногоосаждениясвинцаиз ионныхрасплавовиспользуютсяхлоридныесистемы. Способзаключаетсяв том, чтоподлежащийпереработкесвинецаноднорастворяетсяв расплавленномэлектролите, состоящемиз смесихлоридасвинцаи хлоридовщелочныхи щелочно-земельныхметаллов.
Электролитомслужитсистема -NaCl-KCl. Электролитв ходепроцессапочтине расходуется. Температураэлектролитаприэлектролизене должнапревышать 600 С во избежаниеиспаренияхлоридасвинца.
В качестверастворителяприпереработкеотработанных аккумуляторов методомэлектролизарасплавовможетбытьиспользовантакжерасплавленныйгидроксиднатрия.
Электролизрасплавовсоединенийсвинцасвязани с целымрядомпроблем. Однойиз важнейшихявляетсяпроблемакоррозионнойстойкостиконструкционныхматериалов. К коррозионно-стойкимматериаламследуетотнестиникельи сталь.
Коррозияметаллов


Ржавчина, самыйраспространенныйвидкоррозии.


Коррозияметалла.
Коррозияметаллов —разрушениеметалловвследствиехимическогоилиэлектрохимическоговзаимодействияихскоррозионнойсредой.[2] Дляпроцессакоррозииследуетприменятьтермин «коррозионныйпроцесс», адлярезультатапроцесса —«коррозионноеразрушение». Образованиегальваническихпарспользойприменяютдлясозданиябатарейиаккумуляторов. Сдругойстороны, образованиетакойпарыприводиткнеблагоприятномупроцессу, жертвойкоторогостановитсяцелыйрядметаллов, —коррозии. Подкоррозиейпонимаютпроисходящеенаповерхностиэлектрохимическоеилихимическоеразрушениеметаллическогоматериала. Наиболеечастоприкоррозииметаллокисляетсясобразованиемионовметалла, которыепридальнейшихпревращенияхдаютразличныепродуктыкоррозии. Коррозияможетбытьвызванакакхимическим, такиэлектрохимическимпроцессом. Соответственно, различаютхимическуюиэлектрохимическуюкоррозиюметаллов.
Видыкоррозии
· Газоваякоррозия
· Атмосфернаякоррозия
· Коррозияпринеполномпогружении
· Коррозияповатерлинии
· Коррозияприполномпогружении
· Коррозияприпеременномпогружении
· Подземнаякоррозия
· Биокоррозия
· Коррозиявнешнимтоком
· Коррозияблуждающимтоком
· Контактнаякоррозия
· Коррозияпритрении
· Фреттинг-коррозия
· Сплошнаякоррозия
· Равномернаякоррозия
· Неравномернаякоррозия
· Местнаякоррозия
· Подповерхностнаякоррозия
· Точечнаякоррозия
· Коррозияпятнами
· Сквознаякоррозия
· Послойнаякоррозия
· Нитевиднаякоррозия
· Структурнаякоррозия
· Межкристаллитнаякоррозия
· Избирательная (селективная) коррозия
· Графитизациячугуна
· Обесцинкование
· Щелеваякоррозия
· Ножеваякоррозия
· Коррозионнаяязва
· Коррозионноерастрескивание
· Коррозияподнапряжением
· Коррозионнаяусталость
· Пределкоррозионнойусталости
· Коррозионнаяхрупкость
37.Контактнаякоррозия – видкоррозионногоразрушения, которыйнаблюдаетсяприконтактедвухразнородныхметаллов, т.е. которыеобладаютразнымиэлектрохимическимисвойствами.
Принеправильнойкомпоновкеметалловисплавовданныйвидкоррозионногоразрушениявыводитизстроямножествосложныхметаллическихконструкций. Контактная коррозиянаблюдается, например, всистемахалюминий (исплавыалюминия)-углеродистаястальилиалюминий-цинк, медь-железо, ит.д. Контактнаякоррозиятакжеможетнаблюдатьсяприконтакте изделийизодногоитогожеметалла, носоединенныхприпомощипайкилибосварки. Сварной (спаечный) шовбудетотличаться электрохимическимисвойствамиотосновногометалла. Различнаямеханическаяобработкастали (металла) такжеможетвызватьконтактнуюкоррозиюдажеуодногоитогожеметала.
Приконтактедвухразнородныхметалловнаихповерхностиреализуетсякомпромиссныйпотенциал, которыйпосвоемузначениюотличаетсяотпотенциаловкаждогометаллапоотдельности. Компромиссныйпотенциалопределяетсяпересечениемсуммарныхполяризационныхкривых: аноднойикатодной.
Приконтактнойкоррозиианодомбудеттотметалл, которыйобладаетболееэлектроотрицательнымпотенциалом, катодприэтомимеетболееэлектроположительный. Скоростьрастворениякатодаможетбытьвыше, нижелиборавнаегособственнойскоростирастворениявтомжеэлектролите.
Скоростьрастворенияанодавомногозависитотразностипотенциаловмеждукатодомианодом. Процессывторичногоосажденияпродуктоврастворенияанода, ионизациикислородаиграютприэтомнепоследнююрольимогутсущественноповлиятьнаходискоростьпроцесса.
Величинакомпромиссногопотенциалазависитнетолькоотприродыконтактирующихметаллов, ноиотхарактеристикокружающейихсреды: температура, аэрация, составокружающейсреды, влажностьит.д.
Припротеканиикоррозионныхпроцессоввпочведостаточночастовозникаютпарыдифференциальнойаэрации. Этосвязаноснеравномернымподводомкислорода (окислительногоэлементасреды) кповерхностиметаллоконструкции. Катоднаяреакцияпроходитсзатруднениями. Приэтомнаучасткахконструкциисразличнойаэрациейнаблюдаетсяразличныйпотенциалсвободнойкоррозии. Этозачастуюобусловленопролеганиемподземнойметаллоконструкциивгрунтахсразличнымихарактеристиками.
38.коррозияподдействиемблуждающихтоков.Блуждающиетокиилитоки, рассеянныевпроводящейсреде, возникаютврезультатеразличныхприродныхявленийилисоздаютсяпромышленнымиэлектрическимустановками, использующимипроводящеюсреду (землю, морскуюводу) вкачестветокопровода.
ИсточникамиестественныхблуждающихтоковявляютсявариациимагнитногополяЗемли, грозовыеразряды, перемещенияземныхпородидругиеприродныеявления. Максимальнаянапряженностьестественныхэлектрическихполейнепревышает 150мВ/км, поэтомуочевидно, чтоонинепредставляютпрактическойкоррозионнойопасности.
Промышленныеблуждающиетокисоздаютсялиниямиэлектротранспорта, заземлителямипостоянноготока, системамикатоднойзащитыидругимиэлектрическимиустановками. Онимогутбытьоченьзначительнымиповеличинеинаноситьсерьезныйущербметаллическимсооружениям, находящимсявзонеихдействия. Типичныеслучаиэлектрокоррозииметаллическихсооруженийподдействиемблуждающихтоковпоказанынарис. 1, 2.
Интенсивностькоррозииобъектоввполеблуждающихтоковопределяетсянапряженностьюполя, удельнымсопротивлениемсреды, состояниемизоляционногопокрытияобъекта, взаимнымрасположениемобъектаиисточникатока.
Борьбаскоррозией
Современнаязащитаметалловоткоррозиибазируетсянаследующихметодах:
1. повышениехимическогосопротивленияконструкционныхматериалов,
2. изоляцияповерхностиметаллаотагрессивнойсреды,
3. понижениеагрессивностипроизводственнойсреды,
4. снижениекоррозииналожениемвнешнеготока (электрохимическаязащита).
Широкоприменяютсяследующиеосновныерешениязащитыметаллическихконструкцийоткоррозии:
1. Защитныепокрытия;
2. Обработкакоррозионнойсредысцельюснижениякоррозионнойактивности. Примерамитакойобработкимогутслужить: нейтрализацияилиобескислороживаниекоррозионныхсред, атакжеприменениеразличногородаингибиторовкоррозии;
3. Электрохимическаязащитаметаллов;
4. Разработаипроизводствоновыхметаллическихконструкционныхматериаловповышеннойкоррозионнойустойчивостипутемустраненияизметаллаилисплавапримесей, ускоряющихкоррозионныйпроцесс (устранениежелезаизмагниевыхилиалюминиевыхсплавов, серыизжелезныхсплавовит.д.), иливведениявсплавновыхкомпонентов, сильноповышающихкоррозионнуюустойчивость (напримерхромавжелезо, марганцавмагниевыесплавы, никелявжелезныесплавы, медивникелевыесплавыит.д.);
5. Переходврядеконструкцийотметаллическихкхимическистойкимматериалам (пластическиевысокополимернымематериалы, стекло, керамикаидр.);
6. Рациональноеконструированиеиэксплуатацияметаллическихсооруженийидеталей (исключениенеблагоприятныхметаллическихконтактовилиихизоляция, устранениещелейизазороввконструкции, устранениезонзастоявлаги, ударногодействияструйирезкихизмененийскоростейпотокавконструкцииидр.).
41.Металлическиепокрытия
| Металлическиепокрытиямогутизготавливатьсяпутемпогруженияврасплавленныйметалл (методпогруженияврасплав), путемнапыленияжидкогометаллаилипутемгальваническойметаллизации (гальванизации). Вметодепогруженияврасплавдеталипогружаютсявжидкийметалл, как, например, вцинкпритемпературе 450 °С (огневаяоцинковка). Приэтомтонкийслойпокрывающегометаллакрепкоудерживаетсянаповерхностидетали. Этотметодтребуетметаллическичистыхповерхностей. Поэтомудеталидолжныбытьпредварительнообезжирены, атакжеочищеныотржавчиныиокалинывтравильныхваннах. Деталисогневойоцинковкойможноузнатьпорисункуввидеснежинокнаповерхности Встальныхконструкцияхметалл покрытияможетбытьнанесентакже напылением. Приэтомметалл, по ступающийввидепроволокиврас пылитель, расплавляетсягазовойго релкойилиэлектроэнергией, распы ляетсясжатымвоздухоминаноситсянадеталь |
42.Протекторнаязащитаметалла — способантикоррозионнойзащиты, прикоторомзащищаемойповерхностинеобходимообеспечитьконтактсболееактивнымметаллом (ссылка). Поотношениюкжелезу, болееактивнымиметалламиявляютсякадмий, хром, цинк, магнийидругиеметаллы
Катоднаязащита — это электрохимическаязащита, основаннаянаналоженииотрицательногопотенциаланазащищаемуюдеталь[1][2].
Сдвигпотенциалазащищаемогометаллическогообъектаосуществлёнспомощьювнешнегоисточникапостоянноготока (станциикатоднойзащиты) илисоединениемс протекторным анодом, изготовленнымизметалла, болееэлектроотрицательного относительнообъекта. Приэтомповерхностьзащищаемогообразца (деталиконструкции) становитсяэквипотенциальной инавсехеёучасткахпротекаеттолько катодный процесс. Обусловливающийкоррозиюанодныйпроцессперенесённавспомогательныеэлектроды. Отсюданазвания —«жертвенныйанод», «жертвенныйэлектрод». Если, однако, сдвигпотенциалавотрицательнуюсторонупревыситопределённоезначение, возможнатакназываемая«перезащита», связаннаясвыделениемводорода, изменениемсоставаприэлектродногослояидругимиявлениями, чтоможетпривестикускорениюкоррозии. Катоднуюзащиту, какправило, совмещаютснанесениемзащитныхпокрытий.
.
