Периодическоеизменениесвойствхимическихэлементов
Законэквивалентов
веществавзаимодействуютдругсдругомвколичествах, пропорциональныхихэквивалентам. Прирешениинекоторыхзадачудобнеепользоватьсядругойформулировкойэтогозакона: массы (объемы) реагирующихдругсдругомвеществпропорциональныихэквивалентныммассам (объемам).
Эквивалентвещества или Эквивалент — этореальнаяилиусловнаячастица, котораяможетприсоединять, высвобождатьилидругимспособомбытьэквивалентнакатиону водорода в ионообменныхреакциях или электрону в окислительно-восстановительныхреакциях[1][2].
Эквивалентнаямасса — этомассаодногоэквивалентаданноговещества.
m1Э2=m2Э1
12.ЗаконАвога́дро — одноизважныхосновныхположенийхимии, гласящее, что«вравныхобъёмахразличныхгазов, взятыхприодинаковыхтемпературеидавлении, содержитсяодноитожечисломолекул». Былосформулированоещёв 1811 году АмедеоАвогадро (1776—1856), профессоромфизикив Турине.
Первоеследствие иззаконаАвогадро: один моль любогогазаприодинаковыхусловияхзанимаетодинаковыйобъём.
Вчастности, принормальныхусловиях, т. е. при 0 °C (273К) и 101,3 кПа, объём 1 молягаза, равен 22,4 л. Этотобъёмназываютмолярнымобъёмомгаза Vm. Пересчитатьэтувеличинунадругиетемпературуидавлениеможноспомощью уравненияМенделеева-Клапейрона:
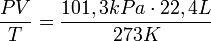 .
.
Второеследствие иззаконаАвогадро: молярнаямассапервогогазаравнапроизведениюмолярноймассывторогогазанаотносительнуюплотностьпервогогазаповторому.
Положениеэтоимелогромадноезначениедляразвитияхимии, таккаконодаетвозможностьопределятьчастичныйвес[2] тел, способныхпереходитьвгазообразноеилипарообразноесостояние. Есличерез m мыобозначимчастичныйвестела, ичерез d — удельныйвес[3] еговпарообразномсостоянии, тоотношение m / d должнобытьпостояннымдлявсехтел. Опытпоказал, чтодлявсехизученныхтел, переходящихвпарбезразложения, этапостояннаяравна 28,9, еслиприопределениичастичноговесаисходитьизудельноговеса воздуха, принимаемогозаединицу, ноэтапостояннаябудетравняться 2, еслипринятьзаединицу удельныйвес водорода. Обозначивэтупостоянную, или, чтотоже, общийвсемпарамигазамчастичныйобъёмчерез С, мыизформулыимеемсдругойстороны m = dC. Таккакудельныйвес параопределяетсялегко, то, подставляязначение d вформулу, выводитсяинеизвестныйчастичныйвесданноготела.
Элементарныйанализ, например, одногоиз полибутиленов указывает, внёмпайноеотношение углерода кводороду, как 1 к 2, апотомучастичныйвесегоможетбытьвыраженформулойСН2 или C2H4, C4H8 ивообще (СН2)n. Частичныйвесэтогоуглеводородатотчасопределяется, следуязаконуАвогадро, размызнаемудельныйвес, т. е. плотностьегопара; онопределенБутлеровымиоказался 5,85 (поотношениюквоздуху); т. е. частичныйвесегобудет 5,85 · 28,9 = 169,06. Формуле C11H22отвечаетчастичныйвес 154, формуле C12H24 — 168, а C13H26 — 182. Формула C12H24 близкоотвечаетнаблюденнойвеличине, апотомуонаидолжнавыражатьсобоювеличинучастицынашегоуглеводорода CH2.
13.Основныетермины:
§ Ядроатома – центральнаячастьатома, котораясостоитизнуклонов, котораяхарактеризируетсятремяпараметрами: массовымчислом, зарядомядра, и N числомнейтроноввядре.
§ Зарядядра – эточисло, котороепишетсявнижнейлевойчастиотсимволаэлемента, равноечислупротонов.
§ Массовоечисло – эточисло, котороепишетсявверхнейлевойчасти.
§ Изотопы – театомы, вядрахкоторыхнаходитсяодинаковоеколичествопротоновиразноеколичествонейтронов.
§ ТеорияБора – состоитвтом, чтоэлектронимеетсвойствавращатьсявокругядрапопериметруатомныхорбиталей.
Атомноеядро́ — центральнаячасть атома, вкоторойсосредоточенаосновнаяего масса (более 99,9 %). Ядрозаряженоположительно, зарядядраопределяет химическийэлемент, ккоторомуотносятатом. Размерыядерразличныхатомовсоставляютнесколько фемтометров, чтовболеечемв 10 тысячразменьшеразмеровсамогоатома.
Прото́н (от др.-греч. πρῶτος — первый, основной) — элементарнаячастица. Относитсяк барионам, имеет спин 1/2,электрическийзаряд +1 (вединицах элементарногоэлектрическогозаряда). Вфизикеэлементарныхчастицрассматриваетсякак нуклон спроекцией изоспина +1/2 (вядернойфизикепринятпротивоположныйзнакпроекцииизоспина). Состоитизтрёхкварков (один d-кварк идва u-кварка). Стабилен (нижнееограничениена времяжизни — 2,9·1029 летнезависимоотканалараспада, 1,6·1033 летдляраспадав позитрон инейтральный пион).
Нейтро́н (отлат. neuter —нитот, нидругой) — элементарнаячастица, неимеющая электрическогозаряда. Нейтронявляетсяфермионом ипринадлежиткклассу барионов. Атомныеядра состоятизнейтронови протонов.
Электро́н (от др.-греч. ἤλεκτρον — янтарь[3]) — стабильная, отрицательнозаряженная элементарнаячастица, однаизосновныхструктурныхединицвещества. Является фермионом (тоестьимеетполуцелый спин). Относитсяк лептонам(единственнаястабильнаячастицасредизаряженныхлептонов). Изэлектроновсостоят электронныеоболочки атомов, гдеихчислоиположениеопределяетпочтивсе химическиесвойства веществ. Движениесвободныхэлектроновобусловливаеттакиеявления, как электрическийток впроводникахи вакууме.
Изото́пы (от др.-греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидности атомов (и ядер) какого-либохимическогоэлемента, которыеимеютодинаковыйатомныйномер, ноприэтомразныемассовыечисла. Названиесвязаностем, чтовсеизотопыодногоатомапомещаютсяводноитожеместо (воднуклетку) таблицыМенделеева. Химическиесвойства атомазависятотстроенияэлектроннойоболочки, которая, всвоюочередь, определяетсявосновномзарядомядра Z (тоестьколичествомпротоноввнём), ипочтинезависятотего массовогочисла A (тоестьсуммарногочисла протонов Z инейтронов N). Всеизотопыодногоэлементаимеютодинаковыйзарядядра, отличаясьлишьчисломнейтронов. Обычноизотопобозначаетсясимволомхимическогоэлемента, ккоторомуонотносится, сдобавлениемверхнеголевогоиндекса, означающегомассовоечисло (например,12C, 222Rn). Можнотакженаписатьназваниеэлементасдобавлениемчерездефисмассовогочисла (например, углерод-12, радон-222). Некоторыеизотопыимеюттрадиционные собственныеназвания (например, дейтерий, актинон).
14. Открытиесложногостроенияатома – важнейшийэтапстановлениясовременнойфизики. Впроцессесозданияколичественнойтеориистроенияатома, позволившейобъяснитьатомныесистемы, былисформированыновыепредставленияосвойствахмикрочастиц, которыеописываютсяквантовоймеханикой. Представлениеобатомахкакнеделимыхмельчайшихчастицахвеществ, какужеотмечалосьвыше, возниклоещевантичныевремена (Демокрит, Эпикур, Лукреций). Всредниевекаучениеобатомах, будучиматериалистическим, неполучилопризнания. Кначалу XVIII в. атомистическаятеорияприобретаетвсебольшуюпопулярность. КэтомувремениработамифранцузскогохимикаА. Лавуазье (1743–1794), великогорусскогоученогоМ.В. ЛомоносоваианглийскогохимикаифизикаД. Дальтона (1766–1844) быладоказанареальностьсуществованияатомов. Однаковэтовремявопросовнутреннемстроенииатомовдаженевозникал, таккакатомысчиталисьнеделимыми. БольшуюрольвразвитииатомистическойтеориисыгралвыдающийсярусскийхимикД.И. Менделеев, разработавшийв 1869 г. периодическуюсистемуэлементов, вкоторойвпервыенанаучнойосновебылпоставленвопросоединойприродеатомов. Вовторойполовине XIX в. былоэкспериментальнодоказано, чтоэлектронявляетсяоднойизосновныхчастейлюбоговещества. Этивыводы, атакжемногочисленныеэкспериментальныеданныепривеликтому, чтовначале XX в. серьезновсталвопросостроенииатома. Существованиезакономернойсвязимеждувсемихимическимиэлементами, ярковыраженноевпериодическойсистемеМенделеева, наталкиваетнамысльотом, чтовосновестроениявсехатомовлежитобщеесвойство: всеонинаходятсявблизкомродстведругсдругом. Однакодоконца XIX в. вхимиигосподствовалометафизическоеубеждение, чтоатоместьнаименьшаячастицапростоговещества, последнийпределделимостиматерии. Привсеххимическихпревращенияхразрушаютсяивновьсоздаютсятолькомолекулы, атомыжеостаютсянеизменнымиинемогутдробитьсянаболеемелкиечасти. Различныепредположенияостроенииатомадолгоевремянеподтверждалиськакими-либоэкспериментальнымиданными. Лишьвконце XIX в. былисделаныоткрытия, показавшиесложностьстроенияатомаивозможностьпревращенияприопределенныхусловияходнихатомоввдругие. Наосновеэтихоткрытийначалобыстроразвиватьсяучениеостроенииатома. Первыекосвенныеподтвержденияосложнойструктуреатомовбылиполученыприизучениикатодныхлучей, возникающихприэлектрическомразрядевсильноразреженныхгазах. Изучениесвойствэтихлучейпривелокзаключению, чтоонипредставляютсобойпотокмельчайшихчастиц, несущихотрицательныйэлектрическийзарядилетящихсоскоростью, близкойкскоростисвета. Особымиприемамиудалосьопределитьмассукатодныхчастицивеличинуихзаряда, выяснить, чтоонинезависятниотприродыгаза, остающегосявтрубке, ниотвещества, изкоторогосделаныэлектроды, ниотпрочихусловийопыта. Крометого, катодныечастицыизвестнытольковзаряженномсостоянииинемогутбытьлишенысвоихзарядовипревращенывэлектронейтральныечастицы: электрическийзарядсоставляетсущностьихприроды. Этичастицы, получившиеназваниеэлектронов, былиоткрытыв 1897 г. английскимфизикомДж. Томсоном.
Изучениестроенияатомапрактическиначалосьв 1897–1898 гг., послетогокакбылаокончательноустановленаприродакатодныхлучейкакпотокаэлектроновибылиопределенывеличиназарядаимассаэлектрона. Томсонпредложилпервуюмодельатома, представиватомкаксгустокматерии, обладающийположительнымэлектрическимзарядом, вкоторыйвкрапленостолькоэлектронов, чтопревращаетеговэлектрическинейтральноеобразование. Вэтоймоделипредполагалось, чтоподвлияниемвнешнихвоздействийэлектронымоглисовершатьколебания, т. е. двигатьсяускоренно. Казалосьбы, этопозволялоответитьнавопросыобизлучениисветаатомамивеществаигамма-лучейатомамирадиоактивныхвеществ.
15.Катодныелучи — поток электронов, излучаемый катодом. Катодныелучииспользуютсяв телевизионныхтрубках, компьютерныхмониторах, осциллографах,электронныхмикроскопах и радиолампах. Вэтихприборахкатодныелучираспространяютсяввакууме. Катодныелучивызываютсвечениенекоторыхвеществ, нанесённыхнавнутреннююповерхностьтрубки. Катодныелучиобладаюткинетическойэнергиейиспособныпередаватьмеханическоедвижениевертушкеслопастями. Катодныелучиотклоняютсямагнитнымиэлектрическимполем. Катодныелучиотрицательнозаряжены, ипоэтомудвижутсяпонаправлениюкположительнозаряженномуэлектродутрубки, пролетаячерезотверстиевнём.
Термоэлектро́ннаяэми́ссия (эффектРичардсона, эффектЭдисона) — явлениеиспускания электронов нагретымителами. Концентрациясвободныхэлектроноввметаллахдостаточновысока, поэтомудажеприсреднихтемпературахвследствиераспределенияэлектроновпоскоростям (поэнергии) некоторыеэлектроныобладаютэнергией, достаточнойдляпреодоления потенциальногобарьера награнице металла. Сповышениемтемпературычислоэлектронов, кинетическаяэнергия тепловогодвижениякоторыхбольше работывыхода, растет, иявлениетермоэлектроннойэмиссиистановитсязаметным.
Фотоэффе́кт — этоиспускание электронов веществомподдействием света (и, вообщеговоря, любого электромагнитногоизлучения). Вконденсированных веществах (твёрдыхижидких) выделяютвнешнийивнутреннийфотоэффект.
Рентге́новскоеизлуче́ние — электромагнитныеволны, энергия фотонов которыхлежитна шкалеэлектромагнитныхволн междуультрафиолетовым излучениеми гамма-излучением, чтосоответствуетдлинамволнот 10−2 до 103 Å (от 10−12 до 10−7 м).[1]
Процессрадиоактивногораспадатакженазывают радиоакти́вностью, асоответствующиеэлементырадиоактивными. Радиоактивныминазываюттакжевещества, содержащиерадиоактивныеядра.
МодельТомсона, иначеназываемая "пудингсизюмом" - модель атома, предложеннаяв 1904 году ДжозефомДжономТомсоном. Открывв 1897 году электрон, Томсонпредположил, что«корпускулы»(такТомсонназывалэлектроны, хотяещёв 1894 годуДж. Дж. Стоунипредложилназывать«атомыэлектричества»электронами[1]) являютсясоставнымичастямиатомаирешилсоздатьмодельатома, отражающуюэтопредположение. Согласноэтоймодели, атомсостоитизэлектронов, помещённыхвположительнозаряженный«суп», компенсирующийотрицательныезарядыэлектронов, подобноотрицательнозаряженным«изюминкам»вположительнозаряженном«пудинге». Электроны, какпредполагалось, былираспределеныповсемуатому. Былонескольковариантоввозможногорасположенияэлектроноввнутриатома, вчастностивращающиесякольцаэлектронов (см. ниже). Внекоторыхвариантахмоделивместо«супа»предлагалось«облако»положительногозаряда.
СэтойновоймодельюТомсонотказалсяотсвоейболеераннейгипотезы«туманногоатома» (nebular atom), представлявшейатомсостоящимизнематериальныхвихрей. ТеперьпокрайнеймеречастьатомасостоялаизмикроскопическихотрицательнозаряженныхкорпускулТомсона, хотяостальнаяположительнозаряженнаячастьатомапо-прежнемуоставаласьдовольнотуманнойиплохо-определённой.
| 16.ОпытРезерфорда |  |
Изучаярассеяниеальфа-частицприпрохождениичереззолотуюфольгу, Резерфордпришелквыводу, чтовесьположительныйзарядатомовсосредоточенвихцентревоченьмассивномикомпактномядре. Аотрицательнозаряженныечастицы (электроны) обращаютсявокругэтогоядра. ЭтамоделькореннымобразомотличаласьотширокораспространеннойвтовремямоделиатомаТомсона, вкоторойположительныйзарядравномернозаполнялвесьобъематома, аэлектроныбыливкрапленывнего. НесколькопозжемодельРезерфордаполучиланазваниепланетарноймоделиатома (онадействительнопохожанаСолнечнуюсистему: тяжелоеядро - Солнце, аобращающиесявокругнегоэлектроны - планеты).
|
17.Бо́ровскаямоде́льа́тома (Моде́льБо́ра) — полуклассическаямодель атома, предложенная НильсомБором в 1913 г. Заосновуонвзялпланетарнуюмодельатома, выдвинутую Резерфордом. Однако, сточкизренияклассическойэлектродинамики, электронвмоделиРезерфорда, двигаясьвокругядра, долженбылбы излучатьнепрерывно, иоченьбыстро, потерявэнергию, упастьнаядро. ЧтобыпреодолетьэтупроблемуБорввелдопущение, сутькоторогозаключаетсявтом, чтоэлектроныватомемогутдвигатьсятолькопоопределенным (стационарным) орбитам, находясьнакоторыхонинеизлучают, аизлучениеилипоглощениепроисходиттольковмоментпереходасоднойорбитынадругую. Причемстационарнымиявляютсялишьтеорбиты, придвижениипокоторыммоментколичествадвиженияэлектронаравенцеломучислу постоянныхПланка[1]: 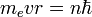 .
.
Используяэтодопущениеизаконыклассическоймеханики, аименноравенствосилыпритяженияэлектронасостороныядраицентробежнойсилы, действующейнавращающийсяэлектрон, онполучилследующиезначениядлярадиусастационарнойорбиты  иэнергии
иэнергии  находящегосянаэтойорбитеэлектрона:
находящегосянаэтойорбитеэлектрона:
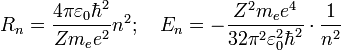
Здесь 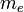 — массаэлектрона, Z —количествопротоноввядре,
— массаэлектрона, Z —количествопротоноввядре, 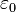 — диэлектрическаяпостоянная, e — зарядэлектрона.
— диэлектрическаяпостоянная, e — зарядэлектрона.
Именнотакоевыражениедляэнергииможнополучить, применяя уравнениеШрёдингера, решаязадачуодвиженииэлектронавцентральномкулоновскомполе.
Радиуспервойорбитыватоме водорода R0=5,2917720859(36)·10−11 м[2], ныненазывается боровскимрадиусом, либо атомнойединицейдлины иширокоиспользуетсявсовременнойфизике. Энергияпервойорбиты 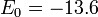 эВ представляетсобой энергиюионизации атомаводорода.
эВ представляетсобой энергиюионизации атомаводорода.
18.Квантоваятеориястроенияатома даетглубокоеобоснованиезаконуМенделеева. [1]
Когдасоздаваласьквантоваятеориястроенияатома, сталоясно, чтоэлектронывсредесвязанывовсякомслучаенеквазиупруго. Так, встаромвариантеквантовойтеорииБораэлектроныдолжныбылидвигатьсявокругядерпонекоторымустойчивымтраекториям. [2]
Согласнопредставлениямквантовойтеориистроенияатома, максимальнаяковалентностьазотасчитаетсяравнойчетырем. [3]
Послеразвитияквантовойтеориистроенияатомов былоестественноискатьпричинунеточностиклассическойформулывнеприменимостиобычноймеханикикатомнымреакциями, вчастности, втомфакте, чтопередачаэнергиивэтихреакцияхможетпроисходитьтолькодискретнымипорциями, хотяэлектронполностьюотрываетсяотатома. Былонайдено, однако ( Фаулер [42]) чтоэтаформуладаетдлятормознойспособностиа-частицзначение, примерновдваразаменьшееэкспериментальнойвеличины. [4]
Этазакономерностьподчиняетсяквантовойтеориистроенияатома. [5]
19.Ква́нтовоечисло́ в квантовоймеханике — численноезначениекакой-либоквантованнойпеременноймикроскопическогообъекта (элементарнойчастицы, ядра, атома ит. д.), характеризующеесостояниечастицы. Заданиеквантовыхчиселполностьюхарактеризуетсостояниечастицы.
Некоторыеквантовыечисласвязанысдвижениемвпространствеихарактеризуютвид волновойфункции частицы. Это, например, радиальное (главное) ( 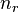 ),орбитальное (
),орбитальное ( 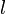 ) и магнитное (
) и магнитное ( 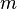 ) квантовыечислаэлектронаватоме, которыеопределяютсякакчислоузловрадиальнойволновойфункции, значениеорбитальногоугловогомоментаиегопроекцияназаданнуюось, соответственно.
) квантовыечислаэлектронаватоме, которыеопределяютсякакчислоузловрадиальнойволновойфункции, значениеорбитальногоугловогомоментаиегопроекцияназаданнуюось, соответственно.
Некоторыедругиеквантовыечисланикакнесвязанысперемещениемвобычномпространстве, аотражают«внутреннее»состояниечастицы. Ктакимквантовымчисламотносится спин иегопроекция. В ядернойфизике вводитсятакже изоспин, ав физикеэлементарныхчастиц появляется цвет, очарование, прелесть (иликрасота[1]) иистинность.
20.Периодическийзакон — фундаментальныйзаконприроды, открытый Д. И. Менделеевым в 1869 годуприсопоставлениисвойствизвестныхвтовремя химическихэлементов ивеличиних атомныхмасс.
Историяоткрытия.
Вмарте 1869 года русскийхимик ДмитрийИванович Менделеев представил Русскомухимическомуобществу сообщениеоботкрытииимПериодическогозаконахимическихэлементов[6]. Втомжегодувышлопервоеизданиеменделеевскогоучебника«Основыхимии», вкоторомбылаприведенаегопериодическаятаблица. Вноябре 1870 года ондоложилРХОстатью«Естественнаясистемаэлементовиприменениееёкуказаниюсвойствнеоткрытыхэлементов», вкоторойМенделееввпервыеупотребилтермин«периодическийзакон» иуказалнасуществованиенесколькихнеоткрытыхещёэлементов.
В 1871 году витоговойстатье«Периодическаязаконностьхимическихэлементов»МенделеевдалследующуюформулировкуПериодическогозакона: «свойствапростыхтел, атакжеформыисвойствасоединенийэлементов, апотомуисвойстваобразуемыхимипростыхисложныхтел, стоятвпериодическойзависимостиотихатомноговеса»[7]. ТогдажеМенделеевпридалсвоейпериодическойтаблицевид, ставшийклассическим (т. н. короткопериодныйвариант).
Вотличиеотсвоихпредшественников, Менделеевнетолькосоставилтаблицуиуказалнаналичиенесомненныхзакономерностейвчисленныхвеличинахатомныхмасс, ноирешилсяназватьэтизакономерности общимзакономприроды. Наоснованиипредположения, чтоатомнаямасса предопределяет свойстваэлемента, онвзялнасебясмелостьизменитьпринятыеатомныевесанекоторыхэлементовиподробноописатьсвойстванеоткрытыхещёэлементов. ДляпредсказаниясвойствпростыхвеществисоединенийМенделеевисходилизтого, чтосвойствакаждогоэлементаявляютсяпромежуточнымимеждусоответствующимисвойствамидвухсоседнихэлементоввгруппепериодическойтаблицы (тоестьсверхуиснизу) иодновременнодвухсоседнихэлементоввпериоде (слеваисправа) (т. н. «правилозвезды»).
Д. И. МенделеевнапротяжениимногихлетборолсязапризнаниеПериодическогозакона; егоидеиполучилипризнаниетолькопослетого, какбылиоткрытыпредсказанныеМенделеевымэлементы: галлий (ПольЛекокдеБуабодран, 1875), скандий (ЛарсНильсон, 1879) и германий (КлеменсВинклер, 1886) — соответственноэкаалюминий, экабориэкасилиций. Ссередины 1880-хгодовПериодическийзаконбылокончательнопризнанвкачествеоднойизтеоретическихосновхимии.
22.ЗаконМозли — закон, связывающийчастоту спектральныхлиний характеристического рентгеновскогоизлучения атома химическогоэлемента сегопорядковымномером. Экспериментальноустановленанглийскимфизиком ГенриМозли в 1913 году.Современнаяформулировкапериодическогозакона. Свойствахимическихэлементов, атакжеформыисвойствасоединенийэлементовнаходятсявпериодическойзависимостиотвеличинызарядаядерихатомов. Аточнеесвойствахимическихэлементовопределяютсяпериодическиповторяющимисяоднотипнымиэлектроннымиконфигурациями.
23.Мозлипоказал, чтонаиболееважнойхарактеристикойэлементов, прямосвязаннойспериодичностьюстроенияихатомов, являетсяатомныйномер ( порядковыйномерэлементаотаблице); онвскрылпричинупериодичностисвойствэлементов, найдяеевпериодичностистроенияихатомов. УжевнашидниподтвердиласьгениальнаядогадкаД. И. Менделееваосуществованиизаурановыхэлементов, которыеобразуютгруппуактиноидов, аналогичнуюгруппелантаноидов.
Причинапериодичностипериферическихсвойств заключаетсявограниченностичислаэлектронов, которыемогутразместитьсянаразныхэнергетическихуровнях.
Причинапериодичностипериферическихсвойств заключаетсявтом, чточислоэлектронов, которыемогутразместитьсянаразныхэнергетическихуровнях, ограничено. Памереростапорядковогономерановыеэлектроны, заполниввсевозможныеместанаболеенизкихуровнях, начинаютзаполнятьследующиеболеевысокиеуровни, повторяяпоследовательностьзаполненияболеенизкихуровнейиструктурувнешнейоболочкиболеелегкихатомов. Томсон ( 1897), еедетальноисследовалБор ( 1922), нолишьпринципПаулидалейправильноетолкование.
Следовательно, причинапериодичностисвойствэлементов установлена, оназаложенавпериодичностиизменениястроенияэлектронныхуровней.
25.Согласно квантовоймеханике, атомынеимеютчеткихграниц, новероятностьнайти электрон, связанныйсядромданного атома, наопределенномрасстоянииотэтогоядра быстроубываетсувеличениемрасстояния. Поэтомуатомуприписываютнекоторыйопределённыйрадиус, полагая, чтовсфереэтогорадиусазаключенаподавляющаячасть электроннойплотности (порядка 90 процентов).
Характернойоценкойрадиусаатомаявляется 1 ангстрем (1 Å), равный 10-10 м.
Энергияионизации — разновидность энергиисвязи или, какеёиногданазывают, первыйионизационныйпотенциал (I1), представляетсобойнаименьшуюэнергию, необходимуюдляудаления электрона отсвободногоатомавегонизшемэнергетическом (основном) состояниинабесконечность.
Эне́ргиейсродства́ а́томакэлектро́ну, илипростоего сродствомкэлектрону (ε), называютэнергию, выделяющуюсявпроцессеприсоединения электрона ксвободномуатомуЭвегоосновномсостоянииспревращениемеговотрицательныйионЭ− (сродствоатомакэлектронучисленноравно, нопротивоположнопознакуэнергииионизациисоответствующегоизолированногооднозарядногоаниона).
Э + e− = Э− + ε
Сродствокэлектронувыражаютв килоджоулях на моль (кДж/моль) илив электронвольтах на атом (эВ/атом).
26.Эле́ктроотрица́тельность (χ) — фундаментальноехимическоесвойствоатома, количественнаяхарактеристикаспособности атома в молекуле смещатьксебе общиеэлектронныепары.
Современноепонятиеобэлектроотрицательностиатомовбыловведеноамериканскимхимиком Л. Полингом. Ониспользовалпонятиеэлектроотрицательностидляобъяснениятогофакта, чтоэнергиягетероатомнойсвязи A—B (A, B —символылюбыххимическихэлементов) вобщемслучаебольше среднегогеометрическогозначениягомоатомныхсвязей A—A и B—B.
Внастоящеевремядляопределенияэлектроотрицательностейатомовсуществуетмногоразличныхметодов, результатыкоторыххорошосогласуютсядругсдругом, заисключениемотносительнонебольшихразличий, ивовсякомслучаевнутренненепротиворечивы.
Типысвязи
· Одноэлектроннаяхимическаясвязь
· Металлическаясвязь
· Ковалентнаясвязь
· Ионнаясвязь
· Ван-дер-ваальсовасвязь
· Водороднаясвязь
· Двухэлектроннаятрёхцентроваяхимическаясвязь
· Одноэлектроннаяхимическаясвязь
· Простейшаяодноэлектроннаяхимическаясвязьсоздаётсяединственным валентнымэлектроном. Оказывается, чтоодинэлектронспособенудерживатьвединомцеломдваположительнозаряженныхиона. Водноэлектроннойсвязикулоновскиесилыотталкиванияположительнозаряженныхчастицкомпенсируютсякулоновскимисиламипритяженияэтихчастицкотрицательнозаряженномуэлектрону. Валентныйэлектронстановитсяобщимдлядвухядермолекулы.
Одинарнаяковалентнаяхимическаясвязьсоздаётсясвязывающейэлектроннойпарой. Вовсехсуществующихтеориях (теориявалентныхсвязей, теориямолекулярныхорбиталей, теорияотталкиваниявалентныхэлектронныхпар, боровскаямодельхимическойсвязи) связывающаяэлектроннаяпарарасполагаетсявпространствемеждуатомами молекулы. Различаютполярнуюинеполярнуюковалентнуюсвязи.
· Неполярнаяковалентнаясвязьимеетместовгомоядерных двухатомныхмолекулах, вкоторыхсвязывающаяэлектроннаяпараравноудаленаотобоихядермолекулярнойсистемы (рис.2). Расстояние d междуатомнымиядрамиможнорассматриватькаксумму ковалентныхрадиусов соответсвующихатомов.
· Расстояниемеждуатомнымиядрамиводинарнойдвухэлектроннойковалентнойсвязикорочеаналогичногорасстояниявпростейшейодноэлектроннойхимическойсвязи.
28.Ковалентнаясвязь (атомнаясвязь, гомеополярнаясвязь) — химическаясвязь, образованнаяперекрытием (обобществлением) пары валентных электронныхоблаков. Обеспечивающиесвязьэлектронныеоблака (электроны) называются общейэлектроннойпарой.
Методвалентныхсвязей (МВС) иначеназываюттеориейлокализованныхэлектронныхпар, посколькувосновеметодалежитпредположение, чтохимическаясвязьмеждудвумяатомамиосуществляетсяспомощьюоднойилинесколькихэлектронныхпар, которыелокализованыпреимущественномеждуними. ВотличиеотММО, вкоторомпростейшаяхимическаясвязьможетбытькакдвух-, такимногоцентровой, вМВСонавсегдадвухэлектроннаяиобязательнодвухцентровая. Числоэлементарныххимическихсвязей, которыеспособенобразовыватьатомилиион, равноеговалентности. Также, какивММО, вобразованиихимическойсвязипринимаютучастиевалентныеэлектроны. Волноваяфункция, описывающаясостояниеэлектронов, образующихсвязь, называетсялокализованнойорбиталью (ЛО).
Отметим, чтоэлектроны, описываемыеЛО, всоответствииспринципом Паули должныиметьпротивоположнонаправленныеспины, тоестьвМВСвсеспиныспарены, ивсемолекулыдолжныбытьдиамагнитны. Следовательно, МВСпринципиальнонеможетобъяснитьмагнитныесвойствамолекул.
Темнеменее, принциплокализованныхсвязейимеетрядважныхпреимуществ, одноизкоторых–егочрезвычайнаянаглядность. МВСдостаточнохорошо, например, предсказываетвалентныевозможностиатомовигеометриюобразующейсямолекулы. ПоследнееобстоятельствосвязаностакназываемойгибридизациейАО. Онабылавведенадляобъяснениятогофакта, чтодвухэлектронныедвухцентровыехимическиесвязи, образованныезасчетАОвразныхэнергетическихсостояниях, имеютодинаковуюэнергию. Так, Be*(2s11p1), B*(2s12p2), C*(2s12p3) образуютзасчет s- и p-орбиталейсоответственнодве, триичетыресвязи, апотомуоднаизнихдолжнабытьпрочнеедругих. Однакоопытпоказывает, чтов BeH2, BCl3, CH4 всесвязиравноценны. У BeH2 уголсвязиравен 180°, у BCl3 – 120°, ау CH4 – 109°28'.
29.Методмолекулярныхорбиталей исходитизтого, чтокаждуюмолекулярнуюорбитальпредставляютввидеалгебраическойсуммы (линейнойкомбинации) атомныхорбиталей. Например, вмолекулеводородавобразованииМОмогутучаствоватьтолько 1s атомныеорбиталидвухатомовводорода, которыедаютдвеМО, представляющиесобойсуммуиразностьатомныхорбиталей 1s1 и 1s2 – МО± = C11s1 ±C21s2.
Теориявалентныхсвязей (методвалентныхсвязей, методвалентныхсхем, методлокализованныхэлектронныхпар) —приближённый квантовохимический расчётныйметод, основанныйнапредставленииотом, чтокаждаяпара атомов в молекулеудерживаетсявместеприпомощиоднойилинесколькихобщихэлектронныхпар.
30.Валентностьвковалентныхсоединениях равначислуэлектронныхпар, участвующихвобразованиисвязи.Следовательно, валентностьэлементаопределяетсячисломэлектронов, участвующихвобразованиихимическихсвязей. Частовалентностьэлементовсравниваютсвалентностьюводорода, принятойзаединицу. Например, вбромоводороде  бромодновалентен; ваммиаке
бромодновалентен; ваммиаке  азоттрехвалентен; вметане
азоттрехвалентен; вметане 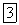 углеродчетырехвалентен. Нередковалентностьэлементовопределяютиизихкислородныхсоединений. Например, вдиоксидекремния
углеродчетырехвалентен. Нередковалентностьэлементовопределяютиизихкислородныхсоединений. Например, вдиоксидекремния  кремнийчетырехвалентен, втриоксидехрома
кремнийчетырехвалентен, втриоксидехрома 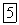 хромшестивалентен, втетраоксидерутения
хромшестивалентен, втетраоксидерутения  рутенийвосьмивалентен.
рутенийвосьмивалентен.
Насыщаемостьковалентнойсвязи вызываетсяограничениемчислаэлектронов, находящихсянавнешнихоболочках, которыемогутучаствоватьвобразованииковалентнойсвязи. [1]
Однакопонятиенасыщаемостиковалентнойсвязи нельзярассмат - риватькакабсолютное. Можносебепредставить, чтоприсближениидвухмолекулЬЬвнешнеевоздействиепреодолеваетсилыотталкиванияичетыреэлектронаразместятсянадвухновыхорбиталях, охватывающихвсечетыреядраводорода.
31.Полярностьхимическихсвязей — характеристика химическойсвязи, показывающаяизменениераспределения электроннойплотности впространствевокругядервсравнениисраспределениемэлектроннойплотностивобразующихданнуюсвязьнейтральных атомах.
Вкачествеколичественноймерыполярностисвязииспользуютсятакназываемыеэффективныезарядынаатомах.
Эффективныйзарядопределяетсякакразностьмеждузарядомэлектронов, находящимсявнекоторойобластипространствавблизиядра, изарядомядра. Однакоэтамераимеетлишьусловныйиприблизительныйсмысл, посколькуневозможнооднозначновыделитьвмолекулеобласть, относящуюсяисключительнокотдельномуатому, апринесколькихсвязях —кконкретнойсвязи.
Наличиеэффективногозарядаможетбытьуказаносимволамизарядовуатомов (например, Н+δ — Cl−δ, гдеδ —некотораядоляэлементарногозаряда).
Практическивсехимическиесвязи, заисключениямсвязейвдвухатомныхгомоядерныхмолекулах —втойилиинойстепениполярны. Ковалентныесвязи обычнослабополярны. Ионныесвязи — сильнополярны.
Полярностьмолекул
Молекулы, которыеобразованыатомамиодногоитогожеэлемента, какправило, будут неполярными, какнеполярныисамисвязивних. Так, молекулыН2, F2, N2 неполярны.
Дипольныймомент электрический, векторнаявеличина, характеризующаяасимметриюраспределенияположительныхиотрицательныхзарядоввэлектрическинейтральнойсистеме. Дваодинаковыхповеличинезаряда +qи —q образуютэлектрическийдипольсдипольныймомент m = q l, где l - расстояниемеждузарядами.
32.Направленность – т. е. связьобразуетсявнаправлениимаксимальногоперекрытияэлектронныхоблаков. Относительнолиниисоединяющейцентрыатомовобразующихсвязьразличают: σ и π(рис. 9):
σ-связь –образованаперекрываниемАОполиниисоединяющейцентрывзаимодействующихатомов; π-связь–этосвязь, возникающаявнаправленииосиперпендикулярнойпрямой, соединяющейядраатома.
Направленностьсвязиобусловливаетпространственнуюструктурумолекул, т. е. ихгеометрическуюформу.
ГИБРИДИЗАЦИЯАТОМНЫХОРБИТАЛЕЙ , квантовохим. способописанияперестройкиорбиталейатомавмолекулепосравнениюсосвоб. атомом. Являясьформальныммат. приемом, гибридизацияатомныхорбиталейпозволяетотразитьнарушениесферич.симметриираспределенияэлектроннойплотностиатомаприобразованиихим.связи. Сущностьгибридизацииатомныхорбиталейсостоитвтом, чтоэлектронмолекулывблизивыделенногоатомногоядрахарактеризуетсянеотдельнойатомнойорбиталью (АО), алинейнойкомбинациейатомныхорбита-лейсразл. значениямиазимутальногоимагнитногоквантовыхчисел. Такаялинейнаякомбинацияназ. гибридной (гибридизированной)орбиталью (ГО). Какправило, гибридизациязатрагиваетлишьвысшиеиблизкиепоэнергиизанятыеАОсвоб. атома.
33.Ионнаясвязь — оченьпрочная химическаясвязь, образующаясямеждуатомамисбольшойразностью (>1,5 пошкалеПолинга) электроотрицательностей, прикоторойобщая электроннаяпара полностьюпереходиткатомусбольшейэлектроотрицательностью.Этопритяжениеионовкакразноименнозаряженныхтел. Примеромможетслужитьсоединение CsF, вкотором«степеньионности»составляет 97 %. Рассмотримспособобразованиянапримерехлориданатрия NaCl. Электроннуюконфигурациюатомовнатрияихлораможнопредставить: 11 Na 1s2 2s2 2p 6 3s1; 17 Cl 1s2 2s2 2p6 Зs2 3р5. Этоатомыснезавершеннымиэнергетическимиуровнями. Очевидно, дляихзавершенияатомунатриялегчеотдатьодинэлектрон, чемприсоединитьсемь, аатомухлоралегчеприсоединитьодинэлектрон, чемотдатьсемь. Прихимическомвзаимодействииатомнатрияполностьюотдаетодинэлектрон, аатомхлорапринимаетего. Схематичноэтоможнозаписатьтак: Na. — l е—> Na+ ионнатрия, устойчиваявосьмиэлектронная 1s2 2s2 2p6 оболочказасчетвторогоэнергетическогоуровня. :Cl + 1е --> .Cl - ионхлора, устойчиваявосьмиэлектроннаяоболочка. Междуионами Na+ и Cl- возникаютсилыэлектростатическогопритяжения, врезультатечегообразуетсясоединение. Ионнаясвязь —крайнийслучайполяризации ковалентнойполярнойсвязи. Образуетсямеждутипичными металлом и неметаллом. Приэтомэлектроныуметаллаполностьюпереходяткнеметаллу. Образуютсяионы.
Механизмобразованияионнойсвязиможнорассмотретьнапримеререакциимеждунатриемихлором. Атомщелочногометаллалегкотеряетэлектрон, аатомгалогена - приобретает. Врезультатеэтоговозникаеткатионнатрияихлорид-ион. Ониобразуютсоединениезасчетэлектростатическогопритяжениямеждуними.
Взаимодействиемеждукатионамиианионаминезависитотнаправления, поэтомуоионнойсвязиговоряткаконенаправленной. Каждыйкатионможетпритягиватьлюбоечислоанионов, инаоборот. Вотпочемуионнаясвязьявляетсяненасыщенн
