Металлическая связь. Свойства соединений с металлической связью
Металлическая связь, химическая связь, обусловленная взаимодействием электронного газа (валентные электроны) в металлах с остовом положительно заряженных ионов кристаллической решетки. Идеальная модель металлической связи отвечает образованию частично заполненных валентными электронами металла зон энергетических уровней, называемых зонами проводимости. При сближении атомов, образующих металл, атомные орбитали валентных электронов переходят в орбитали, делокализованные по кристаллич. решетке аналогично делокализованным p-орбиталям сопряженных соединений. Количественно описать металлическую связь можно только в рамках квантовой механики, качественно образование металлической связи можно понять исходя из представлений о ковалентной связи.
При сближении двух атомов металла, например Li, образуется ковалентная связь, при этом происходит расщепление каждого энергетич. уровня валентного электрона на два. Когда N атомов Li образуют кристаллическую решетку, перекрывание электронных облаков соседних атомов приводит к тому, что каждый энергетич. уровень валентного электрона расщепляется на N уровней, расстояния между которыми из-за большой величины N настолько малы, что их совокупность может считаться практически непрерывной зоной энергетических уровней, имеющей конечную ширину. Поскольку каждый атом участвует в образовании большего числа связей, чем, например, в двухатомной молекуле при том же числе валентных электронов, то минимум энергии системы (или максимум энергии связи) достигается при расстояниях больших, чем в случае двухцентровой связи в молекуле. Межатомные расстояния в металлах заметно больше, чем в соед. с ковалентной связью (металлич. радиус атомов всегда больше ковалентного радиуса), а координационное число (число ближайших соседей) в кристаллических решетках металлов обычно 8 или больше 8. Для наиболее часто встречающихся кристаллических структур координационные числа равны 8 (объемноцентрированная кубическая), 12 (гранецентрированная кубическая и гексагональная плотно-упакованная). Расчеты параметров металлических решеток с использованием ковалентных радиусов дают заниженные результаты. Так, расстояние между атомами Li в молекуле Li2 (ковалентная связь) равно 0,267 нм, в металле Li-0,304 нм. Каждый атом Li в металле имеет 8 ближайших соседей, а на расстоянии, в 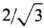 раз большем,-еще 6. Энергия связи в расчете на один атом Li в результате увеличения числа ближайших соседей увеличивается с 0,96.10-19 Дж для Li2 до 2,9.10-19 Дж для кристаллич. Li.
раз большем,-еще 6. Энергия связи в расчете на один атом Li в результате увеличения числа ближайших соседей увеличивается с 0,96.10-19 Дж для Li2 до 2,9.10-19 Дж для кристаллич. Li.
Во многих металлах металлическая связь между атомами включает вклады ионной или ковалентной составляющей. Особенности металлической связи у каждого металла могут быть связаны, например, с электростатическим отталкиванием ионов друг от друга с учетом распределения электрических зарядов в них, с вкладом в образование связи электронов внутренних незаполненных оболочек переходных металлов, с корреляцией движения электронов в электронном газе и некоторыми другими причинами.
металлическая связь характерна не только для металлов и их сплавов, но и для интерметаллических соединений, она сохраняется не только в твердых кристаллах, но и в расплавах и в аморфном состоянии.
20.Водородная связь, ее энергия, возможность образования, значение в химизме процессов в растворах.
Водородную связь относят к числу слабых химических взаимодействий. Энергия водородной связи обычно лежит в пределах от 10 до 30 кДж/моль, хотя иногда она достигает и сотен кДж/моль. Энергии обычных химических связей (ковалентных и ионных), как правило, заметно превышают 150 кДж/моль, достигая, например, для молекул азота или оксида углерода величин 900 кДж/моль и более [1]. Тем не менее за последние полвека появилось четкое понимание исключительной роли слабых взаимодействий, прежде всего роли водородных связей в стабилизации конденсированных состояний многих простых молекулярных систем, например воды, фтороводорода, и, что самое существенное, в стабилизации биополимеров (нуклеиновых кислот, белков).
Водородные связи позволяют полимерным цепям соединяться в специфические трехмерные структуры, приобретающие при этом функциональную биологическую активность, структуры, с одной стороны достаточно прочные (за счет образования большого числа водородных связей), а с другой - достаточно чутко реагирующие на изменение внешних условий (например, приближение той или иной молекулы) именно из-за того, что эти взаимодействия являются слабыми. Разрыв таких связей лишает белки или нуклеиновые кислоты их биологических функций. Отсюда, в частности, видна исключительно важная роль водородных связей, которую они играют в биологических процессах на молекулярном уровне [2]. Понятно и то важное значение исследований и понимания природы водородных связей, которым в последние время было уделено столь пристальное внимание ученых различных направлений.
Долгое время доминировала сугубо электростатическая точка зрения: атом водорода, образующий такую связь, обычно связан с достаточно хорошо выраженным электроотрицательным атомом, то есть атомом с высоким сродством к электрону, из-за чего электронная плотность на атоме водорода понижена по сравнению с плотностью изолированного атома водорода. Следовательно, суммарный электрический заряд на таком атоме оказывается положительным, что и позволяет атому взаимодействовать еще с одним электроотрицательным атомом. Такое взаимодействие с каждым из двух атомов, как правило, слабее взаимодействия с тем атомом, с которым атом водорода был соединен первоначально. Образование подобной связи с третьим и т. д. атомом практически оказывается невозможным из-за того, что начинает доминировать электростатическое отталкивание электроотрицательных атомов друг от друга [1]. Современные расчеты показывают, однако, что суммарный заряд на атоме водорода, участвующем в образовании водородной связи, практически не меняется по сравнению с зарядом в мономерной молекуле, что говорит о том, какую заметную роль в образовании водородной связи должны играть поляризация, перераспределение электронного заряда в отдельных областях пространства.
В настоящее время интерпретация образования химической связи дается, как правило, на языке теории молекулярных орбиталей, то есть в предположении, что для описания электронной структуры молекулы достаточно хорошим является приближение, когда каждый электрон задается своей одноэлектронной функцией, своей орбиталью.
Общей причиной возникновения водородной связи, как, впрочем, и других выделяемых обычно типов химических связей, является главным образом электростатическое, кулоновское взаимодействие разноименных зарядов тех частиц, которые образуют молекулу. Правда, это взаимодействие отличается от того, которое встречается в классической теории, поскольку оно не определяется только лишь плотностью распределения положительного и отрицательного зарядов, а выражается более сложным образом с помощью волновых функций, определяющих состояния молекулярной системы [3-5]. Поэтому естественно стремление найти некоторые более простые образы, которые давали бы возможность наглядно представить себе, как же все-таки образуется химическая связь.
Одно из таких представлений базируется на анализе перераспределения электронной плотности при образовании системы: увеличение электронной плотности в пространстве между ядрами ведет к усилению электростатического взаимодействия между электронами в этом пространстве и ядрами, что сопровождается, в свою очередь, понижением энергии системы
