Расчетные химические задачи, их типы, овладение уч-ся по годам. Методические приемы формирования у уч-ся умения решать расчетные задачи по химии.
Расчетные химические задачи, их типы, овладение уч-ся по годам. Методические приемы формирования у уч-ся умения решать расчетные задачи по химии.
Хим. задачи помогают соверш-ю качества обучения уч-ся, закреплению приобр. знаний, форм-я умения, переносу их в новые ситуации, установлению межпредметных связей. Содействуют приобр. практич. умений и навыков уч-ся (производить расчеты и опыты), служат важным средством развития мышления уч-ся.
Клас-ция хим. задач: 1) качественные (на наблюдение, получение, док-ва отношения в-ва к группе, распознав. в-в, разделение смеси в-в, на конструирование приборов) 8-11 кл.
2) расчетные: * по хим. формулам (Вычисление Mr, массовой доли эл-тов в сл. в-ве, химического кол-ва в-ва по объему по массе, вычисление Mr по относит плотности, масса р-ра и раств. в-ва по массовой доле); по хим. уравнениям ( по известной массе одного из в-в, вычисление объема газа, расчет объемных отношений, по термохим. уравн., р-ции в р-рах, по избытку одного из в-в, примеси); * задачи на выведение формулы ( по массовым долям по колич. и кач. анализу орг. соед.). Классы см. в программке.
Общие метод. приемы по решению задач: кач-во теор. знаний (хим. св-в, способов получения и т.д.); умения проводить анализ условия задач, записывать краткое условие, отметить известные и неизвестные величины, продумать логическую цепочку в решении задачи; составление условий прямых и обратных задач; использование алгоритмов решения типовых задач, использовать наглядность по-возможности, исп. индивид и диф. подхода к уч-ся, исп-е единого образца оформления задач.
РАСТВОРЫ
-это гомогенные(однородные) системы переменного состава, состоящие из двух и более компанентов.*10-8 размеры частиц в растворах.*В зависимости от агрегатного состояния р-ры могут быть: твердыми, жидкими, газообразными.
Вкатодном р-ре имеется растворенное в-во и растворитель(это в-во),кот. в чистом виде нах-ся в такой же фазе,что и раствор.(кого больше-тот растворитель).
Мех-зм процесса растворения:
1. разрушаются связи или силы ММВ в исходных в-вах(эндотермический пр.,Qразр.<0 (∆H>0)).
2. возникают силы взаимодействия между растворенным в-вом и раствор-м(экзотермический пр.,Qгидрат.>0 (∆H<0)).
В воде(полярн.раствор-ль) будут растворяться в-ва:
1. с ионной кристалл. решеткой
2. полярные молекулы
3. молекулы,связанные водородной св.
Общий тепловой эффект процессов растворения Qраств.=Qразр.+Qгидр.(Н2SO4)>0,т.к.Qразр.<<Qгидр. Гидраты,нестойкие соединения и при нагревании они разлагаются, но иногда гидраты настолько прочны, что при выделении раствор-го в-ва из р-ра Н2О входит в состав его кристаллов(наз.кристаллогидраты),а вода- кристаллизац-й. Способность в-ва переходить в р-р,т.е. растворяться,наз-ся растворимостью.Мерой раств-ти в-ва при данных условиях, является масса в-ва в насыщенном р-ре.Насыщенный р-р, в кот. при данной t сущ-т динамическое равновесие между нераств.частью в-ва и в-вом в раствор-м состоянии. Количественной хар-кой раств-ти явл. молярная конц-я насыщенного р-ра(моль/л) или массовая доля растворенного в-ва в насыщенном р-ре.
Кs= (коэф.раств-ти), кот. показывает массу в-ва, кот. может раств-ся в 100г растворителя(Н2О).
Ненасыщенный р-р-это р-р, в кот. может быть раств-но еще некоторое кол-во растворенного в-ва при данной t.
Пересышенный р-р-при данной t раств-го в-ва содержится больше, чем в насыщенном р-ре. Неустойчивы эти р-ры,даже от сотрясения может выпасть избыток растворенного в-ва. Эти р-ры примен-ся для очистки в-в в перекристаллизации.
СПОСОБЫ ВЫРАЖЕНИЯ СОДЕРЖАНИЯ В-ВА В Р-РАХ:
1. массовая доля раств-го в-ва (W): W=m(в-ва)/m(р-ра)*100%
2. массовая концентрация(ρ): ρ=m(в-ва)/V(р-ра)
3. молярная концентрация: С(в-ва)=n(в-ва)⁄V(в-ва)
4. моляльность(ß):ß(в-ва)=n(в-ва)⁄m(р-ля)
3. Арены.Понятие об ароматичности.
1 подход: отнесли соединения, обладающие ароматом
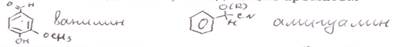
2 подход: относили соединения, содержащие бензойные кольца. На данном уровне Кекуле и Бутлеров внесли вклад по строению бензола. В то время знали, что по строению – это ненасыщенные соединения, т.е.кол-во водорода не максимально, и в то же время для них не были характерны реакции присоединения. Почему? Было предложено считать, что в бензоле и его аналогах электронная плотность 3х π связей делокализована. Это можно показать в виде резонансных структур, либо нарисовать обобщенную формулу

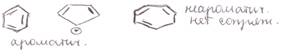
3 подход: правило Хюккеля ароматичными являются соединения, содержащие плоские замкнутые системы сопряженных π связей и/или неподеленных электронных пар и свободные орбитали, число ē-ов, кот. N=4n+2, где n=0, 1, 2, и т.д. Соединения с аналогичными системами, где N=4n, являются антиароматичными.

Номенклатура аренов. В основе названия циклических систем лежат тривиальные названия
I Моноциклические арены
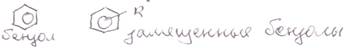
II Би- и полициклические арены: с изолированными циклами

С конденсированными циклами
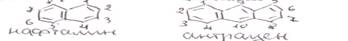
Номенклатура замещенных бензолов и их аналогов
1-й случай: если боковая цепь имеет сложное строение, то она выбирается главной. Бензойная система тогда выступает в качестве заместителя с тривиальным названием фенил (нафтил, антроцил)
2-й случай: в остальных случаях в качестве главной цепи выбирается бензойная система, при этом ряд функционально замещенных бензолов имеет тривиальные названия

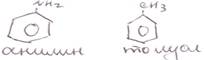
При введении дополнительных заместителей, последние выступают в названии всегда в качестве заместителей, при этом при этом при наличии функциональной группы, определяющей название класса, нумерация начинается от атома С, связанного с этой группой.
3-амино-4-нитро-5-метилбензальдегиж 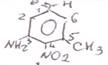
При наличии только 2-х заместителей, их положение можно назвать с помощью префиксов «о» - орто- рядом, «м» - мета- через один атом С, «п» - пара – через два атома С.
1,4-диметилбензл
n-диметилбензол
n-кслило
Химические свойства
1) реакции функциональных групп (f) – аналогичны реакциям соответствующих неароматических соединений.
2) реакции боковой (углеродной) цепи – аналогичны свойствам алканов и реакциям тех функциональных групп, которые содержатся в боковой цепи.
3) Реакции ароматического кольца.
2) Реакции боковой цепи: характерны реакции радикального замещения α-атома С
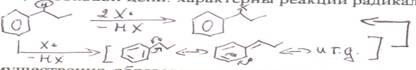
преимущественно образование продуктов α-замещения объясняется повышенной стабильностью соответствующего промежуточного бензильного радикала за счет делокализации ē с участием Ph
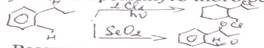
4) Реакции ароматического кольца. 1.Реакции с образованием неароматических продуктов. Ароматичность выгодна, данные процессы протекают в жестких условиях
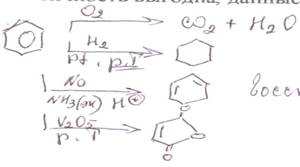
Данные процессы протекают в более мягких условиях для конденсированных аналогов бензола
2. Реакции с образованием ароматических продуктов. Для аренов характерны реакции замещения водорода, которые протекают с участием Е и Nu
а) реакции эдектрофильного замещения (SEAr) происходит по механизму присоединения-отщепления
Электрофильное замещение в ряду монозамещенных бензолов
Электроно-доноры (D): alk; -OR, -NR2, -SR; -Hal.
Электронно-акцептор (А): -CF3; -C=N; -C-X; -NO2; -SO3H
Заместители влияют на скорость и направление процесса.
Элекронодонорные заместители (кроме Hal) ускоряют, а электроноакцепторные – замедляют процесс электрофильного замещения.
Влияние на направление процесса:
Если 2-я стадия обратима, то обратимой является вся реакция (это только алкилирование и сульфирование в жестких условиях).
При установлении равновесия соотношение продуктов реакции определяется их относительной стабильностью. М > П > О
Если 2-я стадия необратима, то с учетом того, что она очень быстрая соотношение продуктов реакции соответствует соотношению σ-комплексов.
Поскольку переходное состояние похоже на σ-комплекс, факторы влияющие на их состояние аналогичны => более стабильный σ-комплекс соответствует более стабильному переходному состоянию и более стабильный σ-комплекс образуется быстрее.
Факторы стабилизации σ-комплекса:
1) электронный: в случае D более стабильным является о- и п- σ-комплексы за счет участия в делокализации заместителя.
2) Стерический: при наличии объемных и/или полярных заместителей более стабильными являются м- и п- σ-комплексы.
В случае А все наоборот.
И в соотсетствии с ē-ым фактором D заместители являются о- и п-ориентантами, а А заместители м-ориентантами.
SEAr дизамещенных бензолов : согласованная ориентация
Несогласованная ориентация: т.к. D ускоряют, а А замедляют процесс, то при несогласованной ориентации учитывают влияние D заместителя
Правило Чаргаффа.
В препаратах ДНК число пиримидиновых снований равно числу пуриновых оснований, т.е. Ц=Г, А=Т или АТ=ГЦ.
Модель Утсона-Крика.Согласно модели: моекула ДНК состоит из 2-х полинуклеотидных цепей, правозакрученных вокруг общей “оси”, которые образует двойную спираль – дуплекс. Имеются 2 бороздки: малая (1,2 нм) и большая (2,2 нм).
Две полинуклеотедных цепочки антипараллельны, гидрофобные.
Азотные основания располагаются внутри дуплекса стопочкой и перпендикулярны общей оси, пересекая общую ось в центре.
Азотные основания поглощают свет в УФ излучении.
Гипохромный эффект – уменьшение интенсивности поглощения.
Каждое пуриновое основание одной цепи спарено с лежащим в той же плоскости пиримидиновым основанием второй цепи при помощи водородных связей.
Комплементарные пары. Каждая из этих пар повернута на 36о вокруг общей оси по отношению к следующей паре оснований.
Две комплементарные цепочки имеют различный нуклеотидный состав и нуклеотидную последовательность друг к другу, т.е. зная нуклеотидный состав одной цепи, можно определить состав второй цепи.
Гидрофильные основы 2-х цепей, состоящие из чередующихся остатков дезоксирибозы и фосфорной кислоты, представляет собой полианионы, которые стабилизированы противоположными ионами (Mg2+, гистоны) и обращены в сторону клетки (воды).
Стабилизация молекулы ДНК происходит за счет водородных связей между компонентами парами (располагаются перпендикулярно оси), за счет гидрофобных взаимодействий между пуриновыми и пиримидиновыми основаниями, за счет электростатического взаимодействия между ДНК как полианионом и противоположно заряженными ионами белков.
Число нуклеотидных пар в одном витке – 10,4.
Шаг спирали –
Молекула ДНК имеет много форм и каждая из этих форм подчиняется правилу Уотсона-Крика, кроме параметров.
Химическая связь.
Электронная теория химической связи возникла в начале xx века, после того как было установлено сложное строение атома. Химическая связь-связь между атомами посредствам электронов.
Теория образования ионной и ковалентной связи(Коссель,Льюис):все атомы, обладающие незаконченной(химически активной) электронной оболочкой,стремятся завершить свой энергетический уровень до 8-електронной устойчивой оболочки(или 2-электронной).
Химическая связь, возникающая за счет обобществления электронных пар называется ковалентной.
По Косселю происходит полная отдача атомам своих внешних ē (с образованием + ионов) или присоединение атомам недостоющих ē(с образованием – ионов).А прочность образования соединения достигается за счет электростатического взаимного притяжения.Такая связь называется ионной.
Теория Льюиса-Косселя не объяснила как могут спариваться ,если имеют один – заряд и поэтому должны отталкиваться.
В 1927 г дается первая квантово-механическая теория образования химической связи. Гайтнер и Лондон создали спиновую теорию химической связи(на примере обр H2).В 1932 г эта теория была перенесена все многоэлектронные атомы получила название теории валентных связей.Если 2 атома водорода находятся на большом расстоянии др от др,то всякое взаимодействие между ними отсутствует. При их сближении возможно 2 вида взаимодействия:Я1-Я2, ē 1- ē 2 и Я1- ē2,Я2 ē-1.Химическая связь образуется тогдасилв притяжения больше сил оталкивания. Выводы из теории валентных связей:теория учитывает участие в образовании химических связей только валентных ē ;Хим связь обр в том случае,если происходит выйгрыш в энергии в системе);химическая связь тем прочнее,чем выше степень перекрывания электронных обоаков;химическая связь-связь между атомами за счет электростатического взаимодействия ẽ и ядер атомов.
Химическая связь бывает трех типов:ковалентная,ионная,металлическая.
Ковалентная связь бывает двух типов:
1.δ-связь-химическая связь в молекуле,осуществляемая одной электоронной парой. Образуется она при перекрывании электронных облаков вдоль линии, соединяюжей атомов ядра. Характерна осевая симметрия относительно линиям связи. При повороте не разрывается ее прочность зависит только от плотности перекрывания электронных облаков.
2. π-связь- образована при перекрывании электронных облаков вне линии, соединяющей ядра атомов. Обр происходит за счет чистых(негибридных)p-облаков.Но это возможно лишь для элементов 2-го периода, а для элементов с 3-го периодаобр происходит за счет d-облаков. Она не обладает осевой симметрией относительно линии, соединяющей ядра, поворот одного из атомов на 90 градусов приводит к ее разрыву(менее прочная и более реакционно способная).
Кратность связи изменяется числом пар обобществленных ē. Повышение кратности приводит к упрочнению межатомных связей.
Характеристики ковалентной связи:
1.Длина связи- это расстояние между ядрами атомов, образующих молекулу(зависит от радиуса атома)
2.Энергия связи- энергия,которая выделяется при образовании химической связи или затрачивающаяся на ее разрыв.(является мерой прочности хим связи)
Свойства ковалентной связи:
1.Насыщаемость-вследствии насыщаемости связи молекулы имеют определенное состояние. Число ковалентных связей ,которые может обр атом определяется числом его валентных орбиталей,способных участвовать в обр хим связи. Атомы элементов 2-го периода могут обр максимально 4 химич связи, т.к. они имеют 4 валентных орбитали. Атомы элементов 3-го периода могут обр 9 хим связей(теоретически),а практически 6.
2.Направленность ков связи определяется напрвленностью электронных облаков центрального атома, участвующего в обр δ-связи.
Когда центральный атом обр 2 δ-связи,в обр кот участвуют разные s и p орбитали-sp-гибридзация(молекула имеет линейную форму).Когда центральный атом обр 3 δ-связи (участвуют 1s и 2p облака)-sp2- гибридзация(плоская форма).Когда центральный атом обр 4 δ-связи (1s и 3p)-sp3- гибридзация(тетраэдрическая форма).
3.Полярность определяется различием энергии ионизации атомов,участвующих в обр связи.
4.Поляризуемость связи-способность ковалентной связи деформироваться(изменять свою полярность под влиянием внешнего электронного поля).Поляризуемость зависит от плотности перекрывания облаков и от длины связи(чем больше длина связи, тем легче она поляризуется).
Ионная связь.
Если хим. св. образуется между атомами, кот. им. очень большую разность электроотрицательностей (∆ЭО > 1,7) , то общая электрон. пара полностью переходит к атому с большей ЭО. Результатом этого является образование частиц, им. электрические заряды. Эти частицы называются ионами.
Между образовавшимися ионами возникает электростатическое притяжение, кот. наз. ионной связью. Способность к образованию + и – ионов оценивается энергией ионизации и эн. сродства к электрону.
Легче всего образуются катионы (+) – элем. с малой эн. ионизации, т.е. это элем (S) – щел. и щел.-зем. металлы. А простые ионы легче образ. р-элем. 7 группы в следствии их высокого сродства к электрону.
Основные свойства ионной св.
Силовые поля распростр. равномерно во всех направлениях в пространстве. Каждый ион может притягивать ионы противоположного знака в любом направлении. Т.е. ионная связь ненаправлена.
Взаимодействие двух противоположно заряженных ионов друг с другом не может привести к полной взаимной компенсации их силовых полей. У них сохраняется способность притягивать ионы противоположного знака и по другим направлениям – ненасыщаемость ионной связи.
В кристаллической решетке ионных соединений вокруг каждого иона располагается определенное число ионов с противоположным знаком. Например, в кристалл. решетке NaCl каждый ион Na+ окружен 6 хлорид-ионами, а каждый Cl- окружен 6 ионами натрия.
Свойства соед. с ион. св. (t0 кип. и плав., растворимость, сила электролита) зависят от степени ионности св., кот. нах. в обратной зависимости от: поляризующей способности катиона (способность его деформировать окружающие анионы) или поляризуемости аниона (способности аниона к деформации, иначе к дополнит. поляризации). – это все зависит от заряда и размера иона. Чем больше заряд катиона и меньше его размер, тем больше его пол. способность катиона. Чем больше заряд аниона и больше его размер, тем больше его поляризуемость. Чем выше ионность связи, тем вещество легче диссоциирует на ионы, тем больше его растворимость, тем выше его t0 кип. и плав.
r кат.(r.к.), пол способность (с.п.), ионность связи (и.с.), сила электролита (с.э.), растворимость (р), t0 кип. и плав. (t0), r аниана (r.а.), поляризуемость (п).
r.к с.п. и.с. с.э. р. t0
LiOH ↓ ↑ ↓ ↑ ↓ ↓
NaOH ↓ ↑ ↓ ↑ ↓ ↓
KOH ↓ ↑ ↓ ↑ ↓ ↓
r.а п и.с. с.э. р. t0.
AlF ↓ ↓ ↑ ↑ ↑ ↑
AgCl ↓ ↓ ↑ ↑ ↑ ↑
AgBr ↓ ↓ ↑ ↑ ↑ ↑
AgJ ↓ ↓ ↑ ↑ ↑ ↑
Фенолы
Фенолы — это производные ароматических углеводородов, содержащие одну или несколько гидроксильных групп у атомов углерода бензольного кольца.
Классификация: Одноатомные, Двуатомные, Трехатомные.
Номенклатура и изомерия
Возможны два типа изомерии: изомерия положения заместителей в бензольном кольце и изомерия боковой цепи (строения алкильного радикала и числа радикалов).
Многие фенолы имеют тривиальные названия.
С6H5OH – фенол
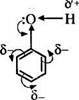 Электронное строение
Электронное строение
Фенолы представляют собой полярные соединения (диполи). Бензольное кольцо является отрицательным концом диполя, группа — ОН — положительным. Дипольный момент направлен в сторону бензольного кольца.
Фенол является слабой кислотой. В этом состоит главное отличие фенолов от спиртов, которые являются неэлектролитами.
Физические свойства
Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления.
Фенол С6Н5ОН (карболовая кислота) — бесцветное кристаллическое вещество, 1°тят = 43°С, /°кип = 182°С, на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66°С смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком.
Химические свойства
Химические свойства фенолов обусловлены наличием в их молекулах функциональной группы — ОН и бензольного кольца.
I. Реакции с участием гидроксильной группы
Кислотные свойства
1) Диссоциация в водных растворах с образованием фенолят-ионов и ионов водорода
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов):
C6H6OH + NaOH = C6H6ONa + H2O фенолят натрия
3) Взаимодействие с активными металлами с образованием фенолятов
2C6H6OH + 2K = 2C6H6OK + H2
Образующиеся в результате реакций 2) и 3) феноляты легко разлагаются при действии кислот. C6H6ONa + H2CO3 = C6H6OH + NaHCO3
Феноляты используются в качестве исходных веществ для получения простых и сложных эфиров фенола: C6H6ONa + CH3CH2Br = C6H6-OCH2CH3 + NaBr
II. Реакции с участием бензольного кольца
1. Реакции замещения
Реакции замещения в бензольном кольце фенолов протекают легче, чем у бензола, и в более мягких условиях.
1) Галогенирование. 2C6H6OH + 2Cl2 = C6H5OHCl + C6H5OHCl (к разным атомам)
2) Нитрование. C6H6OH + 3HONO2 =H2SO4 конц= С6H3OH-(NO2)3 2,4,6-тринитрофенол
3) Сульфирование (c H2SO4). Соотношение о- и n-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t°= 100°С — пара-изомер.
2. Реакции присоединения. C6H6OH + 3H2 = Ni, 150C, P= C6H12OH циклогексанол
III. Качественные реакции на фенолы
В водных растворах одноатомные фенолы взаимодействуют с хлоридом железа (III) FeCl3 с образованием комплексных фенолятов, которые имеют фиолетовую окраску; окраска исчезает после прибавления сильной кислоты.
Способы получения
1. Из каменноугольной смолы.
Каменноугольную смолу, содержащую в качестве одного из компонентов фенол, обрабатывают вначале раствором щелочи (образуются феноляты), а затем — кислотой:
С6Н5ОН + NaOH = C6H5ONa + Н2О Фенолят натрия (промежуточный продукт)
C6H5ONa + H2SO4 = C6H5OH + NaHSO4
2. Сплавление солей аренсульфокислот со щелочью:
C6H6SO3Na + NAOH =300C= C6H6OH + Na2SO3
3. Взаимодействие галогенпроизводных ароматических УВ со щелочами:
C6H5Cl + NaOH =300C, P, Cu= C6H5OH + NaCl
C6H5Cl + HOH пар =450-500C, Al2O3= C6H5OH + NaCl
4. Кумольный способ. В качестве исходного сырья используют бензол и пропилен, из которых получают изопропилбензол (кумол), подвергающийся дальнейшим превращениям.
Строение молекулы.
Электронная формула молекулы: НИз четырёх электронных пар при азоте три общие и одна неподелённая.
..
:N: Н
..
Н
Имеет высокую t-ру кипения, t-ру плавления (благодаря водородным связям, образующимся между молекулами аммиака), легко сжижается, легко растворяется в воде:
NH3 + Н2О = NH3Н2О
Физические свойства.
Бесцветный газ с характерным резким запахом, почти в 2 раза легче воздуха. Раствор аммиака в воде называется аммиачной водой или нашатырным спиртом. При кипячении растворённый аммиак улетучивается из раствора.
Получение аммиака.
В прмышленности: Синтез – N2 + 3Н2 = 2NН3 + Q (Р, катализатор, t-оптимальная)
В лаборатории: 2NН4Cl т. + Ca(ОН)2 т. = CaCl2 + 2NН3 + 2Н2О (t-ра)
Химические свойства.
I.Реакции окисления: 4NН3 + 3О2 = 2N2 + 6Н2О (без катализатора)
4NН3 + 5О2 = NО + Н2О (катализатор)
II.Реакции присоединения: NН3 + Н2О = NН3Н2О = NН4+ + ОН-
NН3 + НCl = NН4 Cl
NН3 + Н+ = NН4+
III.Реакции комплексообразования: Cu(ОН)2 + 4NН3 = [Cu(NН3)4](ОН)2 – сильное основание
[Cu(NН3)4]2+ + 2ОН-
IV.Реакции замещения атома водорода в аммиаке: 2NН2Н + 2Na = 2Na[NH2] + H2
Амид натрия
NНН2 + Na = Na2[NH] + H2
Имид натрия
NН3 + 3Na = Na3N + 3H2
Нитрид натрия
Применение.
Большие количества расходуются для получения азотной кислоты. Жидкий аммиак и его растворы применяют как жидкие удобрения.
Принципы обучения химии.
Содержание курса химии опр-ся общими целями обучения, содержанием самой хим. науки, значением и местом данного учебного предмета в общей с-ме образования. Химия явл-ся предметом естеств-научн. цикла, её основная задача – форм-е научного мировоззрения. Принципы обучения – это основные дидактические положения как ко всей с-ме обучения, так и по отдельным учебным дисциплинам. Дидактические принципы определяют требования к содержанию, методам, средствам, орг. формам учебной работы в соотв. с общими целями и закон-стями процесса обучения. Выделют след. дидак. Принципы: научности и посильной трудности, сознательности и творч. актив-сти уч-ся при руководящей роли у-ля, наглядности обучения и развития теор. мышления, систематичности и прочности знаний, связи обучения с реальной жизнью, фор-ние положит. эмоций у уч-ся к обучению, коллективного хар-ра обучения и учета индивид. особ-стей уч-ся.
Выдел-ют след. принципы обучения химии: 1) принцип соответствия учебного мат-ла уровню современной науки. Этот принцип реализуется через: приближение содержания курса к уровню современ. науки; путем повышения системности курса; путем определения ведущей роли теории в курсе; путем определ-я оптим. соотнош-ния фактов и теории; 2) Принцип развития понятий. Совр. курс химии в школе построен с учетом принципов концентризма (по спиралеобр. х-ру). Любое хим. понятие проходит свое форм-е и развитие на разных уровнях теории строения в-ва; 3) Принцип разделения трудностей теории школьного курса, понятия изучаются на разных возр. уровнях. 4) Принцип историзма. Всё изучаемое в курсе химии должно рассматр-ся с точки зр. истор. событий. Стр-ра школьного курса опр-ся: четким выделением осн. теор. знаний, дидактич. обоснованной последоват-стью учебного мат-ла, оптимальностью содержания учебн. мат-ла для сознательного и системного усвоения умений и знаний.
Сходства.
1.Принадлежность к группе определяется mах числом валентных электронов.
Cr … 3d54s1
S … 3s23р4
2.Отсюда, исходные по составу соединения с mах степенью окисления: CrО3, SО3 – кислотные оксиды
Эти оксиды хорошо растворяются в воде. Это сходство объясняется тем, что атомы элементов главной и побочной подгруппы, в высшей степени окисления приобретают сходное электронное строение.
Различия.
1.Валентные электроны у атомов элементов главных подгрупп – на внешнем энергетическом уровне, а у атомов элементов побочных подгрупп – на внешнем и предвнешнем энергетических уровнях.
2.У атомов элементов главных подгрупп в периоде с увеличением заряда ядра, растёт число электронов на внешнем энергетическом уровне, а это приводит к быстрому переходу от типичных металлов к типичным неметаллам. У атомов элементов побочных подгрупп с увеличением заряда ядра число внешних электронов не увеличивается, поэтому свойства их изменяются менее резко.
3.У атомов элементов главных подгрупп устойчивость соединений, в которых элемент проявляет высшую степень окисления, с увеличением заряда ядра – уменьшается. У атомов элементов побочных подгрупп наоборот: с увеличением заряда ядра элемента в его высшую ст. ок. – повышается.
4.Радиусы атомов в главных подгруппах растут монотонно, с ростом числа энергетических уровней, а от этого зависит и энергия ионизации – уменьшается. В побочных подгруппах – радиус атомов сначала возрастает, Еи – увеличивается.
5.Для атомов элементов побочных подгрупп характерно комплексообразование за счёт d – орбиталей. Для атомов элементов главных подгрупп менее характерно комплексообразование.
6.Деление элементов на металлы и неметаллы в главных подгруппах идёт по числу вал. Электронов, а также по размеру атомов.
7.Атомы элементов в главных подгруппах могут как присоединять (немет.), так и отдавать (мет.), т.е могут находиться и вположительной , и в отрицательной степени окисления. Атомы элементов побочных подгрупп могут только отдавать и находяться только в положительной степени окисления.
ФЕРМЕНТЫ
Ферменты (энзимы, биол. катализаторы) – это в-ва белковой природы, которые образуются в тканях всех организмов и обладают способностью ускорять хим. процессы в организме.(«элексир жизни» - Павлов)
Впервые фермент в крист. сост. был получен Самерром. из бобов(уреаза) – 1926г.
В соостветсвии с международ. правилами, ферменты разбиты на 6 кл.:
1. оксиредуктазы – ф-ты катализирующие в/о р-ции.
2. трансферазы - ф-ты катализирующие р-ции переноса отдельных атомов или целых групп.
3. гидролазы – ф-ты ускоряющие реакции генетического расщепления с участием воды
4. лиазы – ф-ты катализирующие р-ции расщепления
5. изомеразы – участвующие в реакции изомеризации.
6. лигазы(синтетазы) – ф-ты которые ускоряют р-ции образования хим. связей с образованием АТФ
Классы делятся на подклассы®подподклассы®порядковый номер(шифр)
Номенклатура:
Название по международной ном-ре.
Тип хим. р-ции, кот. обеспечивает.
Х-р переносимых гр.
ОСОБЕННОСТИ ФЕРМЕНТОВ:
1.хар-ой особенностью ф-тов как биокатализаторов в том, что они обладают высочайшей биолог. активностью, повышают скорость в 106-1020 раз, по сравнению с обыкн. Kat).
2.специфичность действия
3.дей-е (акт-ть) можно регулировать.
Молекул. масса ф-тов: опр-ся молек. массой белков (белк. компанентов) колеблится от 15000 до неск. миллионов. Для ф-тов х-ны теже, физ-хим св-ва, что и для белков, входящих в их состав.
Все ф-ты явл. глобул. Белками, поэтому их мол. м.б. представлены как простыми, так и сложными. В 1-ом случае- однокомпанентный, во 2-ом- двукомпанентный.
Белков. часть наз. Е фермент или апоферментом. Небелковая часть- S-субстрат или кофакторат. Если кофактор- орг. мол., то она наз. коферментом, а в целом, мол. наз. холоферментом. В качестве неорг. кофакторов чаще всего входят ионы Ме. Если небел. часть ф-та прочно связана с белком и в биохим. реакциях не отсоединяется от него, то эту часть принято наз. простетической группой. Но для большинства Е соединение бел. и небелков. части могут осуществлятся за счет водор. связей, ион. вз-й, гидрофобных вз-й и очень редко за счет ковал. связи. Поэтому прочность связи между кофактором и белковой частью (апоферментом) вальирует в широких пределах. Небелк. компанент имеет сравнительно небол. молек. массу и в отличие от апофермента обладает термостабильностью.
СТРУКТУРА:
Т.к. размеры субстрата значительно меньше размера мол. Е, то субстрат не может контактировать со всей огромной мол. белка, а вз-ет с небол. его участком. Этот участок мол., кот. обеспечивает соединение Е и S и дает возможность для дальнейшего превращения S наз. акт. центром (а/ц) фермента. Т.е. а/ц Е принимает участие в связывании и превращении S. На долю центра приходится небол. часть белк. мол. А/ц образуется определ. радикалами а/к, кот. располаг-ся далеко др. от др. в полипептидной цепи, а у двухкомпанентов ферментов в а/ц входят некот. гр-ки Коэазима. У олигомерных ф-тов им. неск. акт. центров соотв-х кол-ву субъединиц. А/ц функционально неоднороден, в нем условно выд-ют: -каталитическую зону. Это гр-ки, кот. принимают непосредств. участие в контакте с S; -зону связывания.это гр-ки, кот. контакт-т с непревращаемыми фрагментами S и укрепляющие его в актив. центре. Наиболее часто в акт. центр Е входят:серин, гистидин, треопин, цистеин, глутаминовая к-та, аспаргиновая к-та. Эти к-ты располагаются далеко др. от др. и сближаются только при форм-нии акт. центра. А/ц расп-ся на поверхности ф-та, в углублениях.
КИНЕТИКА ФЕРМЕНТАТИВНЫХ Р-ЦИЙ:
Мех-зм:
Ур-ние Михаэлиса-Ментен:ур-ние, кот. выражает зав-сть скор-ти ферм. процесса от конц-ции субстрата.
V=Vmax×[S]  Km+[S] Km+[S] |
 Vmax полное насыщение Е S-ом, V=max, если все активн. Центры центры Е заняты и своб. молекулы Е отсутствуют, 100% 100% насыщение Е субстратом. При 50% насыщеном насыщенном Е субстратом, V=половине Vmax.
Vmax полное насыщение Е S-ом, V=max, если все активн. Центры центры Е заняты и своб. молекулы Е отсутствуют, 100% 100% насыщение Е субстратом. При 50% насыщеном насыщенном Е субстратом, V=половине Vmax.
Km-конц. S, при кот. достигается 50% насыщ. Е субстратом субстратом.
 |  |
Vmax=Vmax×[S]   2 Km+[S] ; 2[S]=Km+[S] ; Km=S. 2 Km+[S] ; 2[S]=Km+[S] ; Km=S. | Для того, чтобы определить Vmax и Km исп-ся график в двойных обратных коор-тах, т.е. в коорд. 1 = 1   V [S] ; y=ax+b V [S] ; y=ax+b |
Уровнение Лаинувера-Берка:
| 1 = Km . 1 + 1 V Vmax [S] Vmax |

Т.о. Þключевыми параметрами явл. Кm и Vmax отражающие мех-зм действия фермента.
Vmax определяет эффективность действия фериента, т.е. его каталитическую активность.
Km опр-т специфичность действия Е по отношению к данному S. Чем больше Km, тем меньше степень сродства Е и S и меньше V ферментативного процесса.
ЕДИНИЦЫ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ: Согласно мехдунар. правилам един-й акт-ти любого Е явл. то его кол-во, кот. катализирует превращение S со скоростью 1 моль в 1с –катал. 1Кат.=6×107 стандар. единица Е. 1 стандарт. единиц Е=16,97 нКат (10-9)
Существует удел. акт-ть, кот. выражает число единиц акт-ти Е, приходящей на 1мг белка. Кол-во мг моль S, превращаемых 1мг Е в 1 мин. Если известна молекул. масса фермента, то можно рассчитать молекуляр. (молярн.) акт-ть фермента. Е молек. акт-ти выражает число молей (или молекул) субстрата, превращ-х 1 молем (молекулой) Е за 1 мин. Между удельн. и молек. акт-тью сущ-ет связь:
  Емол.= Еуд × Мфермента ; Емол= Vmax n- кол-во молей фермента 1000 nE Емол.= Еуд × Мфермента ; Емол= Vmax n- кол-во молей фермента 1000 nE |
СВОЙСТВА ФЕРМЕНТОВ:
1.  Термолабильность (зависимость св-в акт-ти Е от tо):
Термолабильность (зависимость св-в акт-ти Е от tо):
2.Зависимость от рН, т.е. она им-ет вид:

3.Влияние ионной силы (конц. влияет на конц. Е):
4.Ферменты нах-ся в тканях и клетках в неактивн. форме, кот. наз. проферментом или зимогеном.
5.Специфичность: 1) абсолютная. В случае абсол. спец-ти фер-ты катализируют превращ. только субстрата.
2)относительная. Если один и тот же Е участвует в превращении неск. S- относит. спец-ть, т.е. такие Е действуют на опр-е типы хим. связи.
3)стериохимическая. Дей-т на строго опред-й стериоизомер.
АКТИВАТОРЫ И ИНГИБИТОРЫ ФЕРМЕНТОВ:
Акт-ры- это в-ва, кот. усиливают акт-ть фер-ов. Ингибиторы- тормозят. В качестве акт-ров чаще исп-ся ионы Ме, в частности Са2+, Со2+ и т.д. Они способствуют более ст
