Основные положения квантовой механики. Понятие атомной орбитали.
Основные положения квантовой механики. Понятие атомной орбитали.
Квантовая механика(волновая механика) – теория, устанавливающая способ описания и законы движения микрочастиц в заданных внешних полях. Носит вероятностный характер.1927
Гипотеза Планка состоит в том, что для элементарных частиц любая энергия поглощается или испускается только дискретными порциями(квантами).
Луи Де Бройль выдвинул идею двойственной природы вещества, опиравшуюся на то, что молекулярные частицы обладают свойствами как частицы, так и волны(корпускулярно-волновой дуализм).
Принцип Гейзенберга гласит, что нельзя с одновременной точностью определить координаты электрона и его скорость.
Уравне́ние Шрёдингера — уравнение, описывающее изменение в пространстве и во времени чистого состояния, задаваемого волновой функцией, в гамильтоновых квантовых системах.
Постулаты Бора:
1.электрон в атоме может находиться в определённых стационарных или квантовых состояниях,которых атом не излучает.
2.при переходе из одного стационарного состояния в другое,атом излучает или испускает квант света.
Атомная орбиталь- место, где наиболее вероятно нахождение электрона.
2) Какие характеристики орбиталей определяются значениями: а) главного квантового числа; б) орбитального квантового числа; в) магнитного квантового числа.
Квантовые числа — энергетические параметры, определяющие состояние электрона и
тип атомной орбитали, на которой он находится.
-Главное квaнтовое число n определяет общую энергию электрона в атоме и степень его удаления от ядра (номер энергетического уровня);
n = 1, 2, 3, . .
-Орбитальное квантовое число l определяет форму электронного облака.
l = 0, 1, 2, 3,..., n-1
l = 0 s-орбиталь,
l = 1 – р-орбиталь (3 типа, отличающихся магнитным квантовым числом m),
l = 2 – d-орбиталь (5 типов),
l = 3 – f-орбиталь (7 типов).
-Магнитное квантовое число m определяет ориентацию электронного облака в пространстве.
m=-l...0...l
-Спиновое квантовое число s =+1/2 ( -1/2) Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином.
Охарактеризуйте состояние электрона в атоме водорода системой квантовых чисел: главное, орбитальное, магнитное и спиновое. Какими способами можно описать 1s состояние электрона атома водорода?
n=1. L=(n-1)=0 m=0.s =1/2.Сферическая форма орбитали и эл.облака.(l=0 s-орбиталь)
Сформулируйте правила, которыми определяется порядок заполнения электронами орбиталей атома. Запишите электронную конфигурацию атомов железа.
правила заполнения электронной орбитали:
Принцип минимума энергии.
В многоэлектронном атоме электроны заполняют орбитали таким образом, чтобы их суммарная энергия была минимальна.
1s<2s<2p<3s<3p<4s=3d<4p<5s=4d<5p<6s=5d^1=4f^1-14=5d^2-10<6p.
Принцип Паули.
На одной орбитали могут находиться 2 электрона с антипараллельными спинами.
3.правило Хунда:
суммарный спин в пределах подслоя должен быть максимальным.
Fe
1s^2-2s^2-2p^6-3s^2-3p^6-4s^2-3d^6.
По какому признаку происходит деление на s-,p-,d-элементы?(и бла-бла-бла дальше, лень писать)
у s-элементов - заполняется s-подуровень внешнего уровня. L=o => орбитали и облака имеют сферическую форму
У p-элементов заполняется p-подуровень внешнего энергетического уровня.
У d-элементов заполняется d-подуровень предвнешнего (второго снаружи) энергетического уровня (= электронного слоя).
У f-элементов заполняется 3-й снаружи электронный слой
Определяются по внешнему электронному подуровню:
s-ns
P-nsnp
D-(n-1)dns
s: Li 1s^2 2s^2
p: B 1s^2 2s^2 2p^1
d: Ti 1s^2 2s^2 2p^6 3s^2 3p^6 3d^2 4s^2
6)Структура ПС Менделеева.
У каждого последующего элемента на один электрон больше, чем у предыдущего.
Современная периодическая система включает 109 химических элементов. В 1988 году был синтезирован 110 химический элемент. Из 109 химических элементов 89 обнаружены в природных объектов. Все остальные элементы синтезированы искусственно. Все элементы, которые располагаются после урана называются трансурановыми химическими элементами. Они синтезированы при помощи ядерных реакций.
Период- горизонтальный ряд элементов, заполнение электронных оболочек которых происходит в пределах одного квантового слоя.Малые периоды содержат один ряд химических элементов, Большие периоды содержат по два ряда химических элементов. Каждый период начинается со щелочного металла и заканчивается инертным газом.
Группа-вертикальный столбец, объединяющий элементы с одинаковым числом
валентных электронов.8 групп, что соответствует макс.числу электронов во внешних
подоболочках.Главные подгруппы: Li,Be,B,C,N,O,F и благород.газы. Побочные: d и f
элементы.
Типы химической связи
Ионная связь – образуется между атомами металлов и неметаллов, т.е. между атомами, резко отличающимися друг от друга по значениям электроотрицательности. (Например, NaCl, K2O, LiF)
Механизм образования связи.
Атом неметалла забирает наружные электроны у атома металла и превращается в анион (отрицательно заряженный ион). Атом металла теряет электроны и превращается в катион (положительно заряженный ион). Ионы связаны электростатическими силами. Происходит полная отдача (принятие) валентных электронов, перекрывание облаков отсутствует, обобществления электронов не наблюдается.
Ковалентная связь –это связь, образованная парой электронов, принадлежащей соседним атомам.
Ковалентная связь между атомами, обладающими равной ЭО – неполярная,
так как общие электронные пары в равной степени принадлежат обоим
взаимодействующим атомам. Ковалентная полярнаясвязь – связь между
атомами с разной ЭО, при этом общие электронные пары смещены в сторону
более электроотрицательного элемента.
Металлическая связь— связь между положительными ионами в кристаллах
металлов, осуществляемая за счет притяжения электронов, свободно
перемещающихся по кристаллу. Атомы, оставшиеся без внешних электронов, приобретают положительный заряд. Специфика металлической связи состоит в том, что в обобществлении электронов участвуют все атомы кристалла, и обобществленные электроны не локализуются вблизи своих атомов, а свободно перемещаются внутри решетки, т. е. они уже принадлежат не одному атому, как в случае ионной связи, и не паре соседних атомов, как в случаековалентной связи
, а всему кристаллу в целом. Не имея локализованных связей, металлические кристаллы ( в отличие от ионных) не разрушаются при изменении положения атомовАтом водорода, связанный с сильно электроотрицательным элементом (азотом, кислородом, фтором и др.), испытывает недостаток электронов и поэтому способен взаимодействовать с неподеленной парой электронов другого электроотрицательного атома этой же или другой молекулы. В результате возникает водородная связь, которая графически обозначается тремя точками.
Свойства ковалентной связи.
Понятие ковалентной связи.
Ковалентная связь –это связь, образованная парой электронов, принадлежащей соседним атомам.
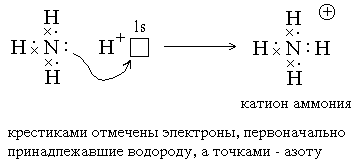
В молекуле аммиака четыре валентные орбитали атома азота (одна 2s и три 2p) находятся
в состоянии sp3-гибридизации. Три из них вовлечены в связи с атомами водорода
по ковалентному способу. Одна оставшаяся орбиталь заполнена парой собственных
электронов атома азота. Именно эта орбиталь с парой электронов и взаимодействует
с протоном, ядром атома водорода, не имеющим своих электронов.Таким образом,
атом азота в молекуле аммиака играет роль донора электронной пары, а протон – роль
акцептора.
Ковалентные связи могут образовываться за счет спаренных электронов, имеющихся на внешнем электронном слое атома. В этом случае второй атом должен иметь на внешнем слое свободную орбиталь. Например, образование иона аммония из молекулы аммиака и иона водорода можно отобразить схемой:
Понятие кислотного дождя.
Кисло́тный дождь — все виды метеорологических осадков — дождь, снег, град,туман,
дождь со снегом, при котором наблюдается понижение pH дождевых осадков из-
за загрязнений воздуха кислотными оксидами (обычно — оксидами серы, оксидами
азота) причины: современный уровень развития технологий очистки не позволяет
отфильтровывать соединения азота и серы, который возникают в результате сгорания
угля, торфа, других видов сырья, что используются в промышленности. В итоге такие
оксиды попадают в атмосферу, соединяются с водой в результате реакций под действием
солнечного света, и выпадают на землю в виде осадков, которые и называют «кислотные
дожди».источники-вулканы,лесн.пожары,сжигание угля и мазута, удобрения в с\х,
выхлопные газы автомобилей, металлургическое произв-во,ТЭЦ
Химическое равновесие
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Процесс называют обратимым, если он допускает возвращение рассматриваемой системы из конечного состояния в исходное через ту же последовательность промежуточных состояний, что и в прямом процессе, но проходимую в обратном порядке. Необратимые процессы могут протекать самопроизвольно только в одном направлении.
Константа ионизации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем легче электролит распадается на ионы, тем больше ионов в его растворе, тем сильнее электролит.
Для сильных оснований Kb>10^-2
для слабых Kb<10^-2
Основания имеют разную способность отщеплять гидроксогруппу. Сильные основания(NaOH, KOH, LiOH, Ba(OH)2,Ca(OH)2) в водных растворах способны легко отдавать свои гидроксогруппы,а слабые(Mg(OH)2, Fe(OH)2, Zn(OH)2)-нет.
Ионное произведение воды.
Константа автопротолиза:
H2O=(H+)+(OH-)
K=[H+]*[OH-]/[H2O]
Ионное произведение воды:
Kw=[H+]*[OH-]=10^-14
[H+]-концентрация ионов водорода
[OH-]-концентрация гидроксид-ионов
[H2O] = 55,6 моль/л-концентрация воды в ионной форме
Водородный показатель:
pH=-lg[H+]
отрицательный десятичный логарифм концентрации протонов в растворе
pH<7-кислая среда-лф(розовый),мо(красный),фф(бесцветный)
pH=7-нейтральная среда-лф(фиолет.),мо(оранж.),фф(бесцв.)
pH>7-щелочная среда-лф(синий),мо(жёлтый),фф(малиновый)
Образование какого продукта
В концентрированных растворах H2SO4 пассивируются на холоду Al, Cr, Fe, Co, Ni, Ti, Zr, Hf, Mo, W и др.
Не взаимодействуют с H2SO4: Pt, Au, Ru, Rh, Ir, и др.
Пассивируются в разбавленных растворах HNO3 (на холоду) Al, Mo, W и др. Не взаимодействуют: Pt, Au, Ru, Rh, Ir
Пассивируются в концентрированных растворах HNO3 (на холоду) Be, Al, Cr, Fe, Co, Ni, Ti, Zr, Hf, Pb, Bi но при нагревании ряд металлов начинает активно взаимодействовать с HNO3. Не взаимодействуют: Pt, Au, Ir, Ru, Rh, Nb, Ta.Разбавленная азотная кислота растворяет железо с выделением оксидов азота и нитрата железа (III).Концентрированная азотная кислота пассивирует такие металлы как хром,железо и алюминий, образуя на их поверхности защитную оксидную пленку.Пассивирование – процесс образования на поверхности металла защитных слоев,при действии окислителей для защитыот коррозии.2Fe +6H2SO4 =(t) Fe2(SO4)3 + 3SO2 ↑+3H2O 2Fe +8HNO3=(t)2Fe(NO3)3+2NO2↑+4H2O
По значениям E оцените активность меди и железа. Что произойдет с пластинкой при погружении ее в раствор сульфат меди(2)?В обосновании ответа приведите стандартные элктродные потенциалы соответствующих систем.
CuSO4 + Fe = FeSO4 + Cu.
Cu+2e=Cu E= -0,44
Fe+2e=Fe E= 0,34
При погружении железной пластинки в раствор сульфата меди (II) происходит выделение меди на поверхности пластинки с окислением железа и переходом его в раствор.
Порядок и молекулярность
Число молекул, участвующих в элементарном акте химического взаимодействия, называется молекулярностью реакции. По числу молекул, принимающих участие в элементарном акте химического превращения, различают реакции моно (одно), би (2) тримолекулярные реакции. Вероятность соударения одновременно большего числа частиц очень мала; поэтому тримолекулярные реакции очень редки, а 4х неизвестны.
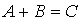 | 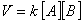 | 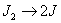 | |
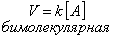 | 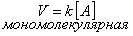 | ||
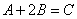 | |||
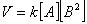 | тримолекулярная |
Сумма показателей степеней в кинетических уравнениях называется порядком реакции.Порядок реакции определяет характер зависимости V от С.В тех случаях, когда процесс многостадиен, запись уравнения реакции лишь фиксирует исходное и конечное состояние системы, не раскрывая механизма процесса.Если различие концентраций реагентов велико, то порядок реакции не совпадает с её молекулярностью.Существуют реакции нулевого порядка, например, разложение некоторых соединений на поверхности различных фаз.Общая скорость сложной химической реакции определяется скоростью ее наиболее медленной (лимитирующей) стадии.Реакции, протекающие в одну стадию, называют простыми (элементарными) реакциями, а реакции, включающие несколько стадий – сложными.
Цепные реакции

Проиллюстрируйте основные

Сущность электролиза заключается в том, что при пропускании тока через раствор электролита ( или рас плавленный электролит) положительно заряженные ионы перемещаются к катоду, а отрицательно заряжен ные - к аноду. Достигнув электродов, ионы разряжаются, в результате чего у электродов выделяются составные части растворенного электролита или водород и кислород из воды
Избирательный разряд ионов
Водный раствор любого электролита содержит анионы и катионы не одного, а двух или нескольких типов. Например, водный раствор хлорида калия содержит анионы двух типов, Cl- и ОН-, и катионы двух типов, K+ и H+ (точнее, H3O+).
Последовательность, в которой ионы разных типов разряжаются на электродах, определяется целым рядом факторов, в том числе химической природой электрода, состоянием электролита и электродным потенциалом каждого конкретного иона.
Первый закон Фарадея гласит, что масса вещества, образующегося на электроде, пропорциональна количеству пропущенного электричества.Количественной мерой электрического заряда является единица фарадей. Фарадей-это заряд, который несет на себе один моль электронов или один моль однозарядных ионов.
Влияние лиганда

Спектрохимический ряд лигандов (Р. Цусида)
Для предотвращения коррозии в качестве конструкционных материалов применяют нержавеющие стали, кортеновские стали, цветные металлы. При проектировании конструкции стараются максимально изолировать от попадания коррозионной среды, применяя клеи, герметики, резиновые прокладки.
Активные методы борьбы с коррозией направлены на изменение структуры двойного электрического слоя. Применяется наложение постоянного электрического поля с помощью источника постоянного тока, напряжение выбирается с целью повышения электродного потенциала защищаемого металла. Другой метод — использование жертвенного анода, более активного материала, который будет разрушаться, предохраняя защищаемое изделие.
Например, цинк имеет более отрицательный электронный потенциал, и первым корродирует, взаимодействует с кислородом, защищая железо (способ-цинкование)так же вместо цинка можно взять олово, хром, никель
3) В качестве защиты от коррозии может применяться нанесение какого-либо покрытия, которое препятствует образованию коррозионного элемента (пассивный метод).Различают холодное цинкование(полимерно- цинковая плёнка) Газотермическое напыление(газовой струей на поверхность изделия на огромной скорости наносят частицы металлической смеси) Термодиффузионное цинковое покрытие(взаимной диффузии железа и цинка)
Основные положения квантовой механики. Понятие атомной орбитали.
Квантовая механика(волновая механика) – теория, устанавливающая способ описания и законы движения микрочастиц в заданных внешних полях. Носит вероятностный характер.1927
Гипотеза Планка состоит в том, что для элементарных частиц любая энергия поглощается или испускается только дискретными порциями(квантами).
Луи Де Бройль выдвинул идею двойственной природы вещества, опиравшуюся на то, что молекулярные частицы обладают свойствами как частицы, так и волны(корпускулярно-волновой дуализм).
Принцип Гейзенберга гласит, что нельзя с одновременной точностью определить координаты электрона и его скорость.
Уравне́ние Шрёдингера — уравнение, описывающее изменение в пространстве и во времени чистого состояния, задаваемого волновой функцией, в гамильтоновых квантовых системах.
Постулаты Бора:
1.электрон в атоме может находиться в определённых стационарных или квантовых состояниях,которых атом не излучает.
2.при переходе из одного стационарного состояния в другое,атом излучает или испускает квант света.
Атомная орбиталь- место, где наиболее вероятно нахождение электрона.
2) Какие характеристики орбиталей определяются значениями: а) главного квантового числа; б) орбитального квантового числа; в) магнитного квантового числа.
Квантовые числа — энергетические параметры, определяющие состояние электрона и
тип атомной орбитали, на которой он находится.
-Главное квaнтовое число n определяет общую энергию электрона в атоме и степень его удаления от ядра (номер энергетического уровня);
n = 1, 2, 3, . .
-Орбитальное квантовое число l определяет форму электронного облака.
l = 0, 1, 2, 3,..., n-1
l = 0 s-орбиталь,
l = 1 – р-орбиталь (3 типа, отличающихся магнитным квантовым числом m),
l = 2 – d-орбиталь (5 типов),
l = 3 – f-орбиталь (7 типов).
-Магнитное квантовое число m определяет ориентацию электронного облака в пространстве.
m=-l...0...l
-Спиновое квантовое число s =+1/2 ( -1/2) Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином.
