Основные процессы извлечения металлов из руд.
1)Гидрометаллургические процессы-их проводят в водных растворах. Восстановление металлов осуществляют хим. восстановителями. CuSO4+Zn->Cu+ZnSO4.
2)Пирометаллургическое восстановление-это восстановление металлов из расплавов или твердой фазой хим. восстанов. при высоких температурах. FeO+CO2->Fe+CO2.
3)Электрогидрометаллургический - это восстановление металлов из расплавов электрическим током. CuSO4+2e ->Cu+SO4.
4)Электропирометаллургический метод -это восстановление металлов из сплавов электрических токов при высоких температурах.
49. К черным металлам относятся:
− железные металлы – железо, кобальт, никель, марганец;
− тугоплавкие металлы; имеют температуру плавления выше чем у железа, т.е. более 15390С
- титан, ванадий, хром, цирконий, ниобий, молибден, вольфрам, технеций, гафний, рений;
− урановые металлы (актиноиды) – торий, актиний, уран, нептуний, плутоний и др. (с 89 до 103 элемента);
− редкоземельные металлы (с 57 -71 элементы), лантан, церий, ниодим и д.р.;
− щелочноземельные металлы- литий, натрий, кальций, калий, рубидий, стронций, цезий, барий, франций, родий, скандий.
Основными современными способами выплавки стали являются: кислородно-конвертерный, мартеновский и электросталеплавильный способы производства (или плавления) стали. В основе всех этих способов лежит окислительный процесс, направленный на снижение в чугуне некоторых веществ.
Различаются следующие промышленные типы железных руд:
- Титано-магнетитовые и ильменит-титаномагнетитовые в базитах и ультрабазитах
- Апатит-магнетитовые в карбонатитах
- Магнетитовые и магно-магнетитовые в скарнах
- Магнетит-гематитовые в железных кварцитах
- Мартитовые и мартит-гидрогематитовые (богатые руды, образуются по железным кварцитам)
- Гётит-гидрогётитовые в корах выветривания.
50.Модель строения атома бора.Энергия электрона зависит от радиуса его орбиты. Минимальная энергия у электрона, который находится на ближайшей к ядру орбите. При поглощении кванта энергии электрон переходит на орбиту с более высокой энергией (возбужденное состояние). И наоборот, при переходе с высокого энергетического уровня на более низкий - электрон отдает (излучает) квант энергии.
Квантово-механическая модель атомаСовременная модель атома является развитием планетарной модели. Согласно этой модели, ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).Химические свойства атомов определяются конфигурацией электронной оболочки и описываются квантовой механикой. Положение атома в таблице Менделеева определяется электрическим зарядом его ядра (то есть количеством протонов), в то время как количество нейтронов принципиально не влияет на химические свойства; при этом нейтронов в ядре, как правило, больше, чем протонов. Если атом находится в нейтральном состоянии, то количество электронов в нём равно количеству протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра).Массу атома принято измерять в атомных единицах массы, равных 1⁄12 от массы атома стабильного изотопа углерода 12C.
Принцип неопределенности Гейзенберга.Гейзенберг сформулировал принцип неопределенности, в соответствии с которым координаты и импульс не могут одновременно принимать точные значения. Для предсказания положения и скорости частицы важно иметь возможность точно измерять ее положение и скорость.
математическое выражение которого называется соотношением неопределенностей Гейзенберга:Δx х Δv > h/m
где Δx — неопределенность (погрешность измерения) пространственной координаты микрочастицы, Δv — неопределенность скорости частицы, m — масса частицы, а h — постоянная Планка, которая равняется примерно 6,626 x 10–34 Дж·с,
Понятие о волновой функции.Волнова́я фу́нкция, или пси-функция  — комплекснозначная функция, используемая в квантовой механике для описания чистого состояния системы. Является коэффициентом разложения вектора состояния по базису (обычно координатному):
— комплекснозначная функция, используемая в квантовой механике для описания чистого состояния системы. Является коэффициентом разложения вектора состояния по базису (обычно координатному): 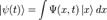
где - 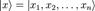 координатный базисный вектор, а
координатный базисный вектор, а 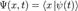 - волновая функция в координатном представлении.
- волновая функция в координатном представлении.
51.
Атомные Орбиталь – область пространства, где наиболее вероятно нахождение электрона.
Главное квантовое число (n) – характеризует энергетический уровень. Определяет энергию и размеры электронных орбиталей.
Орбитальное квантовое число (l) – определяет форму атомной орбитали. Характеризует энергетические подуровни в электронной оболочке атома. (s – 0; p – 1; d – 2; f – 3).
Магнитное квантовое число (m) – характеризует ориентацию орбитали в пространстве. (от –l до +l)
Спиновое квантовое число (s) – спин электрона. (+1/2 - ; -1/2 - ¯)
Строение многоэлектронных атомов.
52.Принцип минимальной энергии. Электроны в основном состоянии заполняют орбитали в порядке повышения уровня энергии орбиталей.
Принцип запрета Паули.В атоме не может быть двух электронов , обладающих одинаковым набором квантовых чисел.
Правило Хунда.Заполнение орбитали одной подоболочки в основном состоянии атома начинается одиночными электронами с одинаковыми спинами.
