Скоростью химической реакции называется ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ реагента или продукта в единицу времени.
Разницу между тем, что было и тем, что стало, часто обозначают буквой греческого алфавита D (дельта) Следовательно, только что приведенное определение математически можно выразить так:
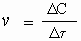 ,где v - скорость реакции, DC - изменение концентрации (в моль/л), а Dt - интервал времени, в течение которого это изменение произошло (сек). "моль/л.сек".
,где v - скорость реакции, DC - изменение концентрации (в моль/л), а Dt - интервал времени, в течение которого это изменение произошло (сек). "моль/л.сек".
При этом за ∆c можно брать изменение концентрации как одного из реагирующих в-в,так и одного из продуктов. Но т.к. скорость реакции,по самому смыслу этого понятия,должна иметь положит.величину,то в случае исходных в-в ∆с= 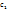 -
- 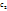 ,где
,где 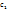 -концентрация в-ва в начальный момент времени
-концентрация в-ва в начальный момент времени 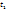 ,
, 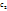 -концентрация в-ва в конечный момент времени
-концентрация в-ва в конечный момент времени 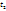 ,а в случае продуктов ∆с=
,а в случае продуктов ∆с= 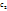 -
- 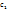 . На практике под скоростью хим. реакции обычно понимают именно среднюю скорость.
. На практике под скоростью хим. реакции обычно понимают именно среднюю скорость.
Наряду со средней скоростью пользуются истинной скоростью реакции, под которой понимают производную концентрации какого-либо участвующего в реакции в-ва по времени. Напр, для реакции aA+bB →dD+eE скорость в данный момент времени v= 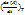 , где
, где 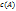 -мгновенная концентрация в-ва A. Индекс T означает, что процесс совершается при пост.температуре. Т.к. изменения концентрации в-в,участвующих в реакции, связаны стехиометрическим уравнением реакции, то скорость реакции можно выразить через изменение во времени концентрации любого из в-в - как исходных,так и конечных. Определенные таким образом скорости связаны между собой простым соотношением :
-мгновенная концентрация в-ва A. Индекс T означает, что процесс совершается при пост.температуре. Т.к. изменения концентрации в-в,участвующих в реакции, связаны стехиометрическим уравнением реакции, то скорость реакции можно выразить через изменение во времени концентрации любого из в-в - как исходных,так и конечных. Определенные таким образом скорости связаны между собой простым соотношением :
 |
|  | =
| =  |
| 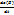 | =
| =  |
| 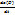 | =
| =  |
| 
Факторы, влияющие на скорость химических реакций.
1. Природа реагирующих в-в. Большую роль играет х-р хим- связей и строение м-л реагентов. Реакции протекают в направлении разрушения менее прочных связей и образования в-в с более прочными связями. Так, для разрыва связей в м-лах H2 и N2 требуются высокие энергии; такие м-лы мало реакционноспособны. Для разрыва связей в сильнополярных м-лах (HCl, H2O) требуется меньше энергии, и скорость реакции значительно выше. Реакции между ионами в р-рах электролитов протекают практич. мгновенно.
Пример.
Фтор с водородом реагирует со взрывом при комнатной t, бром с водородом взаимод. медленно и при нагревании.
2. Концентрация. С увеличением концентрации (числа частиц в единице объема) чаще происходят столкновения м-л реагирующих в-в - скорость реакции возрастает.
3. Температура. При повышении t на каждые 10°C скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа). При увеличении температуры от t1 до t2 изменение скорости реакции можно рассчитать по формуле:
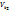 /
/ 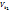 =
= 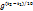
(где 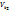 и
и 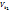 - скорости реакции при температурах
- скорости реакции при температурах 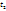 и
и 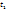 соответственно; g- температурный коэффициент данной реакции).
соответственно; g- температурный коэффициент данной реакции).
Правило Вант-Гоффа применимо только в узком интервале температур. Более точным является уравнение Аррениуса:
k = A • 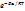
где
A - постоянная, зависящая от природы реагирующих веществ;
R - универсальная газовая постоянная [8,314 Дж/(моль • К) = 0,082 л • атм/(моль • К)];
Ea - энергия активации, т.е. энергия, которой должны обладать сталкивающиеся молекулы, чтобы столкновение привело к химическому превращению.
4. Пов-ть соприкосновения реагирующих в-в. Для гетерогенных систем (когда в-ва находятся в разн. агрегатных состояниях), чем больше пов-ть соприкосновения, тем быстрее протекает реакция. Пов-ть тверд.в-в м.б. увеличена путем их измельчения, а для растворимых веществ - путем их растворения.
5. Катализ. В-ва, кот- участвуют в реакциях и увеличивают ее скорость, оставаясь к концу реакции неизменными, назыв-катализаторами. Механизм действия катализаторов связан с уменьшением энергии активации реакции за счет образования промежуточных соединений. При гомогенном катализе реагенты и катализатор составляют одну фазу (находятся в одном агрегатном состоянии), при гетерогенном катализе - разные фазы (находятся в различных агрегатных состояниях). Резко замедлить протекание нежелательных хим. процессов в ряде случаев можно добавляя в реакционную среду ингибиторы (явл. "отрицательного катализа").
Активные молекулы – м-лы, в кот.энергия равна или больше энергии активации.
Для того чтобы м-лы могли прореагировать, они должны обладать запасом энергии,равным или большим некоторой величины , которая называется энергией активации ( 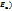 .
.
Вопрос №16.
Раствор – гомогенная (однородная) смесь, образованная не менее чем двумя компонентами, один из кот.назыв. растворителем, а другой – растворимым в-вом, это также система переменного состава, находящаяся в состоянии хим. равновесия.
Растворитель – компонент, агрегатное состояние кот.не изменяется при образовании р-ра. В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрд. в-ва с твёрдым,растворителем считается компонент, кол-во кот. в р-ре преобладает.
Растворенное в-во - компонент жидк. или тверд.р-ра, кот. присутствует в меньшем или незначит. кол-ве.
Р-ры делятся на истинные и коллоидные.
В истинных р-рах (часто называемых просто р-рами) частицы растворенных в-в невидимы ни визуально, ни с помощью оптич. микроскопа. Частицы относит.свободно передвигаются в среде растворителя. В кач-ве растворенных в-в в истин. р-рах могут содержаться неэлектролиты (глюкоза) в виде мол-л и электролиты(хлорид натрия) в виде ионов.
Суспензии – дисперсные системы, в кот. дисперсной фазой явл. тверд. в-во,равномерно распределенное в виде мельчайших частиц в жидкой дисперсионной среде во взвешенном состоянии,причем тверд. в-во практич. нерастворимо в жидкости. Чем мельче частицы,тем дольше сохраняется суспензия. Суспензии относятся к грубодисперсным системам. Пример суспензии – взболтанная глина в воде: со временем частицы выпадут на дно сосуда под действием сил тяжести. В природных условиях образование суспензий происходит при размывании почв и грунтов водой, загрязнении водоемов атмосферной пылью.суспензии широко используют в строительной технологии,в пр-ве керамики,пластмасс,лакокрасочных материалов, бумаги и др. Чтобы приготовить суспензию , надо в-во измельчить до тонкого порошка,высыпать в жидкость , в кот. в-во не растворяется и хорошо взболтать. Чем меньше частички,тем дольше будет сохраняться суспензия.
Эмульсии– дисперсные системы, в которых дисперсные фаза и среда явл. взаимно не смешивающимися жидкостями (иначе – это неоднородная система, состоящая из капель жидкости,распределенных между м-лами др. жидкости). Напр.,из воды и масла можно приготовить эмульсию длительн. встряхиванием. Примером эмульсии также явл. молоко,в кот. мелкие шарики жира распределены в жидкости.
Суспензии и эмульсии – двухфазные системы.
Р-ры подразделяются на:
· Молекулярные –водн. р-ры неэлектролитов – органич. в-в(спирт,глюкоза)
· Молекулярно-ионные – р-ры слаб. электролитов(азотистой,сероводородн. кис-т)
· Ионные – р-ры сильн. электролитов(щелочей,солей,кис-т-NaOH, 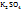 , HN
, HN 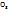 )
)
Р-ры бывают концентрирован. и разбавлен.. Из практич. опыта известно, что растворимость многих в-в небезгранична и зависит от t.
Насыщенным называется такой р-р , в кот. при данной t в-во больше не растворяется.
В ненасыщен. р-ре содержится меньше в-ва, а в пересыщен.– больше,чем в насыщенном.
В работе с в-вами важно знать их растворимость в воде. В-во считается хорошо растворимым,если при комнатной температуре в 100 г растворяется 1 г этого в-ва; если меньше, то в-во считается малорастворимым;при растворимости менее 0,001 г – нерастворимым.
Растворимость –св-во вещ-ва раствориться в воде или др. растворителе.
Хим. теория образования р-ров Д.И.Менделеева, по кот.между растворителем и растворенным вещ-вом происходят хим. взаимодействия (хим. реакции) с образованием особой группы вещ-в: сольватов, гидратов и кристаллогидратов.
В рез-те хим. взаимодействия растворен. вещ-ва с растворителем образуются соединения,кот назыв.сольватамиилигидратами, если растворителем явл. вода. Образование таких соединений роднит р-ры с хим. соединениями.
Концентрация р-ра –содержание растворенного вещ-ва в опред. массовом или объемном кол-ве р-ра или растворителя.
Массов.доля растворен.вещ-ва:Ѡ=(mв-ва/m р-ра)*100% mр-ра=ƿ*V (г)
Молярн.концентрация(молярность):СМ=δ/V (моль/л) δ=m/M (моль)CM=m/(M*V) (моль/л)
Норм.концентрация(нормальность):СН=δ/V (экв/л) СН=m/(Э*V) (экв/л) δ=m/Э
Насыщен.р-р –р-р,кот.нах-ся в динамич.равновесии с избытком растворяемого вещ-ва.
Пересыщенный р-р — р-р, содержащий больше растворённого вещ-ва, чем в насыщенном р-ре, избыток вещ-ва легко выпадает в осадок.
Как правило, растворимость тверд.вещ-в в оде с повышением t возрастает. Но имеются и вещ-ва,растворимость кот.при увеличении t понижается. Давление влияет на коэф-т растворимости тверд. тела незначит-но,т.к. при растворении не происходит заметного изменения объема системы. Выделение вещ-ва из раствора при охлаждении – кристаллизация.
При растворении газов в воде выделяется теплота. Поэтому в соответствии с принципом Ле-Шателье при повышении tрастворимость газа уменьшается. Растворимость газа от давления определяется з-ном Генри: при пост. t растворимость газа пропорц. его порциональному давлению. Для газов,взаимод. с растворителем,а также при высоких давлениях наблюдаются большие отклонения от з-на Генри.
