Типы производных карбоновых кислот и методы их синтеза
Карбоновые кислоты проявляют высокую реакционную способность. Они вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные, т.е. соединения, полученные в результате реакций по карбоксильной группе.

Образование солей происходит при действии на карбоновые кислоты:а) активных металлов
2RCOOH + Mg à (RCOO)2Mg + H2↑
б) аммиака
RCOOH + NH3 à RCOONH4
в) основных оксидов
2RCOOH + CuOà (RCOO)2Cu + H2O
г) гидроксидов металлов и аммония
RCOOH + NaOHàRCOONa + H2O
д) солей более слабых кислот
2RCOOH + Na2CO3à 2RCOONa + H2O + CO2
Названия солей составляют из названий остатка RCOO– (карбоксилат-иона) и металла. Например, CH3COONa – ацетат натрия, (HCOO)2Ca – формиат кальция, C17H35COOK – стеарат калия и т.п.
Более сильные кислоты способны вытеснять карбоновые кислоты из их солей:
CH3COONa + HClàCH3COOH + NaCl
2. Образование сложных эфировR–COOR':

Реакция образования сложного эфира из кислоты и спирта называется реакцией этерификации
Сложные эфиры карбоновых кислот – соединения с общей формулой R–COOR',где R и R' – углеводородные радикалы.
Амиды – функциональные производные карбоновых кислот, в которых гидроксил –ОН в карбоксильной группе –СООН замещен на аминогруппу –NH2.
Общая формула амидов R-СОNН2.
Пример: амид уксусной кислоты (ацетамид) CH3-СОNН2

Амиды образуются при взаимодействии кислот с аммиаком и нагревании образовавшейся аммонийной соли:

Вместо карбоновых кислот для получения амидов чаще используют их галогенангидриды:

Реакции гидролиза карбоновых кислот
Гидролиз нитрилов.
Нитрилы подвергаются гидролизу как в кислой, так и в щелочной среде, например:
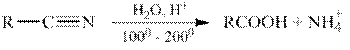
Гидролиз функциональных производных карбоновых кислот (ацилгалогенидов, ангидридов, сложных эфиров, амидов и т.д.).
Все функциональные производные карбоновых кислот при гидролизе в кислой или щелочной среде образуют карбоновые кислоты или их соли.
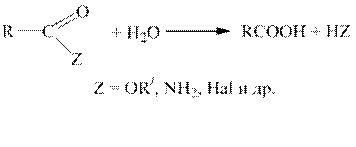
Гидролиз тригалогенопроизводных.
Тригалогенопроизводныегидролизуются в соответствующие карбоновые кислоты.

Жиры
Жиры – сложные эфиры глицерина и высших одноосновных карбоновых кислот
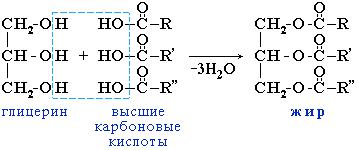
Общее название таких соединений – триглицериды или триацилглицерины, где ацил – остаток карбоновой кислоты -C(O)R.
В состав природных триглицеридов входят остатки насыщенных (предельных) кислот (пальмитиновой C15H31COOH, стеариновой C17H35COOH и др.) и ненасыщенных (непредельных) кислот (олеиновой C17H33COOH, линолевойC17H31COOH, линоленовой C15H29COOH и др.).
Природные кислоты, образующие молекулы жира, имеют неразветвленное строение и содержат четное число углеродных атомов (от 4 до 24). В ненасыщенных кислотах присутствуют связи С=С в цис-форме. Эти особенности строения жиров обусловлены процессами биосинтеза.
Жиры содержатся во всех растениях и животных. Они представляют собой смеси полных сложных эфиров глицерина и не имеют чётко выраженной температуры плавления.
· Физические свойства жиров
При комнатной температуре жиры (смеси триглицеридов) – твердые, мазеобразные или жидкие вещества. Как любая смесь веществ, они не имеют четкой температуры плавления (т.е. плавятся в некотором диапазоне температур). Определенной температурой плавления характеризуются лишь индивидуальные триглицериды.
Консистенция жиров зависит от их состава:
в твердых жирах преобладают триглицериды с остатками насыщенных кислот, имеющие относительно высокие температуры плавления;
для жидких жиров (масел), напротив, характерно высокое содержание триглицеридов ненасыщенных кислот с низкими температурами плавления.
Причиной снижения температуры плавления триглицеридов с остатками ненасыщенных кислот является наличие в них двойных связей с цис-конфигурацией. Это приводит к существенному изгибу углеродной цепи, нарушающему упорядоченную (параллельную) укладку длинноцепных радикалов кислот.
Сравним пространственное строение ненасыщенной и насыщенной и кислот с равным числом углеродных атомов в цепи: олеиновой C17H33COOH и стеариновой C17H35COOH.
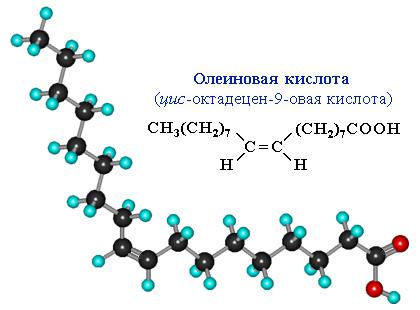
На молекулярной модели олеиновой кислоты виден изгиб цепи по связи С=С, препятствующий плотной упаковке молекул.
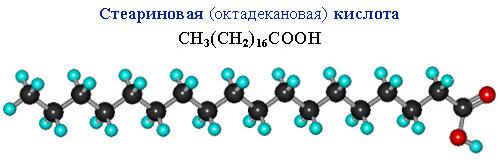
В углеродной цепи стеариновой кислоты отсутствуют изгибы, поэтому ее молекулы способны к плотной параллельной укладке.
Чем плотнее упаковка молекул вещества, тем выше температуры его фазовых переходов (т.плав., т.кип.). Соответственно, температура плавления тристеарата глицерина (71 oC) существенно больше, чем у триолеата (–17 oC).
Жиры практически не растворимы в воде, но при добавлении мыла или других поверхностно-активных веществ (эмульгаторов), они способны образовывать стойкие водные эмульсии. Жиры ограниченно растворимы в спирте и хорошо растворимы во многих неполярных и малополярных растворителях – эфире, бензоле, хлороформе, бензине.
Животные жиры (бараний, свиной, говяжий и т.п.), как правило, являются твердыми веществами с невысокой температурой плавления (исключение – рыбий жир). В твёрдых жирах преобладают остатки насыщенных кислот.
Растительные жиры – масла (подсолнечное, соевое, хлопковое и др.) – жидкости (исключение – кокосовое масло, масло какао-бобов). Масла содержат в основном остатки ненасыщенных (непредельных) кислот.
Жидкие жиры превращают в твердые путем реакции гидрогенизации (каталитического гидрирования). При этом водород присоединяется по двойной связи, содержащейся в углеводородном радикале молекул масел.
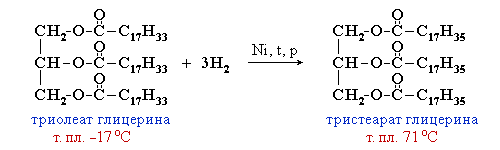
Натриевые соли – твердые мыла, калиевые – жидкие. Реакция щелочного гидролиза жиров, и вообще всех сложных эфиров, называется также омылением.
Высшие карбоновые кислоты можно выделить из мыла действием более сильных кислот.
При длительномхранениии жиры портятся (прогоркают). Под действием воздуха, света и микроорганизмов происходит частичный гидролиз жиров с образованием свободных жирных кислот и продуктов их превращения, обычно имеющих неприятный запах и вкус. Срок годности жиров увеличивается при низкой темературе и в присутствии консервантов (чаще всего поваренной соли).
Жиры, содержащие остатки ненасыщенных кислот, способны к окислению по связям С=С. Важное значение имеют так называемые высыхающие масла (льняное, тунговое и др.), которые входят в состав красок и лаков (в частности, олифы). Эти масла отличаются высоким содержанием остатков кислот с двумя или тремя двойными связями и способны к образованию на окрашиваемой поверхности прочной пленки за счет полимеризации по кратным связям под действием кислорода воздуха.
Альдегиды и кетоны
