Понятия – субстрат, реагент, реакционный центр, продукт реакции, энергия активации, скорость реакции, механизм.
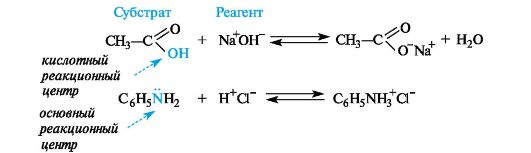
Субстрат -химическое вещество, подвергающееся превращению под действием фермента.
Реагент -это вещества, которые принимают участие в химической реакции, но при этом сами не являются объектом обработки.
реакционный центр -атом, у которого происходит разрыв или образование связей.
Продукт реакции– образующиеся в ходе реакции вещество.
Энергия активации -минимальное количество энергии, которое требуется сообщить системе (выражается в джоулях на моль), чтобы произошла реакция.
Скорость реакции -изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства.
Механизм реакции -это детальное описание всех стадий химического процесса.
7. Типы реагентов: радикальные, кислотные, основные, электрофильные, нуклеофильные. Способы разрыва ковалентной связи в органических соединениях и образующиеся при этом частицы: свободные радикалы (гомолитический разрыв), карбкатионы и карбанионы (гетеролитический разрыв). Электронное и пространственное строение этих частиц и факторы, обусловливающие их относительную устойчивость.
Типы реагентов:
Радикальные реагенты(радикалы) - свободные атомы или частицы с неспаренным электроном. Примеры радикальных реагентов: гидроксильные НОˑ, гидропероксильные HOOˑ, алкильные Rˑ радикалы, атомы галогенов Сˑ, Brˑ.
Электрофильные реагенты(электрофилы) - частицы, образующие новую ковалентную связь за счет электронной пары реакционного партнера. Электрофильные частицы обозначаются символом Е+ или Е. Они могут нести положительный заряд - протон Н+, карбокатионы R3C+, ацилий-катионы R-C=O - или быть электронейтральными, например триоксид серы SO3.
Кислотные реагенты(кислоты) - полностью или частично ионизированные в водных растворах нейтральные молекулы (CH3COOH, HCl) либо положительно заряженные частицы (катионы аммония NH4+, гидроксония H3O+), способные быть донором протона для реакционного партнера.
Нуклеофильные реагенты(нуклеофилы) - частицы, образующие новую ковалентную связь с реакционным партнером, предоставляя для этого свою электронную пару. Нуклеофильные частицы обозначаются символами Nu или Nu и могут быть отрицательно заряженными - гидрид-ион Н-, гидроксид-ион НО- , алкоксид-ион RO- , карбанион R3C- , хлорид-ион Cl- или быть электронейтральными. В этом случае их нуклеофильность обусловлена р- или π-электронами (NH3, H2O, CH2=CH2, C6H6).
Термин «нуклеофил» применяется к частице, реагирующей с любым электрофильным реакционным партнером за исключением протона Н+.
Основные реагенты(основания) - отрицательно заряженные частицы (НО-, RO-) или нейтральные молекулы (NH3, H2O), способные оторвать протон от кислотного реакционного центра. Основные реагенты обозначаются символами B- или B.
В соответствии с характером разрыва связи в субстрате и природой реагента различают реакции радикальные и ионные.
В радикальных, или гомолитических, реакциях(символ R) участвуют радикальные реагенты и происходит гомолитический разрыв ковалентной связи в субстрате. При гомолитическом, или свободнорадикальном, разрыве ковалентной связи (гомолизе)у каждого из ранее связанных атомов остается по одному электрону. В результате в качестве промежуточных частиц образуются радикальные реагенты, как показано ниже для молекулы X-Y (где X и Y обозначают ковалентно связанные атомы или группы атомов).
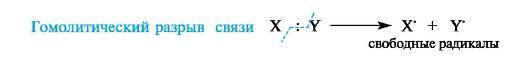
Ионные(гетеролитические) реакциисопровождаются гетеролитическим разрывом связи в субстрате. При таком разрыве (гетеролизе) ковалентной связи электронная пара, связывающая атомы, остается с одним из партнеров по связи. При этом образуются электрофильная и нуклеофильная частицы.
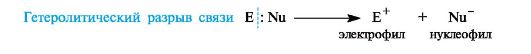
В качестве промежуточных частиц в гетеролитических реакциях принимают участие карбокатионы R3C+ и карбанионы R3C-.
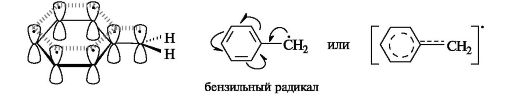
Свободные радикалы.Входящий в состав свободнорадикальных частиц атом углерода с неспаренным электроном находится в состоянии sр2-гибридизации и три его валентные связи лежат в одной плоскости. Неспаренный электрон занимает негибридизованную р-АО, расположенную перпендикулярно плоскости σ-связей (рис. 6).
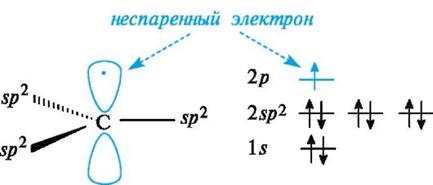
Рис. 6.Распределение электронов по орбиталям в свободном радикале
Высокая реакционная способность свободных радикалов объясняется их стремлением достроить внешний электронный уровень до устойчивого октета. Алкильные радикалы - короткоживущие частицы. Их относительная устойчивость соответствует ряду: третичный > вторичный > первичный.

Это связывают с энергией разрыва соответствующей связи С-Н, которая составляет 414 кДж/моль в этане, 396 кДж/моль для группы в пропане и 376 кДж/моль для группы СН в 2-метилпропане.
Стабильность свободных радикалов существенно возрастает, когда имеется возможность делокализации неспаренного электрона за счет участия π-электронов соседней двойной связи или бензольного кольца. Для систем с открытой цепью сопряжения наиболее типичным примером является аллильный радикал, а для систем с ароматическим циклом - бензильный радикал (одноэлектронные смещения обозначены стрелкой с одним острием).
8. Классификация органических реакций по результату (замещения, присоединения, элиминирования, перегруппировки, окислительно-восстановительные) и по механизму – радикальные, ионные (электрофильные, нуклеофильные), согласованные.
По направлению (конечному результату) органические реакции делят на несколько основных типов:
В случае реакций замещения в молекуле один атом (или группа атомов) замещается другим атомом (или группой атомов), в результате чего образуются новые соединения:
СН3–СН3 + С12 → СН3–СН2С1 + НC1
При протекании реакций присоединенияиз двух (или нескольких) молекул образуется одно новое вещество:
CH2 = CH2 + HBr → CH2Br–СH3
В результате реакции отщепления (элиминирования) образуется новое органическое вещество, содержащее кратную связь:
СН3–СН2С1 + NaOH(спиртовой р-р) → СН2 = СН2 + NaC1 + Н2О
Реакции разложения приводят к образованию из одного вещества двух или более веществ более простого строения:
НСООН → СО2 + Н2
окислительно-восстановительные реакции. Процесс окисления включает переход электронов от органического субстрата к реагенту-окислителю, а процесс восстановления - передачу электронов от реагента к органическому субстрату. В органической химии более распространен иной подход к трактовке реакций окисления и восстановления. Под окислением понимают введение атома кислорода в молекулу субстрата или удаление двух атомов водорода, как, например, в следующих рядах:
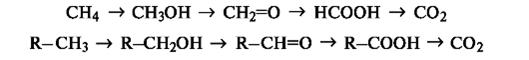
При таком подходе восстановление представляет собой обратный процесс, т.е. удаление атома кислорода или введение двух атомов водорода:
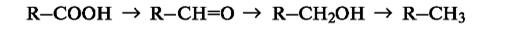
В окислительно-восстановительных реакциях органических соединений, безусловно, меняется степень окисления атома углерода, являющегося реакционным центром. Учет изменения степени окисления, однако, может потребоваться только при необходимости расстановки коэффициентов в уравнении реакции. В то же время многие процессы, протекающие с изменением степени окисления атома углерода, такие, как дегидрирование (-СН2СН2-→ -СН=СН-) или галогенирование (-СН3- →СН2О), классифицируются не как реакции окисления.
Реакция перегруппировки (молекулярная перегруппировка) — химическая реакция, в результате которых происходит изменение взаимного расположения атомов в молекуле, места кратных связей и их кратности; могут осуществляться с сохранением атомного состава молекулы (изомеризация) или с его изменением.
Классификация органических реакций по механизму:
В радикальных реакциях реагент имеет неспаренный электрон и является свободным радикалом (Cl , R и др.). В ходе радикальных реакций связь в субстрате разрывается гомолитически, а новая связь образуется за счет неспаренного электрона свободного радикала и одного из электронов старой связи. Примером радикальных реакций может служить радикальное замещение (символ SR) в алканах:
R-H + Cl• → R• + HCl
R• + Cl-Cl → R-Cl + Cl•
В ионных реакциях происходит гетеролитический разрыв связей в субстрате под действием электрофильного или нуклеофильного реагентов.
В нуклеофильных реакциях реагент (нуклеофил) имеет на одном из атомовсвободную пару электронов и является нейтральной молекулой или анионом (Hal-, OH-, RO-, RS-, RCOO-, R-, CN-, H2O, ROH, NH3, RNH2 и др.). Все нуклеофилы – основания Льюиса. Нуклеофил атакует в субстрате атом с наименьшей электронной плотностью (т.е. с частичным или полным положительным зарядом). При этом новая связь образуется за счет электронной пары нуклеофила, а старая претерпевает гетеролитический разрыв. Примером нуклеофильной реакции может служить нуклеофильное замещение (символ SN) у насыщенного атома углерода:
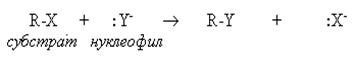
В электрофильных реакциях атакующий реагент (электрофил) имеет вакантную орбиталь и является нейтральной молекулой или катионом (Cl2, SO3, BF3, H+, Br+, R+, NO2+, и др.). Все электрофилы – кислоты Льюиса. Электрофил атакует в субстрате атом с наибольшей электронной плотностью, причем старая связь претерпевает гетеролитический распад, а образование новой связи происходит за счет пары электронов субстрата. Пример электрофильной реакции – электрофильное присоединение (символ AdE) к С=С связи:
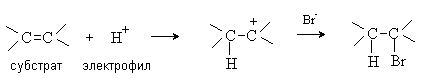
В согласованных реакциях разрыв старых и образование новых связей происходит одновременно.

Кислотность и основность органических соединений: теория Бренстеда. Классификация кислот и оснований Бренстеда. Общие закономерности в изменении кислотных и основных свойств во взаимосвязи с электронными эффектами заместителей.
См. лекцию № 4.
10. Основные правила составления названий по номенклатуре ИЮПАК для органических соединений; заместительная и радикально-функциональная номенклатура. Родоначальная структура, заместители, характеристические группы.
В настоящее время общепринята систематическая номенклатура ИЮПАК (IUPAC - Международный союз теоретической и прикладной химии).
Для использования систематической номенклатуры ИЮПАК необходимо знать содержание следующих номенклатурных терминов:
• органический радикал;
• родоначальная структура;
• характеристическая группа;
• заместитель;
• локант.
Органический радикал- остаток молекулы, из которой удаляются один или несколько атомов водорода и при этом остаются свободными одна или несколько валентностей.
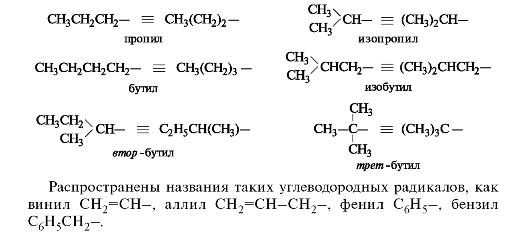
Углеводородные радикалы алифатического ряда имеют общее название - алкилы (в общих формулах обозначаются R), радикалы ароматического ряда - арилы (Ar). Два первых представителя алканов - метан и этан - образуют одновалентные радикалы метил СН3- и этил СН3СН2-. Названия одновалентных радикалов обычно образуются при замене суффикса -ан суффиксом -ил.
Атом углерода, связанный только с одним атомом углерода (т. е. концевой), называют первичным, с двумя - вторичным, с тремя - третичным, с четырьмя - четвертичным.
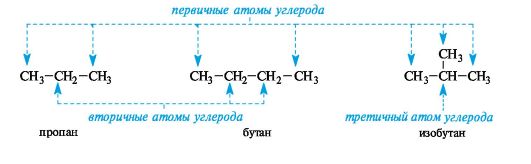
Каждый последующий гомолог из-за неравноценности атомов углерода образует несколько радикалов. При удалении атома водорода от концевого атома углерода пропана получают радикал н-пропил (нормальный пропил), а от вторичного атома углерода - радикал изопропил. Бутан и изобутан каждый образуют по два радикала. Буква н-(которую разрешается опускать) перед названием радикала указывает, что свободная валентность находится на конце неразветвленной цепи. Префикс втор- (вторичный) означает, что свободная валентность находится у вторичного атома углерода, а префикс трет- (третичный) - у третичного.
Родоначальная структура- химическая структура, составляющая основу называемого соединения. В ациклических соединениях в качестве родоначальной структуры рассматривается главная цепь атомов углерода, в карбоциклических и гетероциклических соединениях - цикл.
Характеристическая группа- функциональная группа, связанная с родоначальной структурой или частично входящая в ее состав.
Заместитель- любой атом или группа атомов, замещающие в органическом соединении атом водорода.
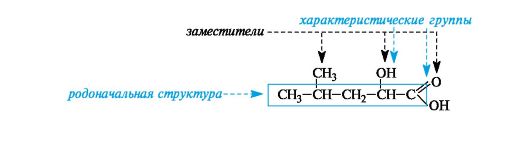
Локант(от лат. locus - место) цифра или буква, указывающая положение заместителя или кратной связи.
Наиболее широко применяются два вида номенклатуры: заместительная и радикально-функциональная.
Заместительная номенклатура
Общая конструкция названия по заместительной номенклатуре представлена на схеме 1.
