Аллотропные формы углерода. Чем они отличаются?
Углерод — вещество с самым большим числом аллотропических модификаций (более 8 уже обнаружены).
Аллотропные модификации углерода по своим свойствам наиболее радикально отличаются друг от друга, от мягкого к твёрдому, непрозрачного к прозрачному, абразивного к смазочному, недорогого к дорогому. Эти аллотропы включают аморфные аллотропы углерода (уголь, сажа), нанопена, кристаллические аллотропы — нанотрубка, алмаз, фуллерены, графит, лонсдейлит и церафит.
Классификация
Чаоит — минерал, который, как считают, сформирован под воздействием ударов метеоритов. Он описывается как несколько более твёрдый, чем графит, с отблеском от серого до белого цвета. Тем не менее, существование такого состояния углерода считается спорным.
Металлический углерод — теоретические исследования показали, что в фазовой диаграмме углерода в области очень высоких давлений есть области, где он металлический [1] Также показано, что в этих условиях углерод может стать сверхпроводящим при очень низкой температуре (4 кельвина) [2].
Диуглерод — метастабильные частицы С2
Желе́зо — элемент побочной подгруппы 8 группы IIII периода ПС с атомным номером 26. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
Соединения железа (II)
Оксид железа(II) FeO обладает основными свойствами, ему отвечает основание Fe(OH)2. Соли железа (II) обладают светло-зелёным цветом. При их хранении, особенно во влажном воздухе, они коричневеют за счёт окисления до железа (III). Такой же процесс протекает при хранении водных растворов солей железа(II):
4FeCl2 + O2 + 2H2O → 4Fe(OH)Cl2.
Из солей железа(II) в водных растворах устойчива соль Мора — двойной сульфат аммония и железа(II) (NH4)2Fe(SO4)2·6Н2O.
Реактивом на ионы Fe2+ в растворе может служить гексацианоферрат(III) калия K3[Fe(CN)6] (красная кровяная соль). При взаимодействии ионов Fe2+ и [Fe(CN)6]3− выпадает осадок турнбулевой сини:
3K3[Fe(CN)6] + 3Fe2+ → 3KFeII[FeIII(CN)6]↓ + 6K+.
Для колчиественного определения железа (II) в растворе используют фенантролин Phen, образующий с железом (II) красный комплекс FePhen3 (максимум светопоглощения — 520 нм) в широком диапазоне рН (4-9)
102) 1 В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.
Моль - это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро
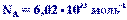 Рассмотрим разложение воды на водород
Рассмотрим разложение воды на водород 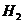 и кислород
и кислород 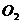 . Эту реакцию можно записать в виде:
. Эту реакцию можно записать в виде:
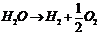 . Здесь общее число молей продуктов разложения
. Здесь общее число молей продуктов разложения 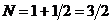 ; мольная доля водорода
; мольная доля водорода
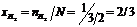 , мольная доля кислорода
, мольная доля кислорода 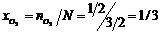 .
.
103)
Если водородная связь объединяет части одной молекулы, то говорят о внутримолекулярной водородной связи.
Если же водородная связь образуется между атомом водорода одной молекулы и атомом неметалла другой молекулы, то это межмолекулярная водородная связь.
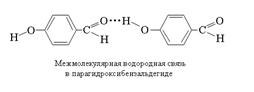
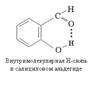
104)
Термодинамическая система - совокупность объектов, взаимосвязь между которыми выше, чем с объектами внешней среды.
3 типа т/д систем:
1. Открытые системы способны обмениваться с окружающими телами веществом и энергией.
2. Закрытые системы обмениваются с внешней средой только энергией. Движение вещества в них невохможно.
3. Изолированные системы не обмениваются с внешней средой ни веществом, ни энергией. Она является идеализированной системой.
Состояние системы характеризуется следующими т/д параметрами:
1. Внутренней энергией (U(E))
2. Энтальпией (H)
3. Энтропией (S)
4. Энергией Гиббса (G)
5. Давлением (P)
6. Температурой (T)
7. Объемом (V)
Если P=const, то такая система называется изобарической.
Если T=const, то - изотерической.
Если V=const, то - изохорной.
) Скорость химической реакции — это есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций).Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1.
Истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени.
Средняя скорость – изменения концентрации вещества за данный промежуток времени. В различных интервалах времени средняя скорость химической реакции имеет разные значения.
Факторы, влияющие на скорость химической реакции:
1) Природа реагирующих веществ (характер связи в молекулах реагентов);
2) Концентрация реагентов;
3) Температура;
4) Катализатор;
5) Давление (для газов);
6) Излучение (ИК-, УФ-, рентгеновское, радиоактивное и др.);
7) Площадь поверхности раздела фаз
106).
БУФЕРНЫЕ РАСТВОРЫ – растворы, концентрация ионов водорода (рН) которых не изменяется от прибавления ограниченных количеств сильной кислоты или щелочи (см. водородный показатель). Б.р. состоят из смеси раствора слабой кислоты и ее соли сильного основания или, наоборот, — слабого основания и его соли сильной кислоты.
Для определения пределов действия Б.р. вводится понятие буферная емкость, измеряемая количеством сильной кислоты или основания (в г-экв), которое надо добавить к 1 л Б.р., чтобы сместить рН на единицу.
Максимальная буферная емкость соответствует содержанию компонентов в эквивалентных количествах. В маломинерализованных природных водах буферность в основном создается карбонатами, т.е. свободной угольной кислотой и ее солями сильных оснований (Ca, Mg, Na).
Существует два основных механизма поддержания pH:
1)Химические буферные системы крови и тканей.
2) Физиологические буферные системы.
Выделяют 4 наиболее важных буфера, которые играют ведущую роль в механизмах регуляции pH:
- Гидрокарбонатный (карбонатный) буфер
- Гемоглобиновый
-Белковый (протеиновый)
-Фосфатный буфер - 5%
Работу буфера можно рассмотреть на примере гидрокарбонатного буфера, который состоит из сопряженной кислотно-основной пары:
· молекула слабой угольной кислоты (донатор протона);
· бикарбонат-ион HCO3 (акцептор протона).
Для определения значения pH растворов широко используют несколько методик. Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
1. Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы — органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах — либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1—2 единицы.
2. Для расширения рабочего интервала измерения pH используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислой области в щелочную. Определения pH индикаторным методом затруднено для мутных или окрашенных растворов.
3. Использование специального прибора — pH-метра — позволяет измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем с помощью индикаторов. Ионометрический метод определения pH основывается на измерении милливольтметром-ионометром ЭДС гальванической цепи, включающей специальный стеклянный электрод, потенциал которого зависит от концентрации ионов H+ в окружающем растворе. Способ отличается удобством и высокой точностью, особенно после калибровки индикаторного электрода в избранном диапазоне рН, позволяет измерять pH непрозрачных и цветных растворов и потому широко используется.
4. Аналитический объёмный метод — кислотно-основное титрование — также даёт точные результаты определения кислотности растворов. Раствор известной концентрации (титрант) по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакции. Точка эквивалентности — момент, когда титранта точно хватает, чтобы полностью завершить реакцию, — фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется кислотность раствора.
107.В случае электрохимич.процессов протек. С участием воду электродные потенциалы зависят от рН раствора и имеют тем большую величину,чем кислеер-р.
MnO‾+8H++5e= Mn 2++4 H2O
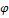 =
= 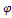 0+0,059/5Lg [MnO4-][H+]8 /[Mn 2+]
0+0,059/5Lg [MnO4-][H+]8 /[Mn 2+]
2).O2+4 H+ + 4e=2H2O
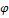 =
= 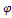 0+0,059Lg[H+]+ 0.059/H lg po2
0+0,059Lg[H+]+ 0.059/H lg po2
108.k2[HgI4]=2K++[HgI4]2- 1диссоц
Вторичная диссоц:
[HgI4]2-=Hg2++4I-
Кнест= [Hg2+][I-]4 / [HgI4]2-
Kуст= [K+]2[HgI4]2- / K2[HgI4]
109 Кремниевые кислоты, производные кремниевого ангидрида SiO2; очень слабые кислоты, мало растворимые в воде. В чистом виде были получены метакремниевая кислота H2SiO3 (точнее её полимерная форма H8Si4O12) и H2Si2O5. Аморфная двуокись кремния (аморфный кремнезём) в водном растворе (растворимость около 100 мг в 1 л) образует преимущественно ортокремниевую кислоту H4SiO4. В полученных разными способами пересыщенных растворах К. к. изменяются с формированием коллоидных частиц (молярная масса до 1500), на поверхности которых находятся группы OH. Образованный т. о. золь в зависимости от водородного показателя pH может быть устойчивым (pH около 2) или может агрегировать, переходя в гель (pH 5—6). Устойчивые высококонцентрированные золи К. к., содержащие специальные вещества — стабилизаторы, применяют при производстве бумаги, в текстильной промышленности, для очистки воды.
Силаны (кремневодороды, гидриды кремния) — соединения кремния с водородом общей формулы SinH2n+2.
Физические свойства
По физическим свойствам силаны сходны с углеводородами. Моносилан SiH4 и дисилан Si2Н6 являются бесцветными газами с неприятным запахом, трисилан Si3Н8 — бесцветная, ядовитая, летучая жидкость. Высшие члены гомологического ряда — твёрдые вещества. Силаны растворяются в этаноле, бензине, органосиланах, CS2. Силаны, бораны и алканы имеют одинаковые формулы, но разные свойства.
Свойства
Силаны воспламеняются на воздухе, Si2Н6 взрывается при контакте с воздухом. Наиболее термически устойчивым является моносилан (энергия связи Si—H 364 кДж/моль)
Силаны чрезвычайно легко окисляются. Моносилан в присутствии кислорода окисляется со вспышкой даже при температуре жидкого воздуха. В зависимости от условий реакции, продуктом окисления является либо SiO2, либо промежут. в-ва:
SiH4(г) + 2O2 → SiO2 + 2H2O ΔHo298 = −1357 кДж
Силаны являются хорошими восстановителями, они переводят КМnО4 в MnO2, Hg(II) в Hg(I), Fe(III) в Fe(II) и т. д. Силаны устойчивы в нейтральной и кислой средах, но легко гидролизуются даже в присутствии малейших следов ОН−-ионов:
SiH4 + 4ОН− → SiO44− + 4Н2↑
SiH4 + 2Н2О → SiO2 + 4Н2↑
SiH4 + 2NaOH + Н2О → Na2SiO3 + 4Н2↑
Реакция протекает количественно и может использоваться для количественного определения силана. Под действием щелочи возможно также расщепление связи Si—Si:
H3Si—SiH2—SiH3 + 6H2O → 3SiO2 + 10H2
С галогенами силаны реагируют со взрывом, при низких температурaх образуются галогениды кремния. Моносилан разлагается при давлении более 50 атм.
Получение
Силаны обычно получают, разлагая кислотами силициды металлов (например, силицид магния):
Mg2Si + 4H+ → 2Mg2+ + SiH4↑
Для синтеза моносилана используют разложение триэтоксисилана в присутствии Na, и нагревании (t=80 °C):
4SiH(OC2H5)3 → SiH4↑ + 3Si(OC2H5)4
либо применяют реакцию:
Li[AlH4] + SiCl4 → SiH4↑ + LiCl↓ + AlCl3
Отличия от углеводородов
Поскольку связи Si—Si и Si—H слабее связей C—C и C—H, силаны отличаются от углеводородов меньшей устойчивостью и повышенной реакционноспособностью. Плотность, температуры кипения и плавления силанов выше, чем у соответствующих углеводородов.
Применяют в различных реакциях органического синтеза (получение ценных кремнийорганических полимеров и др.), как источник чистого кремния для микроэлектронной промышленности. Моносилан широко используется в микроэлектронике и получает все большее применение при изготовлении кристаллических и тонкопленочных фотопреобразователей на основе кремния, ЖК-экранов, подложек и технологических слоев интегральных схем. В основном моносилан производится для дальнейшего получения сверхчистого поликремния, ввиду того, что этот метод себя зарекомендовал как наиболее экономически целесообразный. Также силаны используют для связи между органической матрицей и неорганическим наполнителем (диоксидом кремния) в композиционных стоматологических материалах.
