Предмет и задачи химической кинетики. Кинетическое уравнение. Молекулярность реакции. Порядок реакции.
Скорость химической реакции. Факторы, влияющие на скорость реакции.
Закон действующих масс. Константа скорости реакции.
Зависимость скорости реакции от температуры. Эмпирическое правило Вант-Гоффа. Теория активных молекул.
Катализ. Катализаторы. Ингибиторы. Теория промежуточных соединений.
Катализ— избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий.
Катализатор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции[1]. Количество катализатора, в отличие от реагентов, после реакции не изменяется. Важно понимать, что катализатор не участвует в реакции. Они обеспечивают более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно повторяется. Ингибитор – это вещ. В присутствие которого скорость реакции уменьшается Автокатализ Так называется катализ реакции каким-либо из ее продуктов. Реакция вначале протекает медленно, но по мере образования продуктов она начинает ускоряться. Одним из наиболее широко известных примеров автокатализа является окисление щавелевой кислоты манганатом(VII) калия:
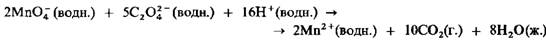
Эта реакция катализируется ионами Mn2+. При комнатной температуре она протекает вначале очень медленно. Однако по мере образования ионов Mn2+ реакция постепенно ускоряется. В лабораторных условиях это очень легко проверить, добавляя в реакционную смесь некоторое количество ионов Mn2+ в виде раствора сульфата марганца(Н). Если это сделать с самого начала, реакция будет сразу же протекать с заметной скоростью.
Теория промежуточных соединений для объяснения действия катализаторов В 1889 г. Аррениус выдвинул предположение, согласно которому действие катализатора заключается в том, что он образует промежуточное соединение (интермедиат). Можно представить себе, что катализатор (С) вступает в реакцию с реагентом, называемым субстратом (S), в результате чего образуется промежуточное соединение CS. Затем это промежуточное соединение разлагается, образуя продукт P и прежний катализатор С:
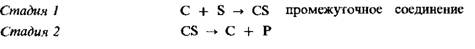
Таким образом, катализатор расходуется на первой стадии и регенерирует на второй стадии. Теория промежуточного соединения может быть также применена и к реакциям, в которых участвуют два реагента:
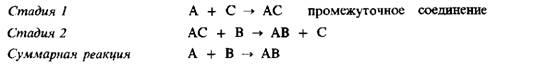
Необратимая и обратимая реакции. Химическое равновесие. Константа равновесия. Принцип Ле-Шателье. Примеры.
Необратимые реакции: реакции которые протекают до конца до ионного израсходования одного из реагентов и образует продукты уходящие из сферы реакции в виде осадка, газа , монодиссоциирующего вещ. С большим выдилением теплоты
Обратимые реакции: реакции которые одновременно протекают в двух взаимно противоположных направлениях
Хим.равновесие: это такое состояние реагирующего вещ. При котором скорость прямой реакции равно скорости обратной реакции
Константа равновесия: при установление равновесия произведение концентрации продуктов реакции делимое на произведение концентрации исходного вещ. Величина постоянная
Принцип Ле-Шателье: внешнее воздействие на систему нах. В состояние равновесия приводит к смещению этого равновесия в направление ослабления этого воздействия
1) Влияние концентрации:
Влияние концентрации на состояние равновесия подчиняется следующим правилам:
- При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
- При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
2)Влияние давления: при увиличение давления равновесие смещается в сторону уменьшения числа молекулы газообразных вещ. При уменьшение давления равновесие смещается в сторону возрастания числа молекул газообр. Вещ. , если реакция протекает без изменения числа молекул, то давление не влияет на положение равновесия в этой системе.
N2 + 3H2 ↔ 2NH3
Значит, при повышении давления равновесие смещается в сторону образования NH3, о чём свидетельствуют следующие данные для реакции синтеза аммиака при 400 °C:
| давление, МПа | 0,1 | |||||
| объемная доля NH3, % | 0,4 |
3)влияние температуры: при повышение темп. Равновесие смещается в сторону эндотермической реакции, при понижение темпр. В сторону экзотермической реакции.
4) Влияние инертных газов Введение в реакционную смесь или образование в ходе реакции инертных газов действует так же, как и понижение давления, поскольку понижается парциальное давление реагирующих веществ. Следует отметить, что в данном случае в качестве инертного газа рассматривается газ, не участвующий в реакции. В системах с уменьшением количества молей газов инертные газы смещают равновесие в сторону исходных веществ, поэтому в производственных процессах, в которых могут образовываться или накапливаться инертные газы, требуется периодическая продувка газоводов.
22. Гомогенная, гетерогенная, изолированная, системы. Первый закон термодинамики.
Гомогенная система — однородная система, химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно, без скачков (между частями системы нет поверхностей раздела). В гомогенной системе из двух и более химических компонентов каждый компонент распределен в массе другого в виде молекул, атомов, ионов. Составные части гомогенной системы нельзя отделить друг от друга механическим путем.
В гомогенных смесях составные части нельзя обнаружить ни визуально, ни с помощью оптических приборов, поскольку вещества находятся в раздробленном состоянии на микроуровне. Гомогенными смесями являются смеси любых газов и истинные растворы, а также смеси некоторых жидкостей и твердых веществ, например сплавы.
Примеры
- жидкие или твердые растворы (растворы — гомогенные (однородные) системы, т.е. каждый из компонентов распределен в массе другого в виде молекул, атомов или ионов)[1].
- лед
- смесь газов
Гетерогенная система— неоднородная система, состоящая из однородных частей (фаз), разделенных поверхностью раздела. Однородные части (фазы) могут отличаться друг от друга по составу и свойствам. Число веществ (компонентов), термодинамических фаз и степеней свободы связаны правилом фаз. Примерами гетерогенных систем могут служить: жидкость — насыщенный пар; насыщенный раствор с осадком; многие сплавы. Твердый катализатор в токе газа или жидкости тоже гетерогенная система (гетерогенный катализ). В технике гетерогенной системой является кирпичная и каменная кладка, состоящая из кладочных элементов (кирпича, природных или искусственных камней, бетонных блоков и др.) и строительного раствора.
Изолированная система (замкнутая cистема) — термодинамическая система, которая не обменивается с окружающей средой ни веществом, ни энергией. В термодинамике постулируется (как результат обобщения опыта), что изолированная система постепенно приходит в состояние термодинамического равновесия, из которого самопроизвольно выйти не может (нулевое начало термодинамики).
Адиабатически изолированнаясистема — термодинамическая система, которая не обменивается с окружающей средой энергией в форме теплоты. Изменение внутренней энергии такой системы равно производимой над ней работе. Всякий процесс в адиабатически изолированной системе называется адиабатическим процессом.
На практике относительная адиабатическая изоляция достигается заключением системы в адиабатическую оболочку (например, сосуд Дьюара). Реальный процесс может также считаться адиабатическим, если он протекает достаточно быстро, так, что за короткое время теплообмен с окружающими телами пренебрежимо мал.
23. Термохимия. Термохимические уравнения. Стандартная теплота образования.
Термохимия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами. Ещё одной из задач термохимии является измерение теплоёмкостей веществ и установление их теплот фазовых переходов.
Термохимические уравнения реакций - это уравнения, в которых около символов химических соединений указываются агрегатные состояния этих соединений или кристаллографическая модификация и в правой части уравнения указываются численные значения тепловых эффектов
Важнейшей величиной в термохимии является стандартная теплота образования (стандартная энтальпия образования). Стандартной теплотой (энтальпией) образования сложного вещества называется тепловой эффект (изменение стандартной энтальпии) реакции образования одного моля этого вещества из простых веществ в стандартном состоянии. Стандартная энтальпия образования простых веществ в этом случае принята равной нулю.
В термохимических уравнениях необходимо указывать агрегатные состояния веществ с помощью буквенных индексов, а тепловой эффект реакции (ΔН) записывать отдельно, через запятую. Например, термохимическое уравнение
4NH3(г) + 3O2(г) → 2N2(г) + 6H2O(ж), ΔН=-1531 кДж
показывает, что данная химическая реакция сопровождается выделением 1531 кДж теплоты, при давлении 101 кПа, и относится к тому числу молей каждого из веществ, которое соответствует стехиометрическому коэффициенту в уравнении реакции.
В термохимии также используют уравнения, в которых тепловой эффект относят к одному молю образовавшегося вещества, применяя в случае необходимости дробные коэффициенты.
