Ионно-обменные реакции в растворах
Если смешать разбавленные растворы двух электролитов АВ и СД, то раствор будет содержать все четыре возможных иона А и В, С и Д. При химическом взаимодействии растворов реакция протекает не между молекулами, а между ионами. При столкновении их образуются новые вещества:
АВ + СД = АД + СВ,
что можно выразить ионным уравнением
А+ + В – + С+ + Д – = А+ + Д – + В – + С+
В итоге установится равновесное состояние. Положение равновесия в подобной системе зависит от свойств образующихся веществ. Главную роль при этом играет вероятность возникновения того или иного из них, определяемая числом столкновений между соответствующими ионами.
Все ионные реакции могут быть обратимыми. Необратимыми они окажутся лишь в случае, если их продукты уходят из сферы реакции. Для равновесия ионных реакций можно сформулировать следующее положение: равновесие ионных реакций смещается в сторону образования менее диссоциированных веществ либо при удалении какого-либо вещества из «сферы реакции».
Уменьшение концентрации ионов может произойти в результате:
а) образования малорастворимого вещества:
AgNO3 + NaCl = AgCl↓ + NaNO3 (молекулярное уравнение)
Ag+ + NO3 – + Na+ + Cl – = AgCl↓ + Na+ + NO3 – (полное ионное уравнение).
Исключив ионы, не взаимодействующие между собой, получаем сокращенное ионное уравнение
Ag+ + Cl – = AgCl↓;
б) образования газообразного вещества, уходящего из раствора:
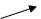 CO2↑
CO2↑
 Na2CO3 + H2SO4 = Na2SO4 + H2CO3
Na2CO3 + H2SO4 = Na2SO4 + H2CO3
H2O
2Na+ + CO32 – + 2H+ + SO42 – = 2Na+ + SO42 – + H2O + CO2↑
CO32 – + 2H+ = H2O + CO2↑
в) образования растворимого, но малодиссоциированного вещества, например, воды, слабой кислоты или слабого основания:
NaOH + HCl = NaCl + H2O
Na+ + OH – + H+ + Cl – = Na+ + Cl – + H2O
OH – + H+ = H2O
CH3COONa + H2SO4 = Na2SO4 + CH3COOH
CH3COO – + Na+ = 2Na+ + SO42 – + CH3COOH
CH3COO – + H+ = CH3COOH;
г) образования из нескольких простых ионов сложного комплексного иона:
HgI2 + 2KI = K2[HgI4]
Hg2+ + 2I – + 2K+ + 2I – = 2K+ + [HgI4]2 –
Hg2+ + 4I – = [HgI4]2 –
Произведение растворимости
Абсолютно нерастворимых веществ нет. Твердые вещества отличаются своей растворимостью. Очевидно, что труднорастворимый электролит легко образует насыщенный раствор. Рассмотрим равновесия, наблюдаемые в насыщенном растворе какого-нибудь труднорастворимого вещества, например, CaSO4. В этой системе осадок находится в равновесии с насыщенным раствором этого вещества:
СaSO4  Ca2+ + SO42–
Ca2+ + SO42–
осадок раствор
Константа равновесия для процесса растворения осадка имеет следующий вид:
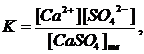
откуда K∙[CaSO4]тв = [Ca2+]∙[SO42-].
Концентрация твердого вещества есть величина постоянная:
[CaSO4]тв = const.
Учитывая это, K∙[CaSO4]тв как произведение двух постоянных величин также можно считать величиной постоянной, некоторой константой, характерной для данного вещества. Эту константу называют произведением растворимости. Её обозначают через ПР:
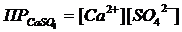 .
.
Для насыщенного раствора сульфата кальция произведение растворимости при 25оС найдено равным 3,72∙10-5 г-ион2/л2.
Таким образом, ПР – это произведение концентраций ионов малорастворимого сильного электролита, содержащихся в свободном виде в его насыщенном растворе. Величина ПР означает, что в насыщенном растворе труднорастворимого электролита произведение концентраций его ионов есть величина постоянная (при данной температуре).
Произведение растворимости характеризует растворимость электролитов. Растворимость численно равна 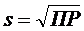 (для бинарных электролитов).
(для бинарных электролитов).
В общем случае для труднорастворимого электролита состава AnBm в растворе наблюдается равновесие:
AnBm = nAa++ mBb–.
Тогда
ПР = [Aa+]n [Вb–]m
Сравнивая значения произведений растворимости труднорастворимых солей, можно видеть, какая из них растворяется лучше (приложение, табл. 3).
Из величины ПР вытекает условие образования и растворения осадка:
1. Если [Aa+]n [Вb–]m = ПР, то осадок находится в равновесии с раствором.
2. Если [Aa+]n [Вb–]m > ПР, то осадок выпадает.
3. Если [Aa+]n [Вb–]m < ПР, то осадок растворяется.
Таким образом, если при той или иной химической реакции произведение концентраций участвующих в ней ионов станет больше произведения растворимости, то выпадает осадок труднорастворимого вещества. И обратно, если произведение концентраций ионов данного электролита в насыщенном его растворе в результате той или иной реакции становится меньше произведения растворимости для ионов этого электролита, то осадок переходит в раствор.
