Стехиометрические законы химии
Раздел химии, в котором рассматриваются количественный состав веществ и количественные соотношения (массовые или объёмные) между реагирующими веществами, называется стехиометрией. Расчёты количественных соотношений между элементами в соединениях или между реагирующими веществами называются стехиометрическими расчётами. В их основе лежат стехиометрические законы, такие как закон постоянства состава, закон сохранения массы веществ, закон Авогадро и другие.
Закон постоянства состава утверждает, что соотношение между массами элементов, входящих в состав данного соединения, постоянно и не зависит от способа получения этого соединения. Следует заметить, что для веществ с молекулярной структурой данный закон выполняется всегда. Однако, для ряда соединений (соединения переменного состава), которые имеют не молекулярную, а атомную структуру, этот закон часто не выполняется.
Согласно закону сохранения массы, установленному М.В. Ломоносовым, масса веществ, вступающих в реакцию, равна массе веществ, образующихся после реакции.
Важнейшими количественными параметрами, которые используются в стехиометрических расчётах, являются масса атома (атомная масса) и масса молекулы (молекулярная масса). В связи с неудобством выражения атомных и молекулярных масс в граммах и других единицах измерения, используемых при изучении объектов макромира, в химии и физике была принята шкала относительных атомных масс. В этой шкале единицей измерения является атомная единица массы (а.е.м.). Атомная единица массы представляет собой 1/12 массы атома изотопа углерода 12С. В соответствии с этим относительной атомной массой Ar элемента называют отношение массы атома этого элемента к 1/12 массы атома 12С. Масса молекулы, выраженная в атомных единицах массы, называется относительной молекулярной массой Mr. Так как масса молекулы любого вещества равна сумме масс атомов, образующих эту молекулу, то относительная молекулярная масса равна сумме соответствующих относительных атомных масс.
Строго говоря, для веществ с немолекулярной структурой понятие «молекулярная масса» не вполне логично, поскольку не всегда корректно говорить, например, о молекуле NaCl. В таких случаях термин «молекулярная масса» иногда заменяют понятием «формульная масса». Вместе с тем, термин «молекулярная масса» очень часто применяют и для веществ с немолекулярной структурой, условно предполагая существование соответствующих молекул.
Одним из важнейших химических понятий, на котором основываются стехиометрические расчёты, является количество вещества. Количество некоторого вещества X обозначается n(X). Основной единицей измерения количества вещества является моль.
Моль – это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода 12C.
Выражая количество вещества в молях, необходимо в каждом конкретном случае точно указывать, какие именно структурные единицы имеются в виду. Выражение «1 моль водорода» является неточным; более точно следует сказать: «1 моль молекул водорода», или «1 моль атомов водорода», или «1 моль ионов водорода». Использующиеся высказывания типа «1 моль серной кислоты» допустимы, если однозначно подразумеваются структурные единицы: серная кислота – сложное вещество с молекулярной структурой и в данном случае однозначно подразумевается 1 моль молекул серной кислоты.
Из определения понятия «моль» следует, что в 1 моле любого вещества содержится одно и то же число структурных единиц (атомов, молекул, ионов). Это число называется числом Авогадро (Na); для практических расчётов его принимают приблизительно равным 6,02·1023 моль–1. Умножая число Авогадро Na на количество вещества n можно рассчитать число молекул N, содержащихся в любом количестве вещества. Для некоторого вещества X число молекул N(X) можно рассчитать по формуле
N(X) = Na · n(X) . (3.1)
Масса одного моля некоторого вещества Х называется молярной массой M(X) этого вещества. Зная молярную массу некоторого вещества X, можно рассчитать количество этого вещества по формуле
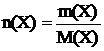
, (3.2)
где m(X) – масса вещества X.
Молярная масса имеет размерность г/моль.
Важно понимать, что молярная масса данного вещества численно равна относительной молекулярной массе этого вещества. Однако относительная молекулярная масса Mr характеризует массу микрочастицы – молекулы – и измеряется в атомных единицах массы, в то время как молярная масса M – это характеристика макроскопической величины – массы 1 моля вещества.
Согласно закону Авогадро в равных объёмах любых газов, взятых при одной и той же температуре и одинаковом давлении, содержится одно и то же число молекул. С другой стороны, 1 моль любого вещества по определению содержит одинаковое число частиц. Следовательно, 1 моль любого газа в одних и тех же условиях занимает один и тот же объём. По аналогии с понятием молярной массы можно ввести понятие молярного объёма. Молярный объём Vm(X) некоторого вещества X – это объём одного моля этого вещества. Зная объём вещества V(X) и его молярный объём, можно рассчитать количество вещества по формуле
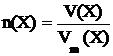
. (3.3)
1 моль любого газообразного вещества при нормальных условиях (температура 0°С и давление 1 атмосфера) занимает объём, равный 22,4 л. Таким образом, при нормальных условиях Vm(газа) = 22,4 л/моль.
Знание молярных масс веществ и числа Авогадро позволяет, в случае необходимости, выразить массу молекулы любого вещества в граммах. Ниже приводится пример расчёта массы молекулы водорода.
1 моль водорода содержит 6,02·1023 молекул H2 и имеет массу 2 г (т.к. M(H2) = 2 г/моль). Следовательно,
6,02·1023 молекул H2 имеют массу 2 г;
1 молекула H2 имеет массу x г; x = 3,32·10–24 г .
Понятие «моль» широко используется для проведения расчётов по уравнениям химических реакций, поскольку в любом уравнении химической реакции стехиометрические коэффициенты показывают, в каких молярных соотношениях вещества реагируют друг с другом и образуются в результате реакции. Например, уравнение реакции 4 NH3 + 3 O2 ® 2 N2 + 6 H2O содержит следующую информацию: 4 моль аммиака реагируют без избытка и недостатка с 3 моль кислорода, при этом образуется 2 моль азота и 6 моль воды. Таким образом, в любом уравнении химической реакции реагирующие и образующиеся вещества связаны чёткими молярными соотношениями. Это и позволяет проводить расчёты по уравнениям реакций: если известно число моль одного прореагировавшего или образовавшегося вещества, то из уравнения реакции можно получить информацию о количестве любого другого вещества, вступившего в реакцию или образовавшегося в результате её протекания.
Л Е К Ц И Я 4
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
Введение
Одна из наиболее широко распространённых классификаций химических реакций относит большинство реакций к одному из следующих типов:
– реакции соединения (синтеза);
– реакции разложения;
– реакции замещения;
– реакции ионного обмена.
Реакции соединения – это реакции, в которых из двух или нескольких более простых веществ получается одно более сложное вещество:
2 H2 + O2 ® 2 H2O; C2H4 + Cl2 ® C2H4Cl2 .
Реакции разложения представляют собой процессы, в которых из одного более сложного вещества образуется несколько более простых веществ:
(CuOH)2CO3 ® 2 CuO + CO2 + H2O; 2 Cu(NO3)2 ® 2 CuO + 4 NO2 + O2 .
Частным случаем реакций разложения можно также считать реакции электролитической диссоциации: Al2(SO4)3 ® 2 Al3+ + 3 SO42–.
В реакциях замещения простое вещество взаимодействует с химическим соединением, причём атомы некоторого элемента в химическом соединении замещаются атомами простого вещества:
CuSO4 + Zn ® ZnSO4 + Cu; Fe + 2 HCl ® FeCl2 + H2;
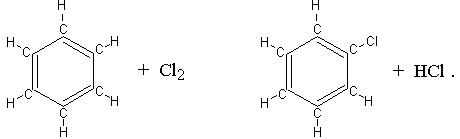

При протекании реакций ионного обмена катион одного из реагирующих веществ соединяется с анионом другого вещества, в результате чего и образуются продукты реакции: Na2SO4 + BaCl2 ® BaSO4¯ + 2 HCl .
Все рассмотренные выше реакции можно, в свою очередь, разделить на две большие группы: реакции, протекающие без изменения степеней окисления элементов и окислительно-восстановительные реакции, при протекании которых наблюдается изменение степеней окисления. Следует заметить, что одни из реакций соединения и разложения являются окислительно-восстановительными, другие – нет. Реакции ионного обмена не являются окислительно-восстановительными, а реакции замещения, напротив, всегда протекают с изменением степеней окисления элементов (см. приведённые выше примеры).
При дальнейшем рассмотрении данной темы более подробно обсуждаются протекающие в водных растворах реакции ионного обмена и окислительно-восстановительные реакции.
Реакции ионного обмена
Обменные реакции протекают, как правило, при смешивании растворов электролитов; электролитами называют вещества, которые в растворах (а также в расплавах) распадаются на ионы (т.е. диссоциируют). Из ранее рассмотренного материала следует, что электролитами являются кислоты, основания и соли.
Реакция ионного обмена протекает в том случае, если в качестве продукта реакции образуется хотя бы одно из следующих веществ:
– малорастворимое соединение, выпадающее в осадок;
– вещество, удаляющееся из сферы реакции в виде газа;
– слабодиссоциирующий электролит.
Например, протекание реакции взаимодействия между хлоридом натрия и нитратом серебра обусловлено выпадением осадка хлорида серебра. Уравнение этой реакции в молекулярном виде:
NaCl + AgNO3 ® AgCl¯ + NaNO3.
Как известно, сильные электролиты находятся в растворах в полностью диссоциированном состоянии. Так как соли являются сильными электролитами, то в растворе хлорида натрия будут содержаться ионы Na+ и Cl–, а в растворе нитрата серебра – Ag+ и NO3–. При смешивании этих растворов ионы Ag+ и Cl– образуют малорастворимый хлорид серебра и, таким образом, удаляются из сферы реакции в виде осадка AgCl. Второй продукт реакции – NaNO3 – полностью диссоциирован на ионы, так как является хорошо растворимым в воде сильным электролитом. Рассмотренный пример позволяет сформулировать правило составления ионно-молекулярных уравнений реакций ионного обмена:
при составлении ионно-молекулярного уравнения обменной реакции следует растворимые в воде сильные электролиты записывать в виде ионов, а слабые электролиты, неэлектролиты, газы и осадки – в виде молекул.
Na+ + Cl– + Ag+ + NO3– ® AgCl¯ + Na+ + NO3–
Полученное уравнение является полным ионно-молекулярным уравнением. После приведения подобных слагаемых (ионы Na+ и NO3– в левой и правой частях полного ионно-молекулярного уравнения) получается сокращённое ионно-молекулярное уравнение: Ag+ + Cl– ® AgCl¯.
Следует заметить, что сокращённые ионно-молекулярные уравнения выражают более общую информацию, чем молекулярные. Например, уравнение Ag+ + Cl– ® AgCl¯ показывает, что при взаимодействии любой растворимой соли серебра (не обязательно нитрата) с любым растворимым в воде хлоридом (не обязательно хлоридом натрия) будет выпадать осадок хлорида серебра.
Взаимодействие соляной кислоты с карбонатом натрия выражается следующим молекулярным уравнением:
2 HCl + Na2CO3 ® 2 NaCl + CO2+ H2O.
Чтобы привести это молекулярное уравнение к ионно-молекулярному виду необходимо понимать, что HCl, Na2CO3 и образующийся в результате реакции NaCl – сильные электролиты; в растворе они находятся в полностью диссоциированном состоянии, и должны быть записаны, поэтому, в виде ионов. Воду и углекислый газ следует записать в молекулярном виде, т.к. вода – очень слабый электролит, а углекислый газ вообще не является электролитом:
2 H+ + 2 Cl– + 2 Na+ + CO32– ® 2 Na+ + 2 Cl– + CO2 + H2O .
После приведения подобных слагаемых (ионы Cl– и Na+) получается сокращённое ионно-молекулярное уравнение 2 H+ + CO32– ® CO2 + H2O,
которое показывает, что любая сильная кислота взаимодействует с раствором любого карбоната, и в результате этого взаимодействия выделяется углекислый газ. В данном случае также происходит удаление из сферы реакции двух типов ионов (H+ и CO32–) в виде газа и малодиссоциирующего вещества.
Важным случаем реакций ионного обмена являются реакции взаимодействия кислот и щелочей (реакции нейтрализации). Например,
Ba(OH)2 + 2 HCl ® BaCl2 + 2 H2O.
Поскольку вода – слабый электролит, а все остальные вещества, записанные в этом молекулярном уравнении – хорошо растворимые сильные электролиты, то полное и сокращённое ионно-молекулярные уравнения имеют следующий вид:
Ba2+ + 2 OH– + 2 H+ + 2 Cl– ® Ba2+ + 2 H2O + 2 Cl–; H+ + OH– ® H2O.
В данном случае ионно-молекулярные уравнения показывают, что любая кислота взаимодействует с любой щёлочью с образованием соли и воды. В результате реакции нейтрализации пара ионов (H+ и OH–) образует малодиссоциирующее вещество и, тем самым, выводится из сферы реакции.
При нейтрализации многоосновной кислоты избытком щёлочи образуется средняя соль (т.е. все атомы водорода в молекуле кислоты заместятся на металл); при недостатке щёлочи образуются кислые соли:
H3PO4 + NaOH ® NaH2PO4 + H2O; H3PO4 + OH– ® H2PO4– + H2O;
H3PO4 + 2 NaOH ® Na2HPO4 + 2 H2O; H3PO4 + 2 OH– ® HPO42– + 2 H2O;
H3PO4 + 3 NaOH ® Na3PO4 + 3 H2O; H3PO4 + 3 OH– ® PO43– + 3 H2O .
При нейтрализации многокислотного основания избытком кислоты образуется средняя соль (т.е. все гидроксогруппы основания замещаются на кислотный остаток); при недостатке кислоты образуются основные соли:
Al(OH)3 + HCl ® Al(OH)2Cl + H2O; Al(OH)3 + H+ ® Al(OH)2+ + H2O;
Al(OH)3 + 2 HCl ® AlOHCl2 + 2 H2O; Al(OH)3 + 2 H+ ® AlOH2+ + 2 H2O;
Al(OH)3 + 3 HCl ® Al(OH)3 + 3 H2O; Al(OH)3 + 3 H+ ® Al3+ + 3 H2O .
Очевидно, что если на кислую соль подействовать далее избытком основания, то произойдёт дальнейшая нейтрализация с образованием средней соли и воды: NaH2PO4 + 2 NaOH ® Na3PO4 + 2 H2O;
H2PO4– + 2 OH– ® PO43– + 3 H2O;
3 NaH2PO4 + 3 Ba(OH)2 ® Na3PO4 + Ba3(PO4)2¯ + 6 H2O;
3 H2PO4– + 3 Ba2+ + 6 OH– ® PO43– + Ba3(PO4)2¯ + 6 H2O.
Аналогично, если на основную соль подействовать избытком кислоты, то произойдёт дальнейшая нейтрализация, и образуется средняя соль и вода:
Al(OH)2Cl + 2 HCl ® AlCl3 + 2 H2O;
3 Al(OH)2Cl + 3 H2SO4 ® AlCl3 + Al2(SO4)3 + 6 H2O.
Для обеих последних реакций сокращённое ионно-молекулярное уравнение одно и то же: Al(OH)2+ + 2 H+ ® Al3+ + 2 H2O.
Из условия протекания реакций ионного обмена следует, что слабые кислоты могут быть вытеснены из их солей сильными кислотами. Поэтому избыток любой сильной кислоты вытесняет слабую кислоту как из кислой, так и из средней соли: 2 Na3PO4 + 3 H2SO4 ® 3 Na2SO4 + 2 H3PO4; PO43– + 3 H+ ® H3PO4;
2 Al(H2PO4)3 + 3 H2SO4 ® Al2(SO4)3 + 6 H3PO4; H2PO4– + H+ ® H3PO4 .
Аналогичным образом, действием избытка щелочи на соли слабых оснований (как средние, так и основные) можно получить соответствующее основание:
Fe2(SO4)3 + 6 NaOH ® 2 Fe(OH)3¯ + 3 Na2SO4; Fe3+ + 3 OH– ® Fe(OH)3¯;
FeOH(NO3)2 + 2 NaOH ® Fe(OH)3¯ + 2 NaNO3; FeOH2+ + 2 OH– ® Fe(OH)3¯.
Важно понимать, что наличие среди исходных веществ малорастворимого в воде соединения, газообразного вещества или слабого электролита не означает, что реакция невозможна. Реакция ионного обмена не будет протекать лишь в том случае, если продуктами реакции не являются или осадок, или газ, или слабый электролит. Сказанное можно подтвердить следующими примерами.
CaCO3↓ + 2 HCl ® CaCl2 + CO2 + H2O
CaCO3↓ + 2 H+ + 2 Cl– ® Ca2+ + 2 Cl– + CO2 + H2O
CaCO3↓ + 2 H+ ® Ca2+ + CO2 + H2O
H2S + 2 NaOH ® Na2S + 2 H2O
H2S + 2 Na+ + 2 OH– ® 2 Na+ + S2– + 2 H2O H2S + 2 OH– ® S2– + 2 H2O
NH4OH (слабое основание) + HCl ® NH4Cl + H2O
NH4OH + H+ +Cl– ® NH4+ + Cl– + H2O NH4OH + H+ ® NH4+ + H2O
