Основные газовые и стехиометрические законы.
Пример 1. Какому количеству вещества соответствует 56 г азота и сколько молекул азота содержится в этом количестве?
Решение. Молярная масса атома азота (N) равна 14 г, молярная масса молекулы азота (N2) равна 28 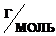 . Следовательно, 56 г соответствует двум моль.
. Следовательно, 56 г соответствует двум моль.
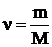 , (1)
, (1)
где ν – количество вещества;
m – масса вещества;
M – молярная масса вещества.
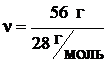 = 2 моль
= 2 моль
Пример 2. Найти массу 200 л хлора при н. у.
Решение. Из закона Авогадро следует, что один моль любого газа при н. у. занимает объем 22,4 л (молярный объем). Один моль газообразного хлора Cl2 имеет массу 71 г (молярная масса атома хлора – 35,5 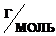 ).
).
71 г – 22,4 л
x г – 200 л
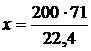 = 633,2 г.
= 633,2 г.
Задания
1. Сопоставить числа молекул, содержащихся в 1 г NH3 и в 1 г N2. В каком случае и во сколько раз число молекул больше?
2. Сколько молекул содержится в 1,00 мл водорода при нормальных условиях?
3. Исходя из молярной массы углерода и воды, определить абсолютную массу атома углерода и молекулы воды.
4. Выразить в молях: а) 6,02·1022 молекул С2Н6; б) 1,8·1024 атомов азота; в) 3,01·1023 молекул NH3. Чему равны молярные массы указанных веществ?
5. Определить массу (в граммах) порции гидроксида бария, в котором содержится 1,806·1023 атомов водорода.
6. Определить массовую долю кислорода (в процентах) в оксиде азота (IV).
7. Определить количество вещества (моль) в порции аммиака, содержащей 2,408·1023 молекул.
8. Определить массу 11,2 л (н.у.) хлороводорода.
9. Определить число атомов водорода в 6,72 л (н.у.) метана (СН4).
10. Определить массовую долю (в процентах) кислорода, входящего в состав хлората калия.
11. Определить массу (в граммах) порции сульфата калия, в котором содержится 6,02·1023 атомов кислорода.
12. Сколько литров водорода, взятого при н.у., можно получить из 360 г воды?
13. Определить количество вещества (моль) в порции оксида натрия, содержащей 1,806·1023 атомов натрия.
14. Определить молярную массу хлора, если масса 500 мл (н.у.) его равна 1,585 г.
15. Определить число атомов азота в 52,2 г нитрата бария.
16. Какой объем при н.у. занимает смесь 1,35 моль Н2 и 0,6 моль О2?
17. Какой из газов легче воздуха: 1) фтор; 2) оксид азота (II); 3) аммиак; 4) кислород; 5) оксид азота (IV). Ответ подтвердите расчетом.
18. Рассчитайте массовую долю кальция в карбонате кальция (%).
19. Вычислите массовую долю кристаллизационной воды в дигидрате сульфата кальция (в процентах) – CaSO4·2H2O.
20. Какова масса водорода, содержащего 1·1023 молекул?
21. Какой объем займет смесь, состоящая из хлора количеством вещества 0,5 моль и кислорода количеством вещества 1,25 моль?
Моль – количество простого или сложного вещества, содержащее такое число структурных частиц: атомов, молекул, ионов или электронов, которое равно числу атомов в 12 г изотопа углерода 12 С и составляет 6,022·1023 (постоянная Авогадро, NА).
1 моль – 6,022·1023 молекул
2 моль – х
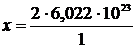 = 12,044·1023 молекул.
= 12,044·1023 молекул.
Гибридизация орбиталей и определение валентностей.
Строение атома
Пример 1.Один из изотопов урана имеет массовое число А = 238. Каков заряд ядра его атома? Сколько электронов находится на электронных оболочках атома? Сколько протонов и нейтронов содержит ядро атома этого изотопа?
Решение.Заряд ядра атома Z равен числу протонов в ядре и числу электронов на электронных оболочках и совпадает с порядковым номером элемента. Для урана Z = 92. Ядро состоит из протонов, заряженных положительно, и нейтронов, не имеющих электрического заряда. Массы протона и нейтрона примерно одинаковы. Массовое число A равно сумме числа протонов Z и нейтронов N: А = Z + N. Отсюда число нейтронов в данном изотопе: N = А – Z = 238 – 92 = 146.
Пример 2. Составьте электронные формулы невозбужденных атомов селена и скандия. Приведите графические схемы распределения электронов по квантовым ячейкам (орбиталям). К каким электронным семействам относятся эти элементы? Укажите валентные электроны их атомов. Для каждого из валентных электронов приведите значения всех квантовых чисел.
Решение.Электронные формулы:
34 Se 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4
21 Sс 1s2 2s2 2p6 3s2 3p6 3d1 4s2
Графические схемы распределения электронов по квантовым ячейкам:
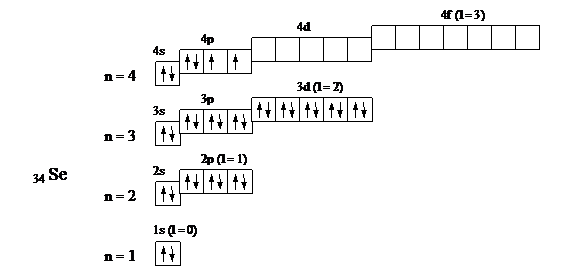
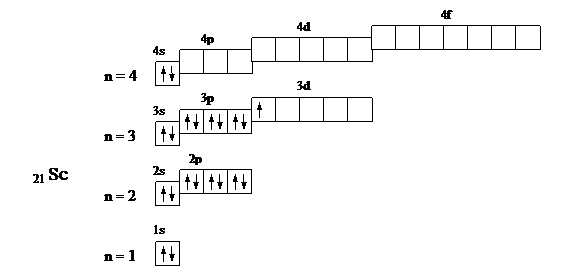
У селена происходит застройка p-подуровня, поэтому он относится к электронному семейству p-элементов; у скандия – застройка d-подуровня, он относится к электронному семейству d-элементов.
Валентными электронами p-элементов являются s и p электроны внешнего квантового уровня. Для селена это 4s2 4p4. Валентными электронами d-элементов являются s-электроны внешнего квантового уровня и d-электроны предвнешнего. Для скандия это 3d1 4s2. Номер группы указывает максимальное число валентных электронов. Значения квантовых чисел, характеризующих валентные электроны, очевидны из выше приведенных графических схем.
34 Se
| Номер электрона | Подуровень | Квантовые числа | |||
| n | e | me | ms | ||
| 4s | +½ | ||||
| –½ | |||||
| 4p | +1 | +½ | |||
| +1 | –½ | ||||
| +½ | |||||
| –1 | +½ |
21 Sc
| Номер электрона | Подуровень | Квантовые числа | |||
| n | e | me | ms | ||
| 4s | +½ | ||||
| –½ | |||||
| 3d | +2 | +½ |
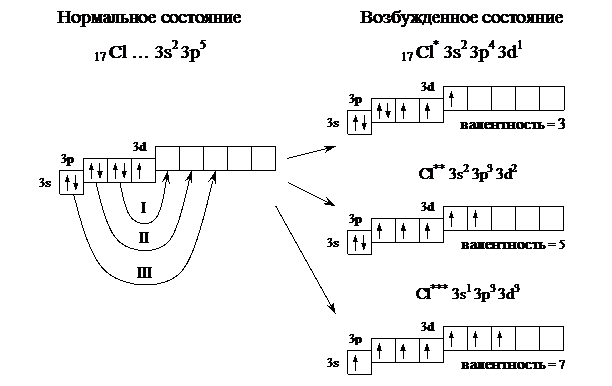
Пример 3. Определить возможные валентные состояния атома хлора (17 Cl).
Решение. Электронная формула 17 Cl – 1s2 2s2 2p6 3s2 3p5.
В нормальном состоянии атом хлора содержит один неспаренный электрон и его валентность равна единице. Однако у хлора есть пять свободных орбиталей 3d подуровня, за счет этого число неспаренных электронов, а следовательно и валентность, может увеличиваться. При возбуждении атома спаренные электроны внешнего уровня могут распариваться и переходить на свободные орбитали другого подуровня в пределах того же уровня. При возбуждении атома хлора происходит переход 3p-электронов, затем 3s-электрона на свободные d-орбитали. Число неспаренных электронов становится равным соответственно 3, 5 и 7. Хлор проявляет переменную валентность равную 1, 3, 5, 7.
Задания
21-30. Выберите исходные данные в таблице и приведите обоснованные ответы на вопросы.
1). Один из изотопов элемента имеет массовое число A. Каков заряд ядра его атома? Сколько электронов находится на всех электронных оболочках атома? Сколько протонов и нейтронов содержит ядро атома этого изотопа?
2). Напишите электронную формулу невозбужденного атома этого элемента, приведите графическую схему распределения электронов по квантовым ячейкам (орбиталям).
3). К какому электронному семейству относится элемент?
4). Сколько имеется в атоме элемента электронов с орбитальным квантовым числом l?
| Номер задачи | Элемент | A | l | Номер задачи | Элемент | A | l |
| 26 Fe | 35 Br | ||||||
| 53 I | 42 Mo* | ||||||
| 25 Mn | 24 Cr* | ||||||
| 28 Ni | 16 S | ||||||
| 27 Co | 17 Cl |
*Следует учесть «провал» электрона с внешнего уровня.
31-40. Выберите исходные данные в таблице и приведите обоснованные ответы на вопросы.
1). Напишите электронную формулу невозбужденного атома элемента с зарядом ядра z, приведите графическую схему распределения электронов по квантовым ячейкам (орбиталям).
2). Укажите валентные электроны его атома. Для каждого из них приведите значения всех квантовых чисел.
3). Сколько в атоме данного элемента электронов с совокупностью главного и орбитального квантовых чисел n и l?
| Номер задачи | z | n | l | Номер задачи | z | n | l |
