Кондуктометрическое титрование
КРАТКИЙ КОНСПЕКТ:
ОБЩАЯ ПОСТАНОВКА ЗАДАЧИ: Определение концентрации ионов методом кондуктометрического титрования. Нахождение точки эквивалентности на графике кондуктометрического титрования сильной, слабой кислоты, смеси кислот методом кондуктометрического титрования. Использование кондуктометров различных типов при определении концентрации ионов методом кондуктометрии.
ОБОРУДОВАНИЕ И РЕАКТИВЫ:
1. Измерительный мостик Кольрауша.
2. Платиновый электрод.
3. Коническая колба на 250 мл, бюретка, градуированная пипетка.
4. 0,1 М раствор едкого натра.
5. Исследуемый раствор электролитов по заданию преподавателя.
Задание 1. Определение концентрации кислоты
По полученным данным кондуктометрического титрования строят соответствующий график, где по оси абсцисс откладывается объем добавленной щелочи в мл, по оси ординат – значение удельной электрической проводимости.
Таблица 9
Результаты кондуктометрического титрования
| V мл, NaOH | Rсравн., Ом | m | Rx, Ом | c, Ом см |
| ... |
где Rсравн – сопротивление магазина (1, 10, 1000, 10000 ом), m – точка компенсации, Rx – сопротивление раствора (Rсравн.*m).
Рассчитывают c раствора:
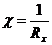
По полученным данным строят кривую титрования и рассчитывают концентрацию кислоты:
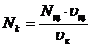 .
.
График
ВЫВОДЫ:
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ:
1. На чем основан метод кондуктометрического титрования.
2. Преимущества и точность кондуктометрического метода.
3. Недостатки метода кондуктометрического титрования.
4. Использование метода кондуктометрического титрования в агрономических объектах.
5. Графики кондуктометрического титрования сильной, слабой и смеси кислот.
ЛАБОРАТОРНАЯ РАБОТА № 6
ТЕРМОХИМИЯ. ЗАКОН ГЕССА. ОПРЕДЕЛЕНИЕ ТЕПЛОВЫХ ЭФФЕКТОВ ХИМИЧЕСКИХ РЕАКЦИЙ. ОПРЕДЕЛЕНИЕ ЭНТРОПИИ РЕАКЦИИ
КРАТКИЙ КОНСПЕКТ:
ОБЩАЯ ПОСТАНОВКА ЗАДАЧИ:устройство калориметра для измерения тепловых эффектов химических реакций. Измерение водяного числа калориметра и теплового эффекта химической реакции Zn + CuSO4 = Cu + ZnSO4 + Q.Расчет свободной энергии Гиббса (G) и изменения энтропии (ΔS).
ОБОРУДОВАНИЕ И РЕАКТИВЫ:
1. Калориметр с механической мешалкой;
2. Металлический цинк (3 г);
3. Хлористый калий (7,2 г);
4. 0,05 М раствор сульфата меди;
5. Измерительный стакан объемом 500мл
Задание 1. Определение постоянной калориметра
Теплота химической реакции, принимаемая или отдаваемая водяным калориметром, будет изменять температуру воды, находящейся в стакане Б, и температуру других частей прибора, находящихся в воде. В этом случае количество теплоты будет равно
Q = (M1C1 + M2C2) × Dt
где M1 - масса воды, С1 - теплоемкость воды, М2 и С2 - усредненные значения масс и теплоемкости для стекла стакана, мешалки и других частей калориметра.
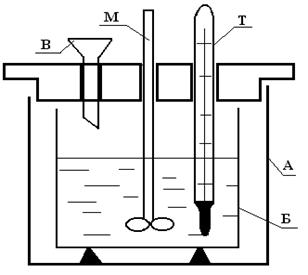
Рис.1. Калориметр.
А – внешний сосуд, Б – внутренний сосуд, в который заливается реагент, Т – термометр, М – мешалка, В – воронка, через которую всыпается второй реагент.
При данном наполнении стакана Б и неизменности частей, погружаемых в воду, М1С1 + М2C2 = const = Z - постоянной калориметра. Таким образом,
Q = Z×Dt
из чего следует, что при Dt = 1° Q = Z, иначе говоря, постоянная калориметра - это количество теплоты, необходимое для изменения температуры всех частей калориметра на 1°. Следовательно, до проведения эксперимента по определению теплового эффекта химической реакции Qp следует прокалибровать прибор (калориметр), т.е. определить постоянную калориметра Z. Этого можно достичь, вводя или отнимая известное количество теплоты (Qp) в данном калориметре с одновременным точным измерением изменения температуры. Тогда постоянную калориметра можно определить по формуле
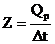
В работе постоянная Z устанавливается по теплоте растворения KCl, для этого производят измерения изменения температуры при растворении KCl, данные заносят в таблицу 10.
Таблица 10
Определение постоянной калориметра
Масса KCl – 7,2 г.
| Периоды, мин. | |||||
| Предварительный | Главный | Заключительный | |||
| Время, мин. | Температура, град. | Время, мин. | Температура, град. | Время, мин. | Температура, град. |
| 10,5 | |||||
| 11,0 | |||||
| 11,5 | |||||
| 12,0 | |||||
| 12,5 | |||||
| 13,0 | |||||
| 13,5 | |||||
| 14,0 | |||||
| 14,5 | |||||
| 15,0 | |||||
| 15,5 |
Полученные данные наносят на миллиметровую бумагу, откладывая по оси абсцисс время в минутах, а по оси ординат – температуру. Через точки предварительного и заключительного периодов проводят прямые линии. Из последней точки предварительного и первой точки заключительного периода опускают перпендикуляр на ось абсцисс. Находят середину главного периода. Из середины главного периода проводят перпендикуляр до пересечения с продолжением прямых предварительного и заключительного периодов. Из точек пересечения опускают перпендикуляры на ось ординат. Отсекаемый отрезок на оси ординат (t1 - t2) равен Dt.
Тепловой Qp, как ранее было сказано, вычисляется на 1 моль прореагировавшего вещества, но в данном случае в калориметре находилось g г вещества, а потому
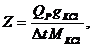
где g - навеска КСl, М – молекулярная масса для КСl, Qp в случае растворения KCl в воде равно 4440 кал/моль.
Задание 2. Определение теплового эффекта реакции окисления металлического цинка и восстановления ионов меди в водном растворе
Тепловые эффекты реакций измеряются так же, как постоянная калориметра.
Полученные данные записывают в таблицу 11, строят график изменения температуры и находят Dt.
Таблица 11
Определение теплового эффекта реакции
| Периоды, мин. | |||||
| Предварительный | Главный | Заключительный | |||
| Время, мин. | Температура, град. | Время, мин. | Температура, град. | Время, мин. | Температура, град. |
| 10,5 | |||||
| 11,0 | |||||
| 11,5 | |||||
| 12,0 | |||||
| 12,5 | |||||
| 13,0 | |||||
| 13,5 | |||||
| 14,0 | |||||
| 14,5 | |||||
| 15,0 | |||||
| 15,5 |
Тепловой эффект реакции рассчитывают по уравнению
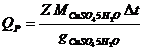 ,
,
где gCuSO4 5H2O – количество кристаллогидрата, содержащегося в 400 мл 0,05 М раствора.
ВЫЧИСЛЕНИЯ:
Максимальная работа по перенесению заряда равна (Дж×моль-1)
W = n × F × E ,
где n – число переносимых электронов, F - число Фарадея (96500 Кл), E - электродвижущая сила (1,10 В). Максимальная работа равна, но противоположна по знаку изменению свободной энергии DG. Следовательно, DG процесса можно рассчитать по уравнению:
W = - DG
“ – “ означает, что работа совершается против сил внешней среды. При расчете DS “ минус “ не учитывается.
Свободная энергия является частью энтальпии и связана с ней соотношением DG = DH - T×DS, где T×DS – связанная энергия. Зная DH и DG, можно рассчитать энтропию реакции окисления цинка и восстановления ионов меди по уравнению
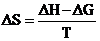 ,
,
где Т – температура, при которой проводился эксперимент (температура окончания реакции окисления Zn с точностью до 10).
После проведения вычислений их результаты заносят в таблицу 12.
Таблица 12
Результаты вычислений
| Опыт | Dt, OC | Z | QP, ккал/моль | DG, кДж/моль | DS, Дж/моль К |
| Определение Z | - | - | |||
| Определение QP | - |
Графическое определение Δt для вычисления постоянной калориметра ( Z ).
Наши рекомендации
|
