Глава 1. Общая физиология возбудимых тканей
Липиды
Липиды, широко представленные в клетках организма, это молекулы, состоящие преимущественно из атомов углерода и водорода. Поскольку эти атомы связаны нейтральными ковалентными неполярными связями, липиды неполярны и имеют очень низкую растворимость в воде, что является характерным свойством этого класса органических молекул. Основные подклассы липидов - жирные кислоты, нейтральные жиры (иначе, ацилглицерины или глицериды), стероиды. Наиболее распространенные липиды мембран - это глицеринзамещенные и сфингозинзамещенные липиды, а также гликолипиды и представители стероидов - стерины.
Жирные кислоты
Молекулы жирных кислот - длинные углеводородные цепи с концевой карбоксильной группой. Типичный пример жирных кислот представлен на рис. 1-1, А, Б.
Вследствие того, что жирные кислоты в организме синтезируются путем соединения двухуглеродных фрагментов, большинство жирных кислот имеет четное число углеродных атомов, от 14 до 22.
Если все атомы углерода в жирных кислотах связаны одинарными ковалентными связями, то такая жирная кислота называется насыщенной жирной кислотой. Некоторые жирные кислоты содержат одну или больше двойных связей, и тогда они называются ненасыщенными. Если у жирной кислоты имеется одна двойная связь, то она называется мононенасыщенной кислотой. Когда таких связей более одной, то говорят о полиненасыщенной жирной кислоте.
Насыщенные и ненасыщенные жирные кислоты различаются по своей структурной конфигурации. В насыщенных жирных кислотах углеводородный
хвост может принимать множество конформаций вследствие свободы вращения вокруг каждой одинарной связи (рис. 1-1, В), однако наиболее вероятна конфигурация вытянутой формы, как энергетически наиболее выгодная.
В ненасыщенных жирных кислотах невозможно вращение вокруг двойной связи, и это обусловливает жесткий изгиб углеводородной цепи (рис. 1-1, Г, Д). В ненасыщенных жирных кислотах цис-конфигурация двойной связи создает изгиб алифатической цепи под углом примерно 30° (рис. 1-1, Г). При транс-форме двойной связи конформация углеводородной цепи мало отличается от конформации насыщенной цепи
(рис. 1-1, Д).
Нейтральные жиры
Глицериновые эфиры жирных кислот называют нейтральными жирами, ацилглицеринами или глицеридами. Они составляют главный компонент жиров, запасаемых в клетках. Структурной основой этих липидов служит замещенный трехатомный спирт глицерин (рис. 1-1, Е).
Если жирными кислотами этерифицированы все три гидроксильные группы глицерина, то такое соединение называется триацилглицерином (рис. 1-1, И). Три жирных кислоты в молекуле триацилглицерина бывают разными, и, таким образом, разные жиры могут включать жирные кислоты с цепочками различной длины и разной степенью насыщенности. Гидролиз триацилглиридов приводит к освобождению жирных кислот от глицерина, а эти продукты могут расщепляться дальше с выделением энергии, необходимой для функционирования клеток. Триацилглицерины представляют собой основную массу природных нейтральных жиров. Кроме триацилглицеринов встречаются диацилглицерины (рис. 1-1, З) и моноацилглицерины (рис. 1-1, Ж).
Рис. 1-1. Основные соединения, формирующие фосфолипиды.
А и Б - примеры молекул жирных кислот. Молекулы жирных кислот представляют собой длинные углеводородные цепи с концевой карбоксильной группой. Показаны (А) насыщенные (все атомы углерода в жирной кислоте связаны одинарными ковалентными связями) и (Б) полиненасыщенные (содержат одну или больше двойных связей) жирные кислоты. Далее на панелях В, Г, Д показана конфигурация связей жирных кислот: насыщенных (В), ненасыщенных с цис-связью (Г), ненасыщенных с транс-двойной связью (Д). Е - замещенный трехатомный спирт глицерин, структурная основа липидов. (Ж) 1-моноацилглицерин. (З) 1,2-диа- цилглицерин как основа фосфолипида. В положении 2 обычно находится ненасыщенная жирная кислота. (И) Триацилглицерин. Положения жирных кислот отмечены как R1 R2 и R3
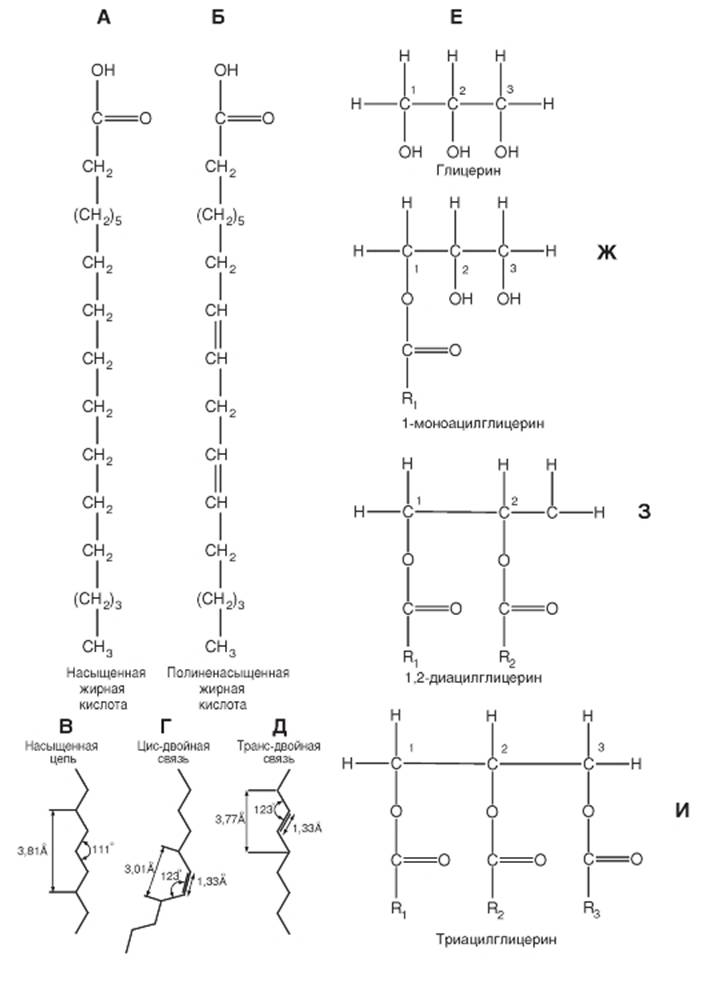
Фосфоглицериды
Структурной основой производных глицерина является замещенный трехатомный спирт глицерин. Фосфолипиды мембран представлены преимущественно фосфоглицеридами (рис. 1-2 А, Б). Интересно, что эти соединения в организме встречаются практически только в биологических мембранах. В фосфоглицеридах одна из первичных гидроксильных групп глицерина (группа 3 на рис. 1-2 Б) этерифицирована не жирной, а фосфорной кислотой. Другими словами, основой для их построения является не глицерин, а глицерофосфорная кислота. Если в положении 3 у глицерина находится остаток фосфорной кислоты, то соответствующее соединение называют фосфатидиловой кислотой.
Кроме того, к этому фосфату в ряде случаев присоединяется небольшая полярная ионизированная азотсодержащая молекула, например, как у фосфатидилсерина и фосфатидилхолина (рис. 1-2 Б). Эти группы составляют полярную (гидрофильную) область на одном конце фосфолипида. Две другие гидроксильные группы глицерина (группы 1 и 2) представляют собой остатки жирных кислот и обеспечивают образование неполярного (гидрофобного) участка на противоположном конце молекулы.
Таким образом, молекулы всех фосфоглицеридов содержат полярную голову и два неполярных углеводородных хвоста. Поэтому они называются амфипатическими, т. е. совмещающими свойства и гидрофильности, и гидрофобности. В воде они организуются в кластеры с полярными концами, которые притягивают молекулы воды.
Фосфоглицериды отличаются друг от друга главным образом по Х-группе полярной головы молекулы. Наиболее простой тип фосфоглицеридов - фосфатидная кислота, не имеющая Х-группы. В клетках она содержится в малом количестве и представляет собой промежуточный продукт в биосинтезе других фосфоглицеридов.
Исходя из изложенной структуры, фосфолипиды обычно обозначаются так, как это представлено на рисунке 1-2 В.
Свойства естественных мембран часто исследуют на их моделях, представляющих собой искусственные фосфолипидные мембраны. Техника получения искусственных липидных мембран была разработана Лэнгмюром в 1917 г. Если на поверхность воды нанести каплю растворенных в каком-либо летучем растворителе фосфолипидов или жирных кислот, то после распределения их молекул по водной поверхности и испарения растворителя образуется мономолекулярная пленка. Как установил Лэнгмюр, при полном насыщении поверхностного слоя адсорбированные молекулы липидов располагаются перпендикулярно к поверхности воды таким образом, что в воду погружается гидрофильная полярная группа, а неполярная углеводородная цепь направлена вертикально вверх. Такой ориентированный слой молекул называют «частоколом Лэнгмюра» (рис. 1-2 Г).
Если стеклянную пластинку опустить в воду, на поверхности которой находится мономолекулярная пленка липидов, то эту пленку можно перенести на поверхность пластинки. При повторных погружениях на пластинке возникают бимолекулярные пленки (рис. 1-2 Д).
Рис. 1-2. Фосфолипиды и принципы формирования мембраны.
А, Б - фосфолипиды мембран преимущественно представлены фосфоглицеридами. В фосфоглицеридах одна из первичных гидроксильных групп глицерина (группа 3) этерифицирована не жирной, а фосфорной кислотой, т. е. их основа не глицерин, а глицерофосфорная кислота. К фосфату присоединяется полярная ионизированная азотсодержащая молекула, как это показано для фосфатидилэтаноламина. Эта группа составляет полярную (гидрофильную) область на одном конце фосфолипида. Две другие гидроксильные группы глицерина (группы 1 и 2) представляют собой остатки жирных кислот и обеспечивают образование неполярного (гидрофобного) участка. В - обозначение фосфолипида. Г - монослой фосфолипидов на воде. Д - бислой фосфолипидов
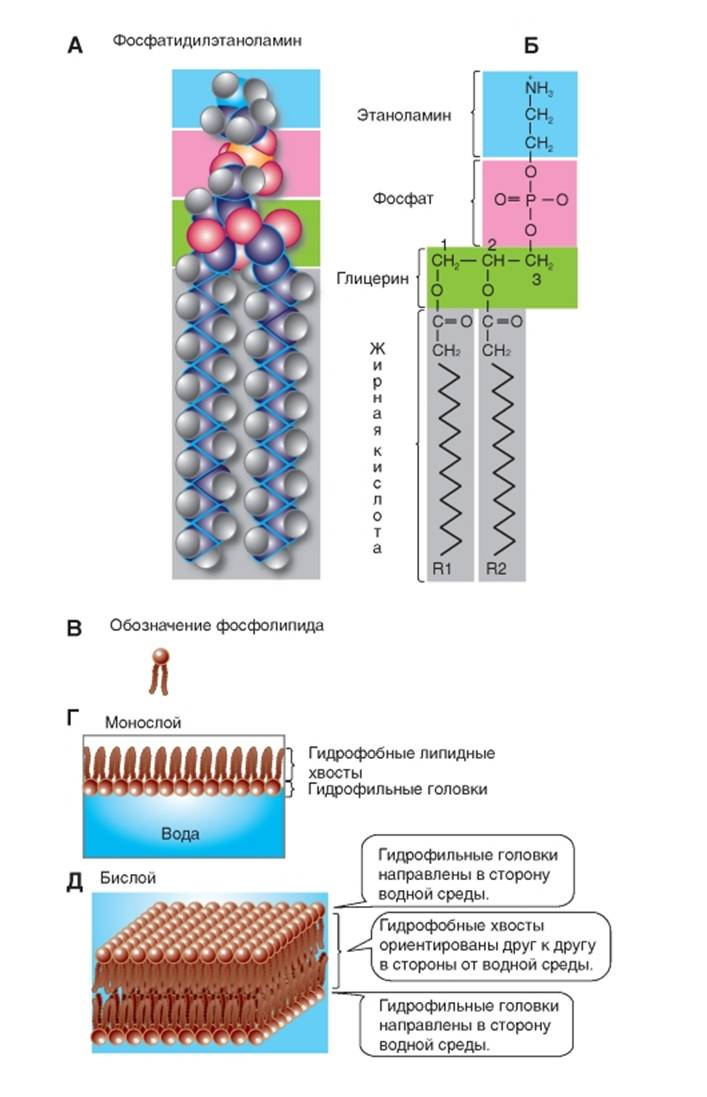
Липиды мембран
В наибольшем количестве в организме человека и животных встречаются такие фосфоглицериды (рис. 1-2 А), как фосфатидилэтаноламин. В дополнение, присутствуют фосфатидилсерин, фосфатидилинозитол и фосфатидилхолин (рис. 1-3 А). Они метаболически связаны друг с другом и содержат в качестве Х-группы аминоспирты этаноламин (остаток фосфоэтаноламина) и холин (остаток фосфохолина). В фосфатидилсерине фосфорная кислота этерифицирована гидроксильной группой серина фосфосерина. В фосфатидилинозите Х-группой служит шестиуглеродный сахароспирт инозит (остаток фосфорного эфира инозита). В фосфатидилглицерине роль Х-группы играет остаток эфира глицерофосфата.
Роль полярной Х-группы фосфатидов может играть также молекула сахара. Эти гликофосфоглицериды, или фосфатидилсахара, обнаружены в растениях и микроорганизмах. Их не следует путать с гликолипидами, в молекуле которых тоже находится сахар, но отсутствует фосфорная кислота.
Сфингозинзамещенные липиды
Структурная основа сфингозинзамещенных липидов - аминоспирт сфингозин. Сфинголипиды обнаружены в мембранах растительных и животных клеток; особенно богата ими нервная ткань, в частности мозг. В жировых отложениях сфинголипидов очень немного. При гидролизе сфинголипидов образуются одна молекула жирной кислоты, одна молекула ненасыщенного аминоспирта сфингозина или его насыщенного аналога дигидросфингозина, одна молекула фосфорной кислоты и одна молекула спирта (X-ОН). Глицерина сфинголипиды не содержат.
Наиболее распространен сфинголипид сфингомиелин (рис. 1-3 Б), содержащий в качестве Х-группы холин. Для сфингомиелина, так же как и для всех других сфинголипидов, характерно то, что одним из его углеводородных хвостов служит длинная алифатическая цепь сфингозина, а другим - этерифицированная жирная кислота. Таким образом, конформации сфинголипидов очень схожи с фосфоглицеридами, так как их молекулы также содержат полярную голову и два неполярных хвоста.
У гликолипидов голову молекулы образуют полярные гидрофильные углеводные группы, чаще всего D-галактоза. Однако в отличие от сфинголипидов, гликолипиды не содержат
фосфорной кислоты. К простейшим гликолипидам относятся гликозилдиацилглицерины, обнаруженные в растениях и микроорганизмах. Другая группа, цереброзиды, может быть отнесена как к гликолипидам, так и к сфинголипидам, поскольку эти соединения содержат и сахар, и сфингозин. Поэтому они называются цереброзиды, или гликосфинголипиды. Особенно велико содержание цереброзидов в мембранах нервных клеток, в частности в миелиновой оболочке. Обнаруженные в цереброзидах жирные кислоты необычны, так как содержат 24 атома углерода. Чаще всего встречаются нервоновая, цереброновая и лигноцериновая кислоты. Жирнокислотный эфир сфингозина, не содержащий сахара, называют церамид.
Стероиды
Стероиды резко отличаются по структуре от молекул других подклассов липидов. Стероиды - это производные пергидроциклопентан-фенантренового ядра, содержащего три конденсированных циклогексановых кольца, соединенных друг с другом. К этим структурам может быть присоединено несколько гидроксильных полярных групп, но число их недостаточно, чтобы сделать стероид водорастворимым.
К важным природным стероидам относятся желчные кислоты, мужские и женские половые гормоны, гормоны надпочечников, а также некоторые стероиды с высокой биологической активностью, к которым относятся, в частности, некоторые яды. В клетках эти соединения присутствуют большей частью в следовых количествах, и только представители одного класса стероидов, а именно стерины, составляют исключение. Стеринами клетки очень богаты. Эти соединения содержат спиртовую гидроксильную группу при С-3 и разветвленную алифатическую цепь из восьми или большего числа атомов углерода при С-17. Они существуют либо в виде свободных спиртов, либо в виде эфиров, у которых гидроксильная группа при С-3 этерифицирована жирной кислотой с длинной цепью.
Примеры стероидов: холестерин (рис. 1-3 Г), кортизол (синтезируется в надпочечниках), женские (эстрогены) и мужские (тестостерон) половые гормоны, секретируемые гонадами. Наиболее распространен холестерин, который содержится в организме как в свободной, так и в этерифицированной форме. Он входит в состав мембран.
Рис. 1-3. Наиболее часто встречающиеся липиды мембран.
А - примеры фосфолипидов; Б - пример сфинголипида; В - пример цереброзида (гликосфинголипида); Г - пример стероидов
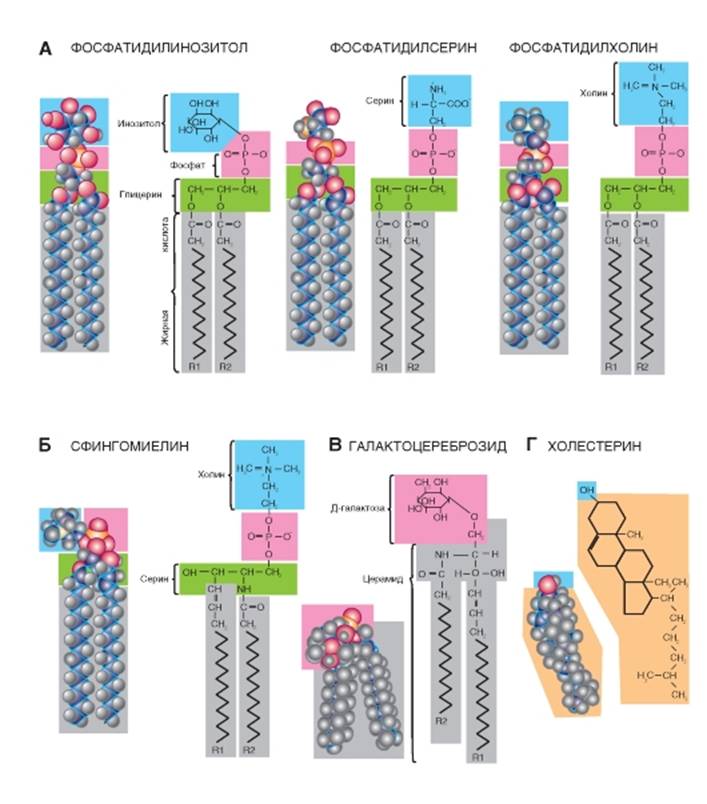
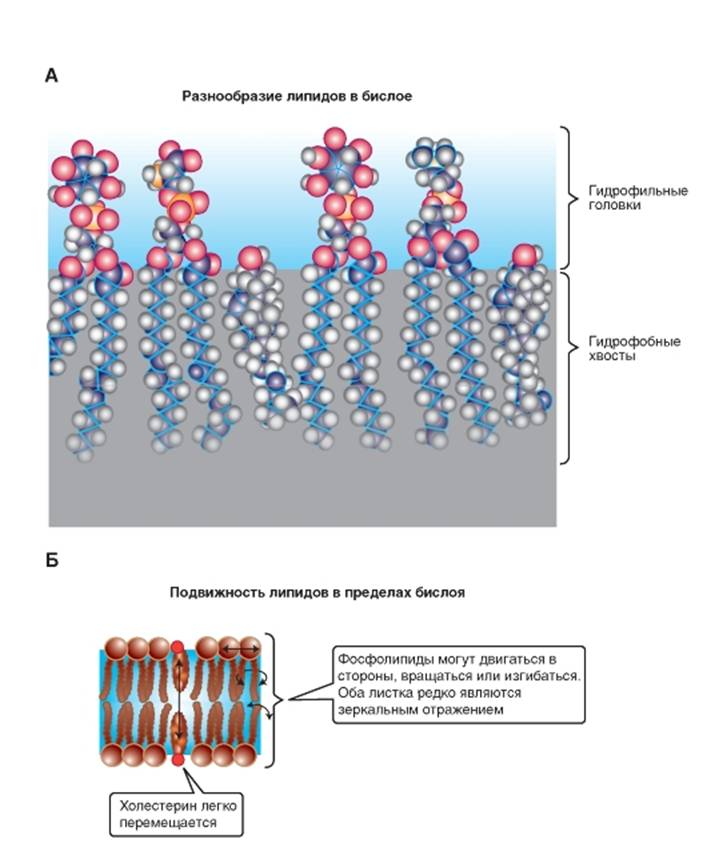
Липиды бислоя
В физиологических условиях мембраны обладают динамическими свойствами. Липидный би слой (рис. 1-4 А) по существу представляет собой вязкую жидкость и характеризуется текучестью. Текучесть - это макроскопическая характеристика всего липидного бислоя; ее величина обратна вязкости. Поскольку липидный бислой обладает текучестью, он, следовательно, имеет низкую вязкость. В зависимости от температуры и химического состава мембраны текучесть может быть высокой или низкой. Текучесть липидного бислоя у теплокровных животных имеет небольшое значение, поскольку температура внутренней среды организма более или менее постоянна, однако у холоднокровных животных этот показатель имеет принципиальное значение, поскольку при понижении температуры вязкость липидного бислоя увеличивается и, следовательно, текучесть уменьшается. Такие изменения динамических свойств мембраны, наряду с рядом других, приводят к тому, что при низких температурах жизнь холоднокровных животных замирает.
Подвижность липидов
Вместе с тем вязкость фосфолипидного бислоя обусловлена двумя видами подвижности на уровне молекул фосфолипидов, которые обладают двумя
видами движений: внутримолекулярным и межмолекулярным (рис. 1-4 Б).
К внутримолекулярной подвижности относится подвижность цепей жирных кислот и участков полярной головки, связанная с гибкостью цепей. Гибкость, в свою очередь, связана с возможностью вращения химических группировок относительно одинарной связи. Это так называемая конформационная подвижность.
Вращательная диффузия - вращение молекулы вокруг своей продольной (длинной) оси, поскольку в вязкой среде «веретено» в плоскости мембраны легче вращается вокруг продольной оси, чем вокруг поперечной.
Вращение вокруг поперечной (короткой) оси теоретически возможно, но в этом случае центр вращения, присущий фосфолипидам, находится близко к поверхности. Вращение происходит как бы около «шеи» молекулы. В этой области молекулы стиснуты, и движение ограничено. Хвосты в этом случае могут совершать маятникообразные движения, но центр вращения будет находиться вверху. Именно поэтому центральная часть бислоя обладает большей текучестью, чем области цепей жирных кислот, расположенные ближе к полярной голове молекулы фосфолипида.
Межмолекулярное движение представляет собой латеральную диффузию целых фосфолипидных молекул и, по-видимому, происходит путем обмена двух молекул липидов местами.
Рис. 1-4. Формирование липидов в бислой.
А - пример фрагмента одного из листков бислоя, сформированного молекулами (слева направо) фосфатидилинозитолом, фосфатидилсерином, фосфатидилинозитолом, фосфатидилхолином, холистерином. Б - варианты подвижности липидов в бислое. Межмолекулярное движение происходит в виде обмена двух молекул липидов местами, а внутримолекулярное движение - в виде вращения молекулы вокруг своей продольной (длинной) оси и вращения вокруг поперечной (короткой) оси. Хвосты могут совершать маятникообразные движения
Белки мембран
Полипептидная цепь аналогична нитке бус (рис. 1-5 А): каждая «бусинка» представляет собой аминокислоту. Более того, так как аминокислоты могут вращаться вокруг пептидных связей, полипептидная цепочка способна изгибаться и укладываться в виде различных форм, подобно нитке бус, которая может быть закручена во многие конфигурации. Трехмерная форма молекулы известна как ее конформация. Конформации пептидов и белков играют главную роль в их функционировании.
Четыре фактора определяют конформацию полипептидной цепи после того, как образуется последовательность аминокислот:
• водородные связи между участками цепи или между участками цепи и окружающими молекулами воды;
• ионные связи, образующиеся между полярными и ионизированными участками вдоль цепи;
• ван-дер-ваальсовы силы, представляющие собой очень слабые силы притяжения между близко расположенными неполярными (гидрофобными) участками;
• ковалентные связи между боковыми цепями двух аминокислот.
Поскольку пептидные связи расположены вдоль цепи через равные интервалы, то водородные связи между ними имеют тенденцию придавать цепи пространственную организацию, известную как α-спираль. Водородные связи могут также образовываться между пептидными связями, когда выступающие участки полипептидной цепи идут примерно параллельно одна другой, образуя сравнительно прямые структуры типа складчатого слоя, которые известны как β-слой. Однако по разным причинам данные участки полипептидных цепей могут и не образовывать конформации в виде α-спирали или в виде β-слоя. Например, размеры боковых цепей и ионные связи между противоположно заряженными боковыми цепями могут препятствовать образованию повторяющихся водородных связей, необходимых для образования этих структур. Эти неупорядоченные
участки, называемые петлями, встречаются в местах, связывающих более регулярные α-спиральние и β-структурные участки.
Ковалентные связи между определенными белковыми цепями могут также искривлять регулярные складчатые слои. Например, боковая цепь аминокислоты цистеина содержит сульфгидрильную группу (R-SH), которая может взаимодействовать с сульфгидрильной группой в другой боковой цепи цистеина, образуя дисульфидную связь (R-S-S-R), которая связывает две аминокислотные цепи вместе. Такие дисульфидные ковалентные связи образуются между участками полипептидной цепи в противоположность более слабым водородным и ионным связям, которые легче разрушаются. Эти же связи вовлечены и в другие межмолекулярные взаимодействия, описанные ниже.
Большинство белков состоят не из одной, а из нескольких полипептидных цепей, и их называют мультимерными (олигомерными) белками. Те же факторы, которые влияют на конформацию одного полипептида, определяют взаимодействие между полипептидами в олигомерных белках. Таким образом, цепи могут поддерживаться вместе благодаря взаимодействию между разными ионизированными, полярными и неполярными боковыми радикалами цепи, а также за счет образования дисульфидных ковалентных связей между цепями.
Первичная структура (последовательность аминокислот) подавляющего количества белков известна, но трехмерная организация определена только для очень небольшого числа белков. Вследствие того, что многие факторы могут изменять упаковку полипептидной цепи, в настоящее время невозможно точно предсказать пространственную организацию белка на основе его первичной структуры.
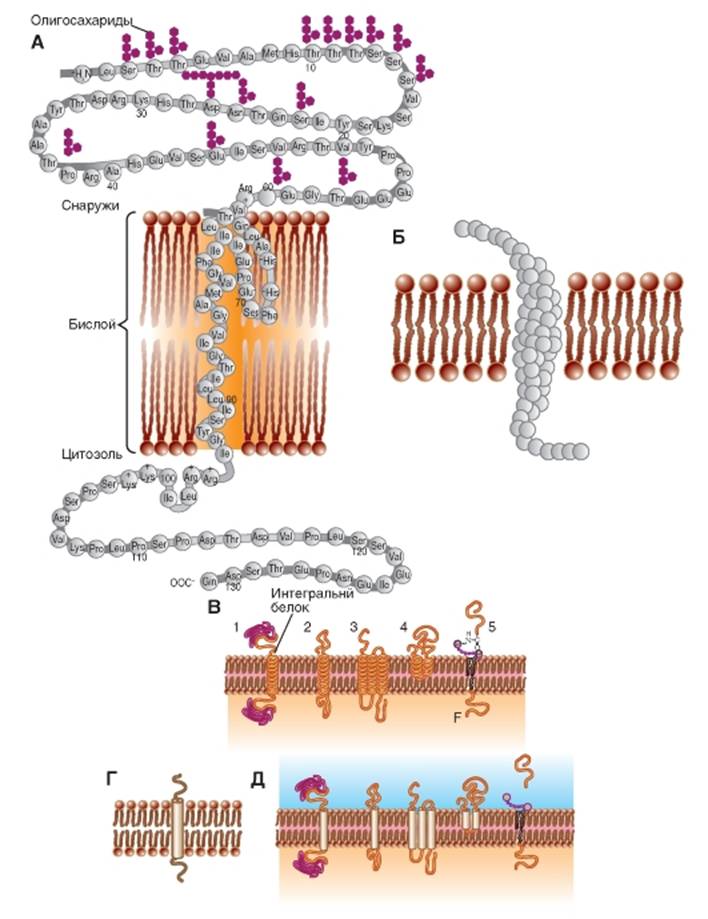
На рис. 1-5 Б и рис. 1-5 В представлены модели интегральных белков, включенных в мембрану.
На рис. 1-5 Г показано стандартное обозначение интегрального белка, а рис. 1-5 Д дублирует рис. 1-5 В, но в виде стандартного обозначения.
Рис. 1-5. Схематическое изображение различных белков, по-разному встроенных в мембрану.
А - принципиальная схема полипептидной молекулы, встроенной в липидный бислой. Известными символами обозначены аминокислоты, входящие в состав белка. Б - модель полипептидной молекулы, встроенной в липидный бислой. Аминокислоты обозначены глобулами. В - модели полипептидных молекул, встроенных в липидный бислой. Трансмембранные фрагменты каждой молекулы обозначены спиралями. Г - основная используемая модель полипептидной молекулы, встроенной в липидный бислой. Трансмембранный фрагмент молекулы обозначен цилиндром. Д - модели полипептидных молекул, встроенных в липидный бислой. Трансмембранные фрагменты каждой молекулы обозначены цилиндрами
Интегральные мембранные белки в модели мембраны
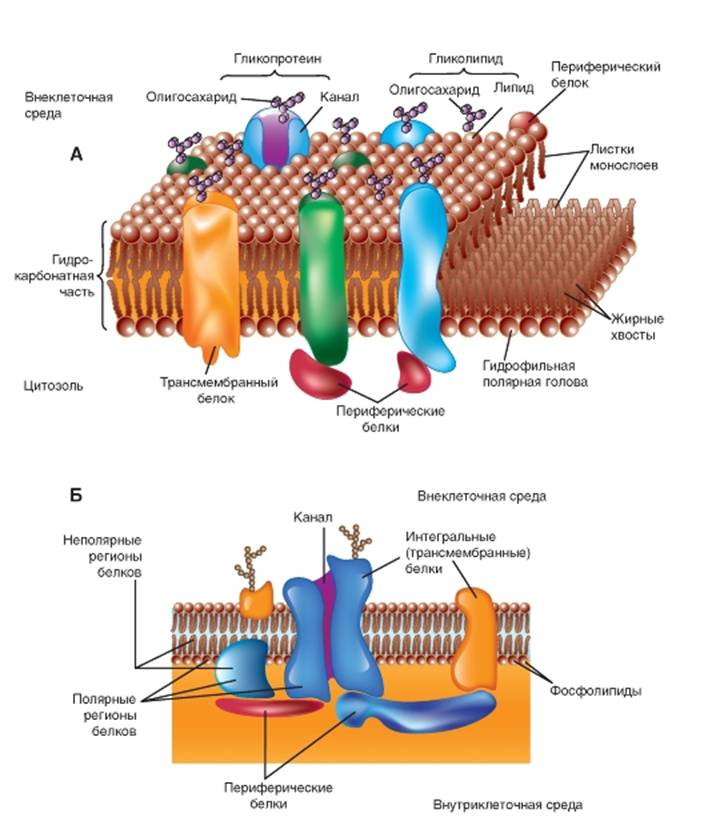
Все мембраны, помимо фосфолипидов, содержат и белки. Хотя Дж. Даниэлли и Х. Давсон, обсуждая способ связывания белка с двойным слоем липидов, использовали термин «мозаичный», они отвергли предположение о том, что пленка растянутого белка покрывает ту или иную сторону мембранного бислоя липидов. Мысль о растянутых молекулах белка, находящихся в конфигурации β-слоя, стала составной частью гипотезы «элементарной мембраны», выдвинутой Дж. Робертсоном. Однако в дальнейшем было показано, что мембранный белок находится преимущественно в виде α-спирали, а не β-слоя. В настоящее время признано, что существуют белки и связанные с обеими сторонами мембраны, и пронизывающие насквозь двойной липидный слой.
В зависимости от метода, применяемого для отделения белков от мембран, мембранные белки причисляют к одной из двух обширных групп. Первая группа - периферические, или внешние, белки, переходящие в надосадочную жидкость при отмывании мембран буферными растворами с различными значениями рН или ионной силы либо растворами, содержащими комплексообразующие вещества, такие, как ЭДТА или ЭГТА. Вторая группа - интегральные, или трансмембранные, белки, сохраняющие связь с мембранами и после проведения указанных операций; поэтому для их освобождения необходимо
сначала разрушить структуру фосфолипидного двойного слоя.
В 1972 г. С. Сингер (S. Singer) и Г. Николсон (G. Nicolson) первыми описали интегральные белки (рис. 1-6 А,Б). В настоящее время показано, что эти белки чрезвычайно разнообразны по своей структуре. Они асимметрично распределены в бислое. Подавляющее большинство интегральных белков многократно пересекают липидный бислой - зигзагообразные белки. Они выполняют множество различных функций. Интегральные белки выступают в роли гидролитических ферментов, рецепторов клеточной поверхности, окислительно-восстановительных компонентов транспортной системы электронов и в качестве специфических белков-переносчиков.
Из гистологических исследований известно, что в гликозилированных интегральных белках область, содержащая углеводы, расположена либо на клеточной поверхности, либо внутри полости эндоплазматического ретикулума или комплекса Гольджи.
Многие интегральные белки содержат в своих полипептидных цепях последовательности гидрофобных аминокислот, однако некоторые связаны с липидным бислоем по иному механизму. Часть интегральных белков ковалентно связана с липидами.
В настоящее время большой интерес исследователей вызывает изучение конформации белков мембран. Многие важные процессы сопровождаются или вызываются изменением способа укладки полипептидной цепи, т. е. изменением конформации белковых молекул в мембранах.
Рис. 1-6. Модель мембраны. Показан липидный бислой со встроенными в него белками, выполняющими разнообразные функции
Транспорт через мембрану
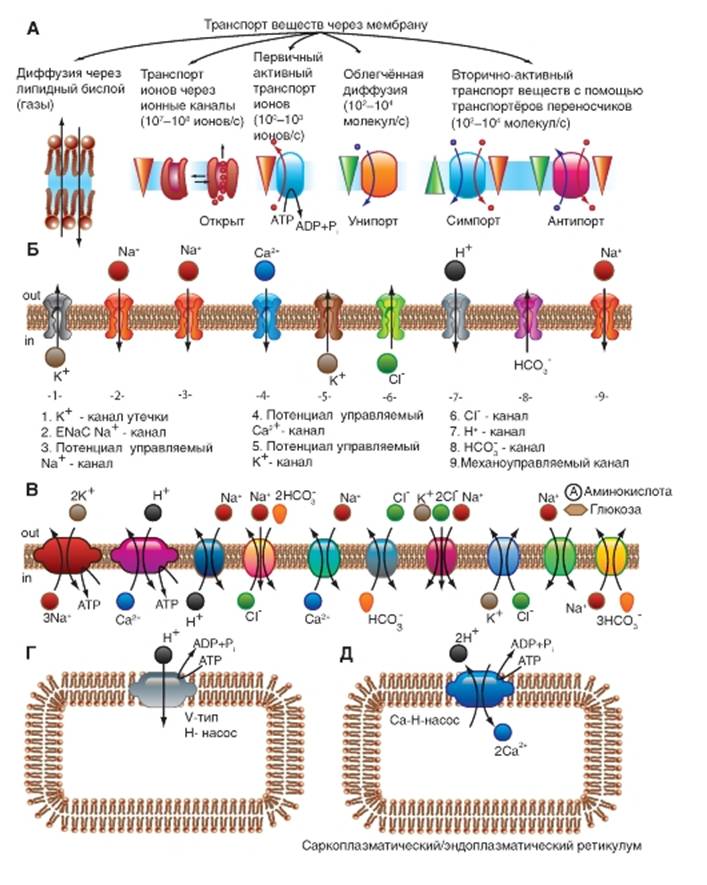
При всем многообразии строения и физикохимических свойств молекул проникающих веществ можно выделить два механизма перемещения веществ через мембрану - посредством простой диффузии, т.е. без помощи специфического переносчика, и при помощи специфических переносчиков. В первом случае выделяют диффузию соединений непосредственно через липидный бислой мембраны (рис. 1-7 А) и ионов через ионные каналы (рис. 1-7 Б). Во втором случае выделяют так называемую облегченную диффузию, первично активный транспорт и, наконец, вторично активный транспорт.
Рассмотрим сначала простую диффузию. Посредством простой диффузии без помощи специального переносчика, во-первых, осуществляется транспорт соединений непосредственно через липидный бислой. В этом случае проникновение веществ в клетку идет путем их растворения в липидах клеточной мембраны, поэтому такой способ присущ водонерастворимым органическим соединениям и газам (например, кислороду и углекислому газу). Во-вторых, вещества перемещаются через ионные каналы клеточной мембраны, соединяющие цитоплазму клеток с внешней средой. Ионный канал - это белковая структура на основе мембранной α-субъединицы, образованная доменами и имеющая вид, подобный пончику с отверстием в середине - порой, через которую движутся ионы. Клетки используют этот путь для транспорта преимущественно ионов Na+, Ca2+, К+ (рис. 1-7 Б). Это пассивный ионный транспорт, который определяется градиентами концентрации и электрического поля (электрохимическим градиентом).
В данном случае понятие «градиент» отличается от его определения в математике или физике. В физико-химических или биологических системах используют термин «по градиенту», когда речь идет о движении от большего электрохимического
потенциала к меньшему, а при движении от меньшего электрохимического потенциала к большему применяют термин «против градиента».
Изменение электрохимического потенциала Δμ (без учета химической энергии, или химических потенциалов) можно записать в виде:
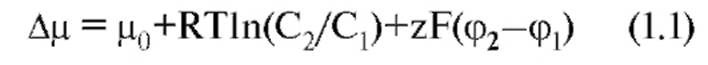
Это максимальная работа, которую можно совершить при переносе одного моля ионов. В таком случае RTln(C2/C1) равно работе по концентрированию раствора от C1 до C2, а zF(φ2-φ1) равно работе по преодолению сил электрического отталкивания, возникающих при разности потенциалов (φ2-φ1) между растворами.
При помощи специфических переносчиков осуществляется энергетически независимая облегченная диффузия ряда соединений (рис. 1-7 В, Г и Д).
Энергетически зависимый первично активный транспорт ионов Na+, Ca2+, K+ иН+ - это перенос веществ против их электрохимических градиентов с затратой энергии АТФ. Клетки в результате активного переноса ионов способны накапливать их в более высоких, по сравнению с окружающей средой, концентрациях и вопреки их заряду. Многие градиенты, возникающие на клеточной мембране и служащие необходимым условием для пассивного переноса ионов по ионным каналам, появляются именно в результате их активного транспорта. Так, градиенты концентрации K+ и Na+ возникают в результате активного переноса этих ионов, т.е. работы специального Na+/К+-насоса. За счет создающейся по обе стороны мембраны разности концентраций осуществляются диффузия этих ионов по градиентам и генерация потенциалов мембраны.
Наконец, вторично активный транспорт ряда ионов и молекул тоже использует энергию, накопленную за счет потребления АТФ и затраченную на создание градиента концентрации (что дает название виду транспорта).
Рис. 1-7. Основные принципы транспорта ионов и некоторых веществ через мембрану и некоторые транспортные системы в клеточной мембране и мембране органелл.
А - продемонстрированы основные пути транспорта веществ через мембрану. Б - показаны различные типы ионных каналов, обеспечивающие транспорт ионов по электрохимическому градиенту. В - насосы, обеспечивающие транспорт ионов против градиента концентрации, обменники и транспортеры. Г и Д - транспортные системы органелл
Na+-канал. Планометрическая организация
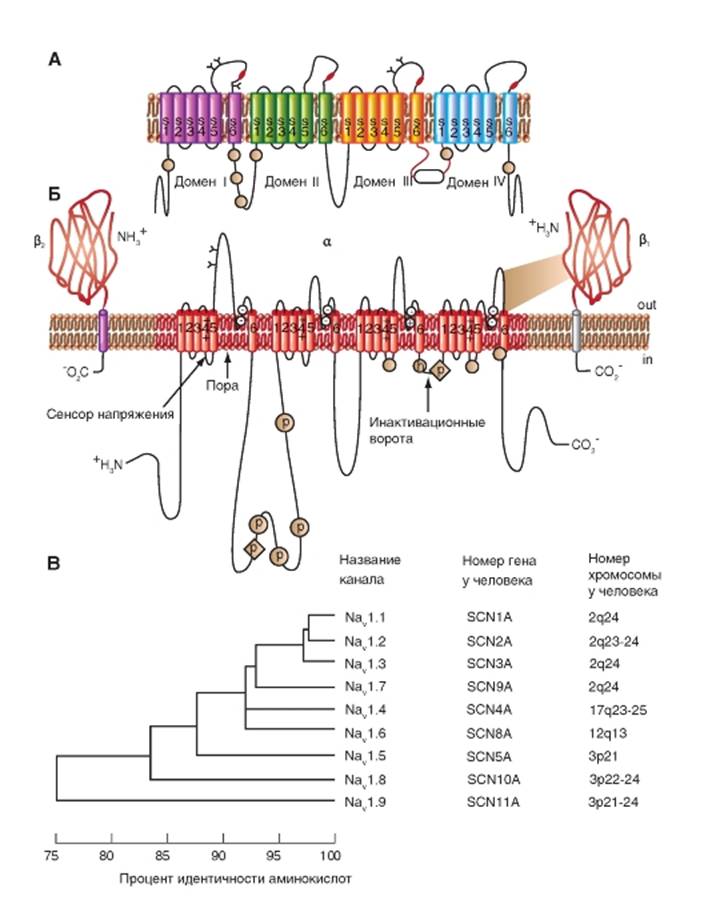
Прежде всего, рассмотрим модель молекулярной организации потенциалуправляемого Na+-канала.
Na+-канал состоит из широко разветвленной α-субъединицы, молекулярная масса которой приблизительно равна 260 кДа (рис. 1-8 А). Разветвленная α-субъединица связана с добавочными β-субъединицами (рис. 1-8 Б). Na+-каналы в клетках центральной нервной системы взрослых животных содержат β1- (или β3-) и β2-субъединицы, в то время как Na+-каналы в скелетных мышцах у взрослых животных имеют только β1- субъединицу. Порообразующая α-субъединица достаточна для обеспечения функции, но кинетика и потенциалзависимость воротного механизма канала модифицируется β-субъединицами. У Na+-канала α-субъединица организована в 4 гомологичных домена (I-IV), каждый из которых содержит 6 трансмембранных α-спиралей (S1-S6- сегменты), а добавочная петля поры локализована между S5- и S6-сегментами. Петля снаружи ограничивает узкий вход в пору, в то время как S5- и S6-сегменты ограничивают внутренний, более широкий, выход из поры. Сегменты S4 в каждом домене содержат положительно заряженные аминокислотные остатки в каждой третьей позиции, выступающие в качестве воротных зарядов и двигающихся через мембрану для инициирования канальной активности в ответ на деполяризацию мембраны. Короткая внутриклеточная
петля, соединяющая гомологичные домены III и IV, выступающая в роли инактивационных ворот, образует складку, внедряющуюся внутрь канальной структуры и блокирующую пору изнутри в течение длительной деполяризации мембраны.
В последние годы для Na+-каналов была разработана новая стандартная классификация (рис. 1-8 В), основыванная на сходстве между аминокислотными последовательностями каналов. В этой классификации индивидуальный канал представлен в виде химического символа, который показывает главный проходящий ион (Na) с главным физиологическим регулятором канала (потенциалом - «voltage gate chanels»), и это записывается вместе как NaV. Число после этих символов показывает генное подсемейство (в настоящее время это только NaV1.), а число, следующее за точкой, показывает специфическую канальную изоформу (например, NaV1.1). Это последнее число было предложено для того, чтобы показать порядок, в котором был идентифицирован каждый ген. Перекрещивающиеся варианты каждого члена семейства обозначаются маленькими буквами, следующими за номером (например, NaV1.1a).
Девять изоформ Na+-каналов млекопитающих, которые были идентифицированы, функционально более чем на 50% идентичны по своей аминокислотной последовательности в трансмембранных и экстрацеллюлярных доменах, где аминокислотная последовательность одинакова. Этого достаточно для четкого выстраивания в ряд всех Na+-каналов.
Рис. 1-8. Планометрическая модель молекулярной организации потенциалуправляемого Na+-канала.
А - порообразующая α-субъединица. Основные структуры α-субъединицы показаны как трансмембранные цилиндры, представляющие собой α-спиральные сегменты. Жирные линии демонстрируют цепи полипептида каждой субъдиницы с длиной, приблизительно пропорциональной числу остатков аминокислот. α-Субъединица состоит из четырех доменов (DI-DIV), каждый из которых состоит из шести сегментов (S1-S6). Сегмент S4 - предполагаемый сенсор напряжения. Б - полная структура канала, включающая α-субъединицу и β1-, β2-субъединицы. Внеклеточные участки β1-, β2-субъединиц показаны как складки. Ψ - участки вероятного гликозилирования; P - места фосфорилирования протеинкиназой А (круги) и протеинкиназой C (ромбы); h - инактивационная частица в петле инактивационных ворот. В - подобие последовательности аминокислот и филогенетические взаимоотношения α-субъединиц потенциалуправляемых Na+-каналов. Показано сравнение аминокислотной идентичности для Na+-каналов NaV1.1- NaV1.9. Даны номер гена и номер хромосомы у человека
Na+-канал. Объемные модели
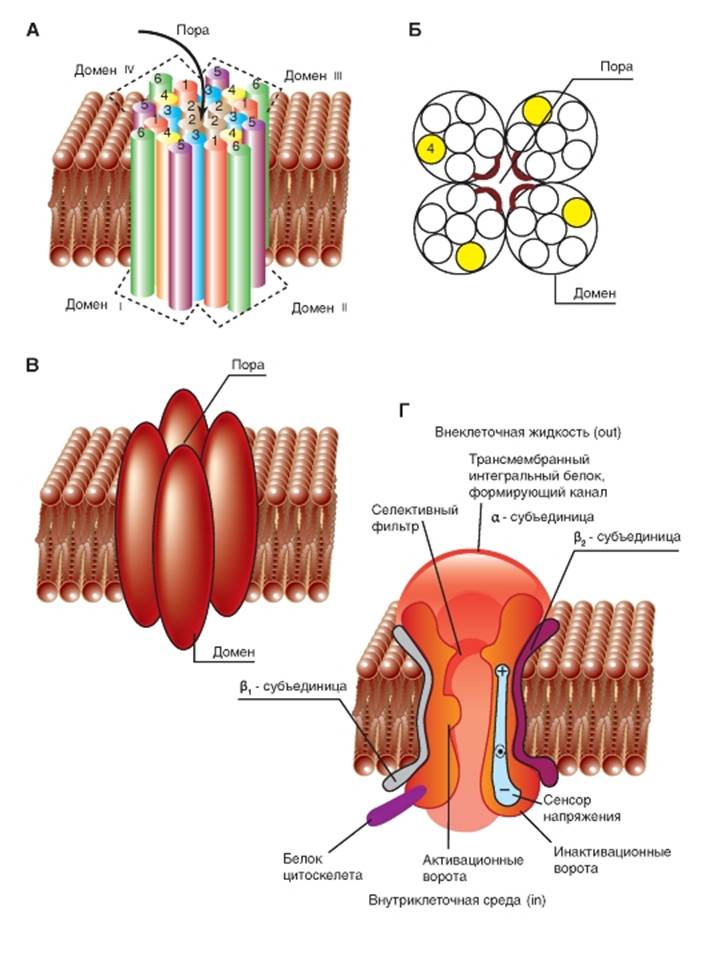
Диаметр пор Na+-канала очень маленький. Он только несколько больше, чем диаметр ионов, которые проходят через эти каналы, что предотвращает вход в них больших полярных органических молекул.
Трехмерное изображение упаковки четырех доменов порообразующей α-субъединицы потенциалуправляемого Na+-канала, каждый из которых содержит 6 пронумерованных трансмембранных сегментов (S1-S6), показано на рис. 1-9 А. Сама пора представлена полым цилиндрическим отверстием в центре упаковки. Связи между сегментами не показаны. Планометрическое изображение среза канала представлено на рис. 1-9 Б. В этом случае трехмерное изображение упаковки четырех доменов порообразую-
щей α-субъединицы потенциалуправляемого Na+-канала можно представить так, как это показано на рис. 1-9 В.
На рис. 1-9 Г канал представлен как трансмембранная макромолекула с отверстием, проходящим насквозь через центр. Ионный канал включает в себя несколько важнейших структур и в том числе устье канала, обращенное в сторону, откуда в него поступает ион (в данном случае внешняя сторона мембраны), селективный фильтр, оценивающий вид иона, активационные и инактивационные ворота, которые могут перекрывать канал для прохождения ионов, и, наконец, сенсор напряжения, управляющий работой канала. (Хотя для многих ионных каналов показано большее количество ворот канала, мы будем обсуждать их работу только с позиций активационных и инактивационных ворот.)
Рис. 1-9. Объемная модель молекулярной организации потенциалуправляемогоNa+-канала.
А - структура всех четырех доменов. На схеме шесть трансмембранных сегментов каждого домена представлены в виде цилиндров и схематически объединены вместе, как это принято. Связи между сегментами и доменами не показаны. Один домен ионного канала, построенный интегральным мембранным белком, содержащим шесть трансмембранных сегментов (S1, S2, S3, S4, S5 и S6), каждый из которых имеет α-спиральную конфигурацию в пределах мембраны. Б - поперечный срез ионного канала, каждый из четырех доменов которого имеет шесть трансмембранных сегментов. В - модель объемного изображения четырех доменов с порой в середине. Г - физиологическая модель потенциалуправляемого Na+-канала
Модель работы Na+-канала
Наиболее простая и широко известная схема работы потенциалуправляемого Na+-канала показана на рис. 1-10 А. Канал представляет собой трансмембранный белок, находящийся в липидном бислое мембраны, прикрепленный к другим мембранным белкам или элементам внутриклеточного цитоскелета. Когда канал открывается, образуется водная пора, проходящая через мембрану. Устье поры намного шире, чем размер иона, только на небольшом участке в области селективного фильтра оно сужается до атомных размеров, где определяется природа иона. Гидрофильные аминокислоты формируют стенку поры, а гидрофобные аминокислоты связаны с липидным бислоем.
В настоящее время механизм работы ворот канала уже достаточно изучен. Одним из первых его попытался описать Б. Хилле. Согласно его точке зрения, основанной на экспериментах А. Ходжкина и А. Хаксли и собственных работах, в ответ на действие электрического раздражителя, т. е. на изменение трансмембранного потенциала, происходит изменение конформации белка потенциалуправляемого канала. Эти конформационные изменения регулируются электрическим полем внутри мембраны, носят стохастический характер и протекают за время от 30 мкс до 10 мс. Важно, что для открытия и закрытия канала не требуются высокоэнергетические химические соединения. Каналы открываются при одних и закрываются при других трансмембранных потенциалах. Было предположено, что электрическое поле действует на сенсор напряжения, который определяет трансмембранный потенциал. Затем сенсор напряжения должен передать эту информацию на саму канальную молекулу для ее конформационной перестройки и соответствующего изменения частоты открытия и закрытия канала.
В 1992 г. Б. Хилле предположил, что изменения конформации происходят в результате общего
перераспределения заряда в макромолекуле, образующей канал, и выражаются в виде открытия или закрытия ворот канала (рис. 1-
