Сущн-ть физико-химич.анализа.пр-лофаз.диаграмма состояния воды.
Сущность:
На основании эксперемент.данных стоят диаграмму сост-я сист.,выражающ.завис-ть к.-л. физич.составасист(т-рапл-я,твердость,пл-тьэлектропровод-ть)в виде ф-и её физич.состава.
Для метал.сист.особоезнач-е имеет построение диагр. плавкости,что позволяет опр-тьпоявляющ-ся в сист.нов.фазы.
Составные части системы – химически индивидуальные вещества, составляющие данную систему и способные к самостоятельному существованию.
В равновесной системе 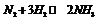 имеются 3 составных части.
имеются 3 составных части.
Константа равновесия: 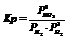
Если известны парциальные давления двух участников реакции, система определена.
Независимые компоненты – индивидуальные вещества, наименьшее число которых необходимо и достаточно для образования всех фаз системы.
Число независимых компонентов – разница между числом составных частей и числом связывающих уравнений.
В данном примере: 3-1=2.
Степени свободы – независимые переменные, которые можно произвольно менять, не нарушая состояния системы (числа и характера фаз).
Правило фаз позволяет определить число фаз в системе при равновесии и изменение этого числа при изменении какого-либо параметра.
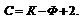 С – число степеней свободы, К – компоненты, Ф – фазы.
С – число степеней свободы, К – компоненты, Ф – фазы.
Если  и
и 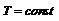 выражение
выражение 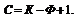
Пример. Определить кол-во фаз в системе 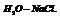
С=К-Ф+2=4-Ф. Максимальное число фаз=минимум С. 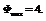
Диаграмма состояния системы - диаграмма, указывающая, в каких фазовых состояниях находится система в зависимости от условий: температура, давление и состав.
В качестве системы возьмем воду. K=1 => состав как переменная отпадает, и фактически имеем Р-Т диаграмму.
С=К-Ф+2=3-Ф; максимальное число фаз, находящихся в равновесии, равно 3.
1 - поле СОВ-область существования твердой фазы – льда.
2 – СОА – жидкая фаза –вода.
3 – АОВ – водяной пар.
Если число ст.св.0,то 3 фазы.
Если число ст.0,то 2 фазы.
Если число ст.2,то 1 фаза.
Двувариантнаясист.-
Одновариант.сист.-
ОС-повыш-е давл-я вызывает пониж-е т-ры,т.к.вызываетобр-е той фазы,к-аяобл-ет большей пл-ю.
Адсорбция и абсорбция.
Адсорбция-процесс изменения концентрации у поверхности раздела двух фаз, а в более узком и употребительном- это повышение концентрации одного вещества у поверхности раздела двух фаз, из которых одна обычно является твердым телом.
Поглощаемое вещество, ещё находящееся в объёме фазы, называют адсорбтив, поглощённое — адсорбат. В более узком смысле под адсорбцией часто понимают поглощение примеси из газа или жидкости твёрдым веществом — адсорбентом. При этом, как и в общем случае адсорбции, происходит концентрирование примеси на границе раздела адсорбент-жидкость либо адсорбент-газ. Процесс, обратный адсорбции, то есть перенос вещества с поверхности раздела фаз в объём фазы, называется десорбция.
Абсорбция- поглощения сорбата всем объёмом сорбента. Абсорбция — частный случай сорбции.
Абсорбция, как правило, означает поглощение газов в объёме жидкости или реже твёрдого тела. Поглощение твёрдым абсорбентом, например, водорода палладием, называют окклюзией. Для процесса поглощения молекул газа или жидкости поверхностью твёрдого тела в русском языке используется термин адсорбция.
На практике абсорбции подвергают не отдельные газы, а газовые смеси, составные части которых поглощаются жидкостью. Эти составные части смеси называют абсорбируемыми компонентами (абсорбат), а непоглощаемые части — инертным газом.
