Расчет тепловых эффектов химических реакций
В стандартных условиях тепловой эффект химическойреакции 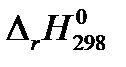 может быть рассчитан по справочным значениям теплот образования
может быть рассчитан по справочным значениям теплот образования 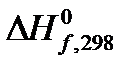 :
:
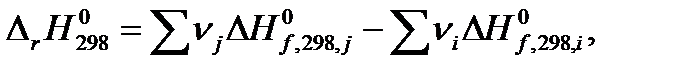 | (1.15) |
здесь и далее индексы i относятся к исходным веществам или реагентам, а индексыj– к конечным веществам или продуктам реакции; 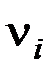 и
и 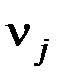 – стехиометрические коэффициенты в уравнении реакции для исходных веществ и продуктов реакции, соответственно.
– стехиометрические коэффициенты в уравнении реакции для исходных веществ и продуктов реакции, соответственно.
Пример:Рассчитаем тепловой эффект реакции синтеза метанола при стандартных условиях.
Решение: Для расчетов воспользуемся справочными данными по стандартным теплотам образования, участвующих в реакции веществ (см. табл. 44 на стр.72 справочника [2]).
| Реакция | СО(Г.) | + 2 Н2 (г.) | = СН3ОН(г.) |
Теплоты образования 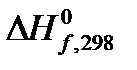 , кДж/моль , кДж/моль | – 110,53 | – 201,00 |
Тепловой эффект реакции синтеза метанола в стандартных условиях по первому следствию из закона Гесса (уравнение 1.15) равен:
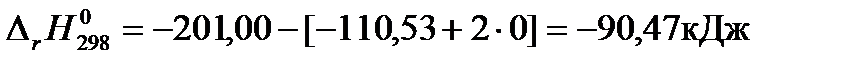
При расчете тепловых эффектов химических реакции нужно учитывать, что тепловой эффект зависит от агрегатного состояния реагентов и от вида записи химического уравнения реакции:
| Реакция | Тепловой эффект в стандартных условиях |
| СО(г.) + 2 Н2 (г.) = СН3ОН(г.) | 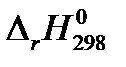 = – 90,47 кДж = – 90,47 кДж |
| СО(г.) + 2 Н2 (г.) = СН3ОН(ж.) | 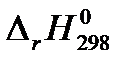 = – 128,04 кДж = – 128,04 кДж |
| 0,5 СО(г.) + Н2 (г.) = 0.5 СН3ОН(ж.) | 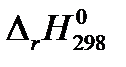 = – 64,02 кДж = – 64,02 кДж |
По второму следствию из закона Гесса тепловой эффект можно рассчитать, используя теплоты сгорания ΔcH, как разность сумм теплот сгорания исходных веществ и продуктов реакции (с учетом стехиометрических коэффициентов):
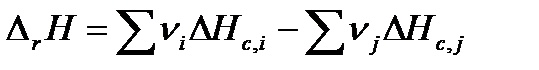 , , | (1.16) |
Большинство химических реакций в химико-технологических системах ведут при повышенных температурах, чтобы повысить скорость реакций и, следовательно, повысить производительность системы. Для того чтобы рассчитать тепловой эффект химической реакции при любой температуре надо знать вид зависимости теплового эффекта от температуры ΔrH = f(T). Эта зависимость выражается законом Кирхгофа. В дифференциальной форме закон Кирхгофа имеет вид:
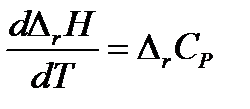 , , | (1.17) |
где ΔrCp – характеризует изменение изобарной теплоемкости системы в результате протекания химической реакции и называется температурным коэффициентом теплового эффекта реакции.
Из дифференциального уравнения Кирхгоффа следует, что зависимость теплового эффекта от температуры определяется знаком ΔrCp, т.е. зависит от того, что больше, суммарная теплоемкость исходных веществ или суммарная теплоемкость продуктов реакции. Проанализируем дифференциальное уравнение Кирхгофа.
1. Если температурный коэффициент ΔrCp> 0, то производная 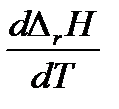 > 0 и функция
> 0 и функция 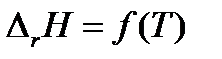 возрастающая. Следовательно, тепловой эффект реакции с ростом температуры увеличивается.
возрастающая. Следовательно, тепловой эффект реакции с ростом температуры увеличивается.
2. Если температурный коэффициент ΔrCp< 0, то производная 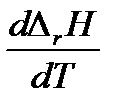 < 0 и функция
< 0 и функция 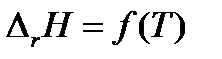 убывающая. Следовательно, тепловой эффект реакции с ростом температуры уменьшается.
убывающая. Следовательно, тепловой эффект реакции с ростом температуры уменьшается.
3. Если температурный коэффициент ΔrCp = 0, то производная 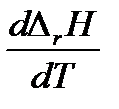 = 0 и
= 0 и 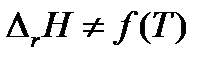 . Следовательно, тепловой эффект реакции не зависит от температуры. Этот случай на практике не встречается.
. Следовательно, тепловой эффект реакции не зависит от температуры. Этот случай на практике не встречается.
Дифференциальные уравнения удобны для анализа, но неудобны для расчетов. Чтобы получить уравнение для расчета теплового эффекта химической реакции, проинтегрируем дифференциальное уравнение Кирхгофа, разделив переменные:

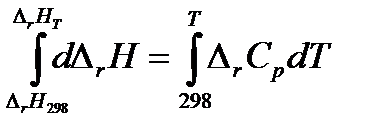
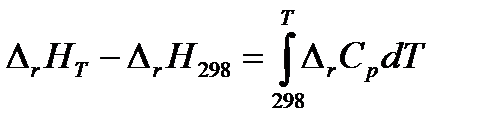
Теплоемкости веществ зависят от температуры, следовательно, и 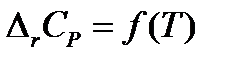 . Однако, в области обычно используемых в химико-технологических процессах температурах эта зависимость не значительна. Для практических целей пользуются средними теплоемкостями веществ в интервале температур от 298 К до заданной температуры
. Однако, в области обычно используемых в химико-технологических процессах температурах эта зависимость не значительна. Для практических целей пользуются средними теплоемкостями веществ в интервале температур от 298 К до заданной температуры 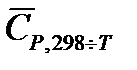 , которые приводятся в справочниках. Температурный коэффициент теплового эффекта, рассчитанный с использованием средних теплоемкостей:
, которые приводятся в справочниках. Температурный коэффициент теплового эффекта, рассчитанный с использованием средних теплоемкостей:
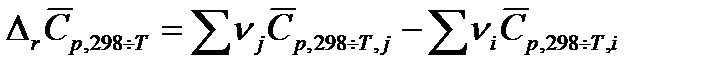 | (1.18) |
Тогда
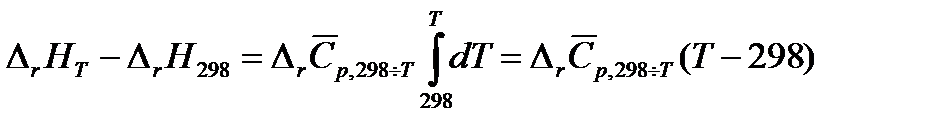 ,
,
откуда
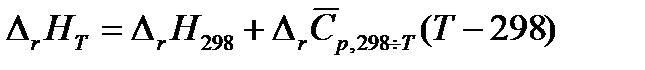 . . | (1.19) |
При стандартных условиях
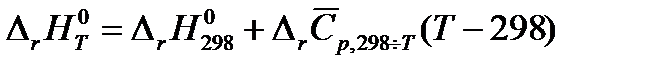 | (1.20) |
Пример: Рассчитаем тепловой эффект реакции синтеза метанола при температуре 1000 К и стандартном давлении.
Решение: Для расчетов воспользуемся справочными данными по средним теплоемкостям участвующих в реакции веществ в интервале температур от 298 К до 1000 К (см. табл. 40 на стр.56 справочника [2]):
| Средние теплоемкости | СО(Г.) | + 2 Н2 (г.) | = СН3ОН(г.) |
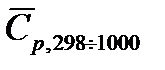 ,Дж/(моль∙К) ,Дж/(моль∙К) | 30,92 | 29,57 | 69,21 |
Изменение средней теплоемкости системы в результате протекания химической реакции:
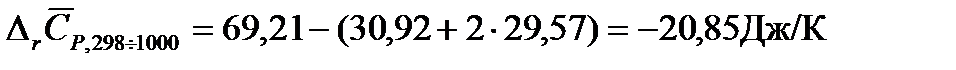 |
Тепловой эффект при 1000 К равен
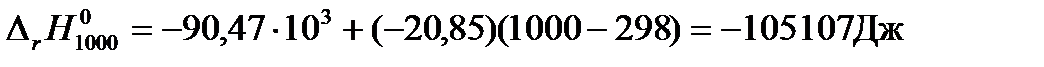 . . |
Второе начало термодинамики
Одной из важнейших задач химической термодинамики является выяснение принципиальной возможности (или невозможности) самопроизвольного протекания химической реакции в рассматриваемом направлении. В тех случаях, когда становится ясно, что данное химическое взаимодействие происходить может, необходимо определить степень превращения исходных веществ и выход продуктов реакции, то есть полноту протекания реакции
Направление протекания самопроизвольного процесса можно определить на основе второго закона или начала термодинамики, сформулированного, например, в виде постулата Клаузиуса:
Теплота сама собой не может переходить от холодного тела к горячему, т. е. невозможен такой процесс, единственным результатом которого был бы переход теплоты от тела с более низкой температурой к телу с более высокой температурой.
Предложено множество формулировок второго начала термодинамики. Формулировка Томсона - Планка:
Невозможен вечный двигатель второго рода, т. е. невозможна такая периодически действующая машина, которая бы позволяла получать работу только за счет охлаждения источника тепла.
Математическая формулировка второго начала термодинамики возникла при анализе работы тепловых машин в трудах Н. Карно и Р. Клаузиуса.
Клаузиусом была введена функция состояния S, названная энтропией, изменение которой равно теплоте обратимого процесса, отнесенной к температуре
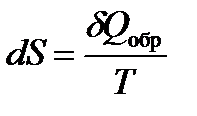 | (1.21) |
Так как теплота необратимого процесса меньше теплоты обратимого процесса
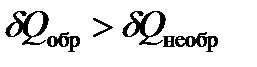
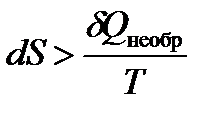 | (1.21а) |
Для любого процесса
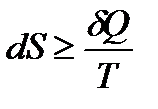 | (1.22) |
Полученное выражение представляет собой математическое выражение второго начала термодинамики.
