Практическое использование электрохимических процессов
Электрохимические процессы, как самопроизвольные, так и вынужденные, широко применяются в различных областях науки и техники. Они являются основными в химических источниках тока, при получении веществ, в частности металлов, и их обработке. Необходимо отметить, что реальные электрохимические системы часто бывают достаточно сложными. На процессы, протекающие в них, влияют различные факторы, связанные как с составом электролита и материалами электродов, так и с режимами их эксплуатации, например плотностью тока и температурой.
Химические источники тока
Гальванические элементы различной конструкции используются в качестве химических источников тока (ХИТ). В ХИТ энергия химических связей в результате протекания самопроизвольной окислительно-восстановительной реакции непосредственно преобразуется в электрическую энергию. При этом происходит расходование компонентов электрохимической системы (окислителя и восстановителя), которые называются активными материалами.
Химические источники тока разделяют на следующие основные типы.
Первичные гальванические элементы (ХИТ одноразового действия). Активные материалы содержатся непосредственно в составе электрохимической системы. Как правило, протекающая при разряде первичного гальванического элемента окислительно-восстановительная реакция является необратимой. Это приводит к тому, что полностью разряженный ХИТ как источник тока к дальнейшей работе непригоден.
 Вторичные элементы - аккумуляторы (ХИТ многоразового действия). Активные материалы, входящие в состав электрохимической системы, расходуются в процессе работы гальванического элемента (разряд аккумулятора), но могут быть регенерированы в результате электролиза (заряд аккумулятора). Это обеспечивается тем, что электродные реакции являются обратимыми. В зависимости от режима работы аккумулятора в нем протекают реакции:
Вторичные элементы - аккумуляторы (ХИТ многоразового действия). Активные материалы, входящие в состав электрохимической системы, расходуются в процессе работы гальванического элемента (разряд аккумулятора), но могут быть регенерированы в результате электролиза (заряд аккумулятора). Это обеспечивается тем, что электродные реакции являются обратимыми. В зависимости от режима работы аккумулятора в нем протекают реакции:
В процессе заряда электрическая энергия от внешнего источника накапливается в аккумуляторе в форме энергии химических связей, которая переходит обратно в электрическую энергию при его разряде.
Топливные элементы. Топливный элемент – электрохимическая система, состоящая чаще всего из газовых электродов. Активные материалы (окислитель и восстановитель) хранятся отдельно от гальванического элемента и подводятся в электрохимическую систему раздельно, непосредственно в момент работы, с одновременным отводом продуктов реакции. Материал электродов в процессе работы элемента не расходуется. Топливный элемент является первичным (неперезаряжаемым) химическим источником тока, в котором химическая энергия окисления вещества (сгорания топлива) непосредственно превращается в электрическую. В качестве восстановителя (топлива) могут быть использованы водород, углеводороды, гидразин и др. Окислителем чаще всего является чистый кислород или кислород воздуха. В отличие от первичных элементов и аккумуляторов, для работы топливного элемента необходимо вспомогательное оборудование. Система, состоящая из батареи топливных элементов, устройств для подвода топлива и окислителя, отвода продуктов реакции, устройства поддержания рабочей температуры, называется электрохимическим генератором.
Основные характеристики химических источников тока:
ЭДС гальванического элемента (Е, В) – напряжение ХИТ без нагрузки.
Номинальное напряжение (U, В) – величина напряжения ХИТ в средней части разрядной характеристики. U = Е - I×R - h, где I - ток во внешней цепи; R – суммарное сопротивление внешней и внутренней цепи; h - поляризация гальванического элемента.
Номинальная емкость (C) – количество электричества, отдаваемое ХИТ во внешнюю цепь. Единицей измерения емкости является ампер-час [А×ч]. Часто для характеристики емкости ХИТ используется удельная энергия, единица измерения – Вт×ч/кг.
Удельная мощность (N, Вт/кг) – максимально допустимая разрядная мощность. Эта характеристика показывает максимально возможный ток, который может генерировать ХИТ при сохранении номинального напряжения.
Срок хранения (Тхр) – время, за которое емкость ХИТ существенно не уменьшается вследствие саморазряда. Саморазряд − химические процессы, идущие на электродах с потреблением окислителя и восстановителя без генерирования электрического тока.
Для аккумуляторов – допустимое число циклов «разряд – заряд» при сохранении основных характеристик. Для топливных элементов важной характеристикой является ресурс работы.
Характеристики некоторых наиболее распространенных химических источников тока.
| Источник тока | Электрохимическая система | U, В | C Вт×ч/кг | N, Вт/кг | |
| Гальванические элементы | Тхр, годы | ||||
| Марганцево-цинковые солевые | Zn|NH4C1,ZnCl2|MnO2(С) | 1,4-1,6 | 20-60 | 1-3 | |
| Марганцево-цинковые щелочные | Zn|КОН|MnO2(С) | 1,4-1,6 | 60-100 | 2-3 | |
| Ртутно-цинковые | Zn|КОН|HgO(С) | 1,1-1,3 | 110-120 | 3-5 | |
| Литиевые неводные | Li|SOC12,LiAlCl4|(С) | 2,6-3,2 | 300-450 | 3-5 | |
| Аккумуляторы | Число циклов | ||||
| Свинцовые кислотные | Рb|H2SO4|PbO2,Рb | 1,8-2,0 | 25-40 | 300- 1000 | |
| Никель–кадмиевые | Cd|KOH|NiOOH,Ni | 1,2-1,3 | 25-35 | ||
| Серебряно-цинковые | Zn|KOH|Ag2O,Ag | 1,4-1,7 | 100-120 | 300-500 | |
| Никель–металлгидридный | МеН|KOH|NiOOH,Ni | 1,2–1,3 | 40 – 70 | - | |
| Топливные элементы | Ресурс, ч | ||||
| Водородно-кислородные | (C,Ме)H2|КОН| O2(Ме,C) | 0,8-0,9 | - | 30-60 | 1000-5000 |
| Гидразино-кислородные | (C,Ме)N2H4|KOH| O2(Ме,C) | 0,8-0,9 | - | 30-60 | 1000-2000 |
Пример 1. Марганцево-цинковый элемент.
а) Сухой элемент Лекланше (Leclanche).
Катодом является смесь диоксида марганца и графитового порошка, окружающая графитовый токоотвод, электролитом – паста из хлорида аммония, хлорида цинка и воды, находящаяся в тонкостенном цинковом стаканчике, который, выполняя функции корпуса, служит также анодом. Активные материалы – цинк и двуокись марганца:
(-)Zn½NH4Cl½MnO2,C(+)
анод (-)(Zn) Zn® Zn2+ + 2ē
2Zn2++4NH4Cl ® [Zn(NH3)4]Cl2+4H++ZnCl2
S 2Zn + 4NH4Cl ® 4ē + [Zn(NH3)4]Cl2 + 4H+ + ZnCl2
катод (+)(С) MnO2+H++ ē ® MnO(OH)
Суммарное уравнение протекающей в системе реакции:
2Zn + 4NH4Cl+ 4MnO2 + 4H++4ē®[Zn(NH3)4]Cl2+ 4H++ ZnCl2+ 4MnO(OH)+4ē
2Zn + 4NH4Cl + 4MnO2 ® [Zn(NH3)4]Cl2 + ZnCl2 + 4MnO(OH)
Электродвижущая сила Е = 1,65 В.
б) Щелочной марганцово-цинковый сухой элемент.
Отличается от сухого элемента Лекланше главным образом тем, что в качестве электролита используется щелочь – раствор гидроксида калия (КОН). Замена электролита приводит к существенному улучшению эксплуатационных характеристик, в частности увеличивается емкость и срок хранения.
(-)Zn½КОН½MnO2,C(+)
анод (-)(Zn) Zn + 4ОН- ® ZnО22- + 2ē + 2H2О
катод (+)(С) MnO2+ H2О + ē ® MnO(OH) + ОН-
Суммарное уравнение протекающей в системе реакции:
Zn + 4ОН- + 2MnO2 + 2H2О + 2ē ® ZnО22- + 2ē + 2H2О + 2MnO(OH) + 2ОН-
Zn + 2КОН+ 2MnO2® К2ZnО2 + 2MnO(OH)
Электродвижущая сила Е = 1,65 В.
Пример 2. Свинцовый аккумулятор.
В ячеистые пластины свинца запрессован оксид свинца, который в процессе первичного заряда на одной пластине превращается в свинец, а на другой – в диоксид свинца. Электролит – серная кислота (32…39 %). Активные материалы – свинец и двуокись свинца.
(-)Pb|H2SO4|РbO2, Pb(+)
Разряд аккумулятора:
анод (-) (Pb) Pb + SO42- ® PbSO4¯ + 2ē
катод (+) (Pb) PbO2 + 4H++ SO42- + 2ē ® PbSO4¯ + 2H2О
Суммарное уравнение реакции, протекающей в системе при разряде:
Pb +SO42-+PbO2+4H++ SO42-+ 2ē ® PbSO4¯ + 2ē+ PbSO4¯ +2H2О
Pb + PbO2 + 2H2SO4 ® 2PbSO4¯ + 2H2О
Электродвижущая сила Е = 2,1 В.
Заряд аккумулятора. К электроду, который при разряде является анодом, подключается отрицательный полюс внешнего источника тока, к другому электроду – соответственно положительный. При напряжении внешнего источника больше, чем Е = 2,1 В, происходит электролиз. В результате протекания катодной и анодной реакций восстанавливаются активные материалы и электролит:
катод (-) PbSO4¯ + 2ē ® Pb + SO42-
анод (+) PbSO4¯ + 2H2О ® PbO2 + 4H++ SO42- + 2ē
Суммарное уравнение реакции, протекающей в системе при заряде:
PbSO4¯ + 2ē + PbSO4¯ + 2H2О ® Pb + SO42- + PbO2 + 4H++ +SO42- + 2ē
2PbSO4¯ + 2H2О ® Pb + PbO2 + 2H2SO4
Примечание. Вследствие участия ионов H+ в окислительно-восстановительной реакции при разряде аккумулятора концентрация серной кислоты уменьшается, а при заряде растет. Степень разряда аккумулятора может быть оценена по концентрации серной кислоты (плотности электролита).
Пример 3. Никель-кадмиевый аккумулятор.
Активные материалы: кадмий и гидроксооксид никеля (III). Электролит – раствор щелочи (КОН).
Разряд аккумулятора:
анод (-) Cd + 2ОН- ® Cd(ОН)2¯ + 2ē
катод (+) NiO(ОН)¯ + H2О + ē ® Ni(ОН)2¯ + ОН-
Суммарное уравнение реакции, протекающей в системе при разряде:
Cd + 2ОН- + 2NiO(ОН)¯ + 2H2О + 2ē ® Cd(ОН)2¯ + 2ē + 2Ni(ОН)2¯ + 2ОН-
Cd + 2NiO(ОН)¯ + 2H2О ® Cd(ОН)2¯ + 2Ni(ОН)2¯
Электродвижущая сила Е = 1,35 В.
Заряд аккумулятора:
катод (-) Ni(ОН)2¯ + ОН- ® NiO(ОН)¯ + H2О + ē
анод (+) Cd(ОН)2¯ + 2ē ® Cd + 2ОН-
Суммарное уравнение реакции протекающей в системе при заряде:
2Ni(ОН)2¯ + 2ОН- + Cd(ОН)2¯ + 2ē ® 2NiO(ОН)¯ + 2H2О + 2ē+ + Cd + 2ОН-
2Ni(ОН)2¯ + Cd(ОН)2¯ ® 2NiO(ОН)¯ + 2H2О + Cd
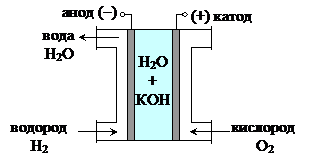 4. Водородно-кислородный топливный элемент со щелочным электролитом (рис.8.12).
4. Водородно-кислородный топливный элемент со щелочным электролитом (рис.8.12).
Рис. 8‑12 Схема водородно-кислородного топливного элемента со щелочным электролитом
Катод (Эк) и анод (Эа) изготовлены из пористого углерода и содержат катализатор (металлы платиновой группы). Между электродами находится электролит – водный раствор КОН (30–40%). Через поры газы попадают на поверхность электродов, контактирующую с электролитом, образуя гальванический элемент: Эк,H2|КОН|O2,Эа. При замыкании внешней цепи электроны будут перетекать с анода на катод, соответственно на поверхности электродов будут протекать реакции:
анод (-) H2 + 2ОН- ® 2H2О + 2ē
катод (+) O2 + 2H2О + 4ē ® 4ОН-
Суммарное уравнение реакции, протекающей в водородно-кислородном топливном элементе:
2H2 + 4ОН- + O2 + 2H2О + 4ē ® 4H2О + 4ē + 4ОН-
2H2 + O2 ® 2H2О
ЭДС кислородно-водородного топливного элемента Е=1,23 В.
Примечание.Химические источники тока могут быть соединены в батареи: последовательно для увеличения напряжения или параллельно для увеличения тока.
Применение электролиза
Электролиз – окислительно-восстановительные реакции, протекающие под действием постоянного электрического тока на поверхности электродов, помещенных в расплав или раствор электролита.
На отрицательно заряженном электроде – катоде – происходит процесс восстановления ионов или молекул электролита, а на положительно заряженном – аноде – процесс окисления. Последовательность протекания электродных реакций при электролизе зависит от многих факторов, основными из которых являются состав электролита, материал электродов, плотность тока, температура и др. Эти факторы влияют на величины потенциалов электродных систем, образующихся при электролизе, которые и будут определять возможность преимущественного протекания той или иной реакции. Для определения наиболее вероятных катодных и анодных реакций необходимо знать значения равновесных потенциалов и вид поляризационных кривых (см. 8.4) всех возможных электродных систем, которые могут возникнуть при электролизе.
Катодный процесс.Независимо от материала катода на нем будет протекать реакция восстановления только ионов металла ( 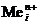 ) при электролизе расплавов и ионов металла или ионов водорода (молекул воды) при электролизе водных растворов электролитов.
) при электролизе расплавов и ионов металла или ионов водорода (молекул воды) при электролизе водных растворов электролитов.
Возможные катодные реакции при электролизе расплава электролита: восстановление катионов металла 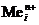 + nē ®
+ nē ® 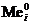 .
.
Возможные катодные реакции при электролизе водного раствора: восстановление катионов металла 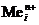 + nē ®
+ nē ® 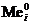 ,
,
восстановление ионов водорода 2H2O + 2ē ®H2 + 2OH- (pH ³7);
2H+ + 2ē ®H2 (pH <7).
Последовательность протекания катодных реакций определяется величиной электродных потенциалов систем, которые возникают при протекании в системе тока. В первую очередь будут восстанавливаться более сильные окислители (Oxi), т. е. ионы или молекулы с большим значением электродного потенциала ( 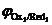 >
> 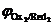 >
> 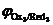 >…>
>…> 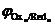 ).
).
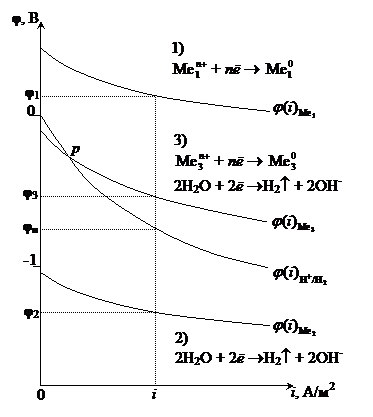 Катодные процессы, протекающие при электролизе водного раствора электролита, условно можно разделить на три группы (рис.8.13).
Катодные процессы, протекающие при электролизе водного раствора электролита, условно можно разделить на три группы (рис.8.13).
Рис. 8‑13 Схема поляризационных кривых восстановления ионов металлаи молекул воды на катоде при рН =const
1. Восстановление только ионов металла: Men+ + nē ® Me0.
Данная реакция протекает при электролизе растворов, содержащих катионы, стандартные потенциалы которых больше потенциала стандартного водородного электрода, т. е. 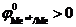 . Этому случаю на рис.8.13 соответствует ион металла
. Этому случаю на рис.8.13 соответствует ион металла 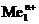 . В системе, независимо от величины плотности тока и pH раствора,
. В системе, независимо от величины плотности тока и pH раствора, 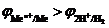 . При токе i потенциал катода равен j1, а скорость выделения металла
. При токе i потенциал катода равен j1, а скорость выделения металла 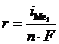 определяется величиной
определяется величиной 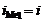 .
.
Если в растворе имеется несколько катионов, стандартные потенциалы которых положительны: 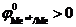 , то среди них в первую очередь восстанавливаются те, у которых величина электродного потенциала больше.
, то среди них в первую очередь восстанавливаются те, у которых величина электродного потенциала больше.
При электролизе расплавов в системе не образуется водородный электрод и на катоде восстанавливаются металлы с любым значением стандартного электродного потенциала.
2. Восстановление только молекул воды или ионов водорода. При pH ³7 реакция записывается как 2H2O + 2ē ®H2 + 2OH-, а при pH<7 – 2H+ + 2ē ®H2.
Данная реакция протекает при электролизе растворов, содержащих катионы, стандартные потенциалы которых существенно меньше потенциала стандартного водородного электрода: 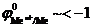 В. В этом случае, независимо от величины плотности тока и pH раствора,
В. В этом случае, независимо от величины плотности тока и pH раствора, 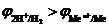 . Этому случаю на рис.8.13 соответствует ион металла
. Этому случаю на рис.8.13 соответствует ион металла 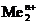 . При токе i потенциал катода равен j2, а скорость выделения водорода
. При токе i потенциал катода равен j2, а скорость выделения водорода 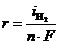 определяется величиной
определяется величиной 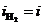 .
.
3. Если  В, то, в зависимости от условий, в основном от плотности тока и от концентрации ионов водорода (pH электролита), возможно восстановление как ионов металла, так и молекул воды или ионов водорода.
В, то, в зависимости от условий, в основном от плотности тока и от концентрации ионов водорода (pH электролита), возможно восстановление как ионов металла, так и молекул воды или ионов водорода.
Вероятность протекания этих реакций определяется величиной неравновесных электродных потенциалов водородного и металлического электродов. Этому случаю на рис.8.13 соответствует ион металла 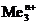 . При малых плотностях тока (i<ip)
. При малых плотностях тока (i<ip) 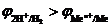 и происходит восстановление преимущественно водорода. При больших плотностях тока(i>ip) одновременно протекают обе реакции, причем скорость восстановления металла (
и происходит восстановление преимущественно водорода. При больших плотностях тока(i>ip) одновременно протекают обе реакции, причем скорость восстановления металла ( 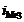 ) больше, чем скорость восстановления водорода (
) больше, чем скорость восстановления водорода ( 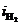 ). В точке р скорости восстановления металла и водорода равны. При больших величинах плотности тока
). В точке р скорости восстановления металла и водорода равны. При больших величинах плотности тока 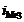 >>
>> 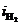 , т. е. на катоде будет происходить преимущественно восстановление ионов металла.
, т. е. на катоде будет происходить преимущественно восстановление ионов металла.
Примечание.На катоде может происходить восстановление и других ионов или молекул окислителей, содержащихся в раствореOx + nē ® Red, например,
O2 + 2H2О + 4ē ® 4ОH-.
Анодный процесс. В отличие от катода, на котором происходил процесс восстановления компонентов электролита, анодной реакцией может быть реакция окисления как ионов и молекул электролита, так и вещества самого анодаRedi ® Oxi+ nē. Последовательность протекания анодных реакций определяется величиной электродных потенциалов, которые возникают при протекании в системе тока. В первую очередь будут окисляться частицы-восстановители (Redi) с меньшим значением электродного потенциала ( 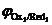 <
< 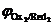 <
< 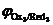 <…<
<…< 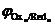 ).
).
Анодные процессы, протекающие при электролизе водного раствора электролита, условно можно разделить на три группы (рис.8.14).
1. Электролиз с растворимым анодом (активный анод). Если материалом анода служит металл, потенциал которого меньше потенциала кислородного электрода 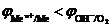 или других частиц, присутствующих в электролите, то происходит окисление металла: Me0 ® Men+ + nē. На рис.8.14 этому случаю соответствует поляризационная кривая 1. При токе i потенциал анода равен j1, а скорость растворения металла
или других частиц, присутствующих в электролите, то происходит окисление металла: Me0 ® Men+ + nē. На рис.8.14 этому случаю соответствует поляризационная кривая 1. При токе i потенциал анода равен j1, а скорость растворения металла 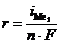 определяется величиной
определяется величиной 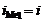 .
.
2. Электролиз с нерастворимым анодом (инертный анод). Если потенциал металла или любого другого проводника первого рода, используемого в качестве анода, больше потенциала кислородного электрода 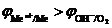 или других частиц, содержащихся в электролите, то материал анода не участвует в реакции окисления. В качестве инертных анодов используются графит, золото, металлы платиновой группы и другие материалы.
или других частиц, содержащихся в электролите, то материал анода не участвует в реакции окисления. В качестве инертных анодов используются графит, золото, металлы платиновой группы и другие материалы.
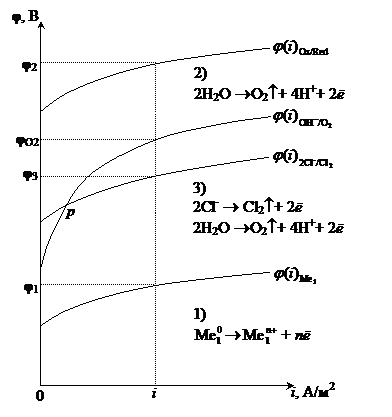 |
Рис. 8‑14 Схема поляризационных кривых окисления металла, молекул воды и анионов на аноде при рН =const
Если в водном растворе электролита присутствуют кислородосодержащие анионы, например SO42-, NO3-, PO43- и др., электродный потенциал которых больше потенциала кислородного электрода, то на аноде происходит только реакция окисления молекул воды (pH£7) или ионов ОH- (pH>7):
2H2O ® О2 + 4H+ + 4ē при pH£7,
4ОH- ® О2 + 2H2O + 4ē при pH>7.
На рис.8.14 этому случаю соответствует поляризационная кривая 2. При токе i потенциал анода равен j2, а скорость выделения кислорода 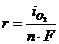 определяется величиной
определяется величиной 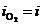 .
.
3. Электролиз с инертным анодом электролитов, содержащих анионы галогенводородных кислот (Cl-, Br-, I-). Вследствие высокой поляризации реакции выделения кислорода на аноде в первую очередь окисляются ионы галогена, образуется иод (I2), бром (Br2). В случае с хлорид-ионом при малых плотностях тока идет выделение кислорода, а при больших плотностях преимущественно окисляются ионы Cl- с образованием хлора:
2Cl- ® 2ē + Cl2
На рис.8.14 этому случаю соответствует поляризационная кривая 3. При потенциале анода j3 скорость выделения хлора определяется величиной 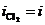 , а кислорода
, а кислорода 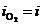 .
.
Примечание.Фтор, вследствие большой величины электродного потенциала, при электролизе водных растворов не образуется, его получают при электролизе расплавов фторидов металлов.
Пример 1. Электролиз водного раствора сульфата натрия (Na2SO4) концентрация 1 моль/л (pH =7) с инертным анодом (графит).
В растворе в результате диссоциации Na2SO4 ↔ 2Na+ + SO42- образуются ионы Na+ и SO42-. При рН =7 равновесный потенциал водородного электрода равен 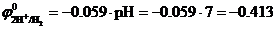 В, а
В, а 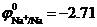 В. Поскольку
В. Поскольку 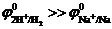 , то на катоде происходит восстановление молекул воды с образованием водорода. Так как SO42- –кислородосодержащий анион, то на аноде происходит окисление молекул воды с образованием кислорода:
, то на катоде происходит восстановление молекул воды с образованием водорода. Так как SO42- –кислородосодержащий анион, то на аноде происходит окисление молекул воды с образованием кислорода:
катод (+) (С) 2H2O + 2ē ®H2 + 2OH-
анод (-)(С) 2H2O ® О2 + 4H+ + 4ē
Суммарное уравнение протекающей в системе реакции:
4H2O+ 4ē +2H2O ® 2H2+4OH- + О2 + 4H+ + 4ē
2H2O® 2H2 + О2
При электролизе происходит разложение воды, растворенное вещество в этом случае не участвует в электрохимических реакциях. Его роль сводится к переносу зарядов в электролите (ток внутренней цепи).
Пример 2. Электролиз водного раствора нитрата серебра AgNO3 с инертным анодом (графит).
В растворе в результате диссоциации AgNO3 ↔ Ag+ + NO3- образуются ионы Ag+ и NO3-.
Поскольку стандартный электродный потенциал 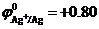 В положительный, то на катоде происходит восстановление ионов серебра. Так как NO3- – кислородосодержащий анион, то на аноде происходит окисление молекул воды с образованием кислорода:
В положительный, то на катоде происходит восстановление ионов серебра. Так как NO3- – кислородосодержащий анион, то на аноде происходит окисление молекул воды с образованием кислорода:
катод (+)(С) Ag+ + ē ®Ag
анод (-)(С) H2O ® О2 + 4H+ + 4ē
Суммарное уравнение реакции, протекающей в системе:
4Ag+ + 2H2O+ 4ē ® 4 Ag +О2 + 4H+ + 4ē
4AgNO3+ 2H2O® 4 Ag + О2+4H NO3
Пример 3. Электролиз водного раствора сульфата меди CuSO4 с медными электродами.
В растворе в результате диссоциации CuSO4 ↔ Cu2+ + SO42- образуются ионы Cu2+ и SO42-.
Стандартный электродный потенциал 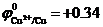 В положительный, поэтому на катоде происходит восстановление ионов меди. Так как медный электрод является активным (растворимым) анодом, то при электролизе происходит окисление меди:
В положительный, поэтому на катоде происходит восстановление ионов меди. Так как медный электрод является активным (растворимым) анодом, то при электролизе происходит окисление меди:
катод (+) (Сu) Cu2+ + 2ē ® Cu
анод (-)(Сu) Cu ® Cu2+ + 2ē
Из суммарного уравнения протекающей в системе реакции:
Cu2+ + 2ē + Cu ® Cu + Cu2+ + 2ē
видно, что в этом случае образование новых веществ не происходит. При электролизе осуществляется перенос атомов меди с анода на катод.
Электролиз является основой различных технологических процессов, в частности:
- при электролизе расплавленных соединений получают алюминий, магний, щелочные и щелочноземельные и другие химически активные металлы (электрометаллургия);
- при электролизе водных растворов получают металлы, не загрязненные примесями: медь, никель, цинк, марганец (гидрометаллургия);
- электролиз водных растворов используют для получения на поверхности изделий металлических покрытий (гальваностегия) или точных металлических копий (гальванопластика);
- электролиз с растворимым анодом лежит в основе процессов рафинирования (очистки) металлов: меди, никеля, серебра;
- процессы анодного растворения используются для электрохимической обработки металлов: электрополирования, электро-фрезерования и др.
- электролизом получают различные химические вещества: хлор, водород и кислород, гидроксид натрия и др.
Контрольные вопросы.
1. Электрохимический процесс. Количественные соотношения между величиной тока и количеством реагентов.
2. Двойной электрический слой на границе «металл – электролит». Электродный потенциал. Уравнение Нернста.
3. Химический и концентрационный гальванические элементы: ЭДС, электродные реакции.
4. Скорость электрохимической реакции. Поляризация электродов.
5. Химические источники тока.
6. Электролиз расплавов и водных растворов электролитов.
КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
Коррозия металлов (от лат. corrosio − разъедание) – непреднамеренный самопроизвольный физико-химический процесс взаимодействия металлов с окружающей (внешней) средой, приводящий к их разрушению или изменению физических свойств.
Причиной коррозии металлов является термодинамическая неустойчивость системы, состоящей из металла и компонентов окружающей среды. В подавляющем большинстве случаев коррозионные процессы представляют собой окисление металлов компонентами среды и превращение их в оксиды (MexOy), гидроксиды (Me(OH)n) или соли (MexAny). Получающиеся соединения называются продуктами коррозии, состав которых зависит от коррозионной среды. Изменение энергии Гиббса для реакций окисления большинства металлов при невысоких температурах отрицательное:
Me0®MexOy; Me(OH)n; MexAny; Me0 ® Men+ + nē; DrG<0,
следовательно, они протекают самопроизвольно.
Только для некоторых химически неактивных металлов (золото, металлы платиновой группы) окисленное состояние термодинамически менее устойчиво, поэтому в природе они часто находятся в неокисленном состоянии. Остальные металлы находятся в природе в виде соединений, и для их получения необходимы затраты энергии на проведение реакция восстановления (металлургические процессы):
MexOy;Me(OH)n;MexAny ®Me0; Men+ + nē ®Me0 ; DrG>0.
Коррозионные процессы
В зависимости от условий эксплуатации металлических изделий внешняя среда состоит из газообразных или жидких веществ. Поэтому коррозия на границе «металл – газ», «металл – жидкость», является гетерогенным процессом, протекающим с изменением поверхности. Продукты коррозии, как правило, образуют на поверхности металла твердую фазу в виде пленок. Следовательно, коррозия должна включать в себя стадию диффузии реагентов через эти пленки.
Таким образом, коррозия является сложным физико-химическим процессом, включающим в себя как химические реакции, так и диффузию. Скорость коррозии определяется как природой металла и химическим составом окружающей среды, так и свойствами ее продуктов и зависит от температуры. Обычно скорость коррозии оценивают по убыли металла с единицы площади (К) или по скорости проникновения, т. е. по одностороннему уменьшению толщины нетронутого металла (П).
Массовый показатель (K) скорости коррозии представляет собой изменение массы металла (Dm) за единицу времени (t), отнесенное к единице поверхности образца (S): 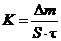 . Чаще всего единицей измерения является г/(м2×сут).
. Чаще всего единицей измерения является г/(м2×сут).
Глубинный показатель (П) скорости коррозии характеризует среднюю глубину (h) разрушения металла за единицу времени (t): 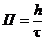 . Обычная единица измерения – мм/год.
. Обычная единица измерения – мм/год.
| Группа стойкости | Скорость коррозии металла, мм/год | Балл |
| Совершенно стойкие | Менее 0,001 | |
| Весьма стойкие | Свыше 0,001 до 0,005 | |
| 0,005 до 0,01 | ||
| Стойкие | 0,01 до 0,05 | |
| 0,05 до 0,1 | ||
| Понижено стойкие | 0,1 до 0,5 | |
| 0,5 до 1,0 | ||
| Малостойкие | 1,0 до 5,0 | |
| 5,0 до 10,0 | ||
| Нестойкие | Свыше 10,0 |
Установлена 10-балльная шкала общей коррозионной стойкости металлов.
Необходимо отметить, что коррозионная стойкость металла в различных средах может значительно различаться.
Пример. Показатели коррозионной стойкости некоторых металлов в кислоте, щелочи и морской воде:
| 20% НCl | 20% KOH | Морская вода | |
| Алюминий | 9-10 | ||
| Магний | 3-4 | ||
| Сталь 3 | 9-10 | 1-2 | 6-7 |
В особых случаях коррозия может оцениваться и по другим показателям (потеря механической прочности и пластичности, рост электрического сопротивления, уменьшение отражательной способности и т. д.), которые выбираются в соответствии с видом коррозии и назначением изделия или конструкции.
Коррозия наносит существенный урон хозяйственной деятельности. Потери, наносимые ею, включают в себя:
- потери металла за счет окисления (~ 20%, из них ~1,5 – 2 % безвозвратно);
- стоимость оборудования, выведенного из строя в результате коррозии отдельных элементов;
- косвенные потери, связанные с ремонтом, простоем оборудования и т.д.
Знание основных закономерностей коррозионных процессов и способов борьбы с ней необходимо для повышения надежности и долговечности работы оборудования.
Классификация коррозионных процессов.
Вследствие огромного разнообразия коррозионных процессов они классифицируются по различным признакам: по характеру коррозионных разрушений металла, по составу коррозионной среды, по механизму коррозионного процесса, по характеру дополнительных воздействий, которым подвергается металл одновременно с действием коррозионной среды, и т. д.
По виду, геометрическому характеру разрушений поверхности или объема металла различают сплошную (общую) и местную (локальную) коррозию.
В случае сплошной коррозии разрушению подвергается вся поверхность металлического изделия, причем она может быть равномерной (рис. 9.1, а) и неравномерной (рис. 9.1, б) в зависимости от того, одинакова ли глубина коррозионного разрушения на разных участках.
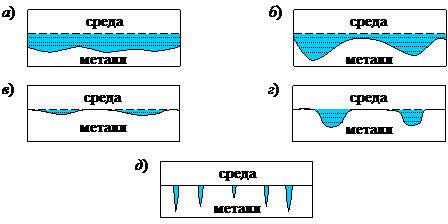 При местной коррозии (рис. 9.1, в–д) поражения локальны. Значительная часть поверхности остается практически незатронутой. В зависимости от степени локализации (соотношение поверхности и глубины проникновения коррозии) различают коррозионные пятна(разрушение отдельных участков на небольшую глубину), язвы (большая глубина поражения металла) и питтинг (точечное разрушение металла на относительно большую глубину).
При местной коррозии (рис. 9.1, в–д) поражения локальны. Значительная часть поверхности остается практически незатронутой. В зависимости от степени локализации (соотношение поверхности и глубины проникновения коррозии) различают коррозионные пятна(разрушение отдельных участков на небольшую глубину), язвы (большая глубина поражения металла) и питтинг (точечное разрушение металла на относительно большую глубину).
Рис. 9‑1 Основные виды коррозионных разрушений поверхности металла: сплошная равномерная (а) и неравномерная (б) коррозия; местная коррозия – пятна (в), язвы (г) и питтинг (д)
Коррозия может приводить к микроскопическим разрушениям в металле (рис.9.2). Все металлы являются поликристаллическими материалами, состоящими из большого числа произвольно ориентированных относительно друг друга мелких монокристаллов (зерно металла) одинакового или разного химического состава. Часто коррозионные процессы развиваются на границах зерен металла, продвигаясь вглубь материала, ослабляя химические связи между микрокристаллами. Процесс такого типа называется межкристаллитной коррозией (рис.9.2, а). В металлическом изделии, находящемся под действием механических напряжений, коррозия может развиваться в виде трещины, рассекая металл прямо через зёрна, транскристаллитная коррозия (рис.9.2, б). Эти два вида местной коррозии являются наиболее опасными, поскольку могут приводить к полной потере прочности и разрушению детали или конструкции. Они почти не оставляют видимых следов на поверхности, их трудно обнаружить и своевременно принять необходимые меры.
 При коррозии сплавов может происходить избирательноеразрушение одного из компонентов. Коррозия такого типа называется селективной (рис.9.2, в).
При коррозии сплавов может происходить избирательноеразрушение одного из компонентов. Коррозия такого типа называется селективной (рис.9.2, в).
Рис. 9‑2 Основные виды микроскопических коррозионных разрушений металла: межкристаллитная (а), транскристаллитная (б), селективная (избирательная) (в)
Отдельные коррозионные среды и вызываемые ими разрушения столь характерны, что по их названию классифицируют и протекающие в них коррозионные процессы.
Выделяют газовую коррозию, протекающую под действием газов в условиях, исключающих образование на поверхности металла жидкой фазы. В отдельный тип выделяют атмосферную коррозию – разрушение металлов под действием природной атмосферы при относительно низкой температуре, приводящей к возможности образования жидкой фазы воды на поверхности металла.
Коррозия металлов при контакте с жидкими агрессивными средами делится на коррозию в электролитах (водные растворы кислот, щелочей и солей) и неэлектролитах (нефть, топливо, смазки и др.).
Коррозия металлических конструкций в грунтах и почвах называется почвенной или подземной коррозией.
В ряде случаев металл подвергается дополнительным воздействиям, которые могут существенно увеличивать скорость коррозии и изменять тип коррозионных разрушений. К таким воздействиям относятся механические нагрузки, блуждающие токи, ионизирующее излучение, жизнедеятельность микроорганизмов и т.д.
В каждом случае при коррозии металлов протекают химические реакции, имеющие свои закономерности и особенности. Выделяют два основных механизма взаимодействия металла с коррозионной средой: химическую и электрохимическую коррозию.
Химическая коррозия
Химическая коррозия – гетерогенная окислительно-восстановительная реакция между металлом и окислителем, содержащимся в окружающей среде. Атомы металла и окислителя обмениваются электронами непосредственно в одном акте, образуя продукты коррозии. Химическая коррозия возможна в любой коррозионной среде, однако обычно она наблюдается в тех случаях, когда коррозионная среда не проводит электрический ток. Как правило, это взаимодействие металлов с газами или парами веществ-окислителей при температурах, когда невозможна их конденсация на поверхности металла с образованием электролита, – высокотемперату
