Неравновесные электрохимические системы
Если в электрохимической системе протекает ток, то она не находится в состоянии равновесия (DG¹ 0).
Пусть электрохимическая система состоит из двух электродов с различным значением их потенциалов. При замыкании внешней цепи под действием разности потенциалов осуществляется перенос зарядов, который сопровождается самопроизвольным (DG<0) окислительно-восстановительным процессом на поверхности электродов. Такая электрохимическая система является гальваническим элементом.
Перенос зарядов в системе может быть осуществлен за счет электрической энергии стороннего источника тока во внешней цепи. В этом случае возможно протекание в электрохимической системе вынужденного окислительно-восстановительного процесса (DG>0). Химические реакции, протекающие на поверхности электродов, представляют собой электролиз.
Гальванический элемент
Гальванический элемент (гальванопара) – электрохимическая система, в которой происходит преобразование энергии химических связей в электрическую энергию. На границах раздела «электрод-электролит» протекают самопроизвольные окислительно-восстановительные реакции. Гальванический элемент состоит из пары электродов с различными значениями электродных потенциалов. Если электродные потенциалы возникают в результате различных потенциалопределяющих реакций, то говорят о химическом гальваническом элементе, если потенциалопределяющие реакции одинаковые, то о концентрационном гальваническом элементе.
Химический гальванический элемент. Простейшим гальваническим элементом является электрохимическая система, составленная из двух электродов первого рода, электролиты которых соединены ионным проводником. При разомкнутой внешней цепи на каждом электроде устанавливается равновесный электродный потенциал. Электрод с бо́льшим потенциалом будет катодом, другой – соответственно анодом (jк > jа). Электрохимическую систему и потенциалопределяющие реакции можно записать как (-)Meа|(Men+)а||(Men+)к|Meк(+)
анод(-): Meа ↔ (Men+)а + nē
катод(+): Meк ↔ (Men+)к + nē
Если замкнуть внешнюю цепь, то за счет разности потенциалов электроны с анода будут перетекать на катод. Это приведет к сдвигу равновесия в потенциалопределяющих реакциях. На аноде увеличится скорость реакции окисления, а на катоде – восстановления. Реакции, протекающие на электродах при работе гальванического элемента (-)Meа|(Men+)а||(Men+)к|Meк(+), записывают как
анод(-): Meа → (Men+)а + nē
катод(+): (Men+)к + nē → Meк
Протекание реакций приводит к нарушению баланса зарядов катионов и анионов электролита в катодном и анодном пространстве. Компенсация избыточных зарядов происходит в результате переноса ионов во внутренней цепи.
Разность потенциалов между катодом и анодом при отсутствии тока в цепи называется электродвижущей силой (ЭДС) гальванического элемента. ЭДС - величина положительная, измеряется в вольтах (В): E = jк – jа > 0.
Величины потенциалов катода и анода зависят от концентрации электролитов и температуры и рассчитывают по уравнению Нернста:
E = (j0к 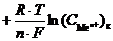 ) – (j0а
) – (j0а 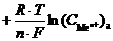 ;
;
E = (j0к – j0а) + ( 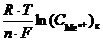
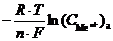 ).
).
Используя табличные данные стандартных потенциалов электродов (см. таблицу), можно определить характер процессов, протекающих на электродах при работе гальванического элемента, и рассчитать его ЭДС.
Пример.Гальванический элемент составлен из цинкового и медного электродов первого рода (гальванический элемент Даниэля-Якоби) Zn|Zn2+||Cu2+|Cu (рис. 8.8). Концентрация ионов цинка 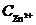 = 0,01 моль/л (сульфата цинка), а концентрация ионов меди
= 0,01 моль/л (сульфата цинка), а концентрация ионов меди 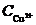 = 0,1 моль/л (сульфата меди). Определить реакции, протекающие на электродах при работе гальванического элемента и ЭДС при стандартной температуре Т0=298 К.
= 0,1 моль/л (сульфата меди). Определить реакции, протекающие на электродах при работе гальванического элемента и ЭДС при стандартной температуре Т0=298 К.
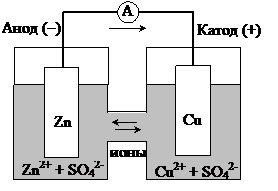 |
Рис. 8‑8 Схема гальванического элемента Даниэля-Якоби
Решение. 1. Используя уравнение Нернста, можно рассчитать потенциалы электродов: 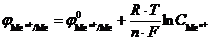 . Для стандартной температуры это уравнение имеет вид
. Для стандартной температуры это уравнение имеет вид
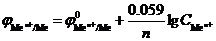 .
.
В условиях примера электродные потенциалы равны:
Zn2++2ē ↔ Zn0 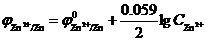 = -0.76
= -0.76 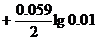 = -0.82 В
= -0.82 В
Cu2++2ē ↔ Cu0 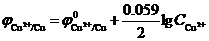 = +0.34
= +0.34 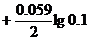 = +0.31 В
= +0.31 В
2. Поскольку потенциал катода больше, чем анода (E = jк – jа >0), то для данной пары электродов цинковый электрод ( 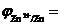 -0,82 В) будет анодом, а медный (
-0,82 В) будет анодом, а медный ( 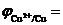 +0,31 В) – катодом. Следовательно, при работе гальванического элемента на электродах будут протекать реакции:
+0,31 В) – катодом. Следовательно, при работе гальванического элемента на электродах будут протекать реакции:
анод (-) окисление Zn0® Zn2++2ē
катод (+) восстановление Cu2++2ē ® Cu0
Суммарная реакция Cu2++2ē + Zn0® Zn2++2ē + Cu0
3. ЭДС данного гальванического элемента равна разности потенциалов катода и анода: E = jк – jа= (+0,31) – (-0,82) = 1,13 В.
Концентрационный гальванический элемент.Когда оба электрода электрохимической системы одинаковы по своей природе, их потенциалы образуются за счет одной и той же химической реакции. В случае электродов первого рода устанавливается равновесие: Men+ + nē ↔Me. В гальваническом элементе jк > jа. Величины потенциалов определяются концентрацией электролита и, согласно уравнению Нернста, будут равны: 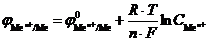 .
.
Из уравнения следует, что потенциал электрода, который находится в контакте с электролитом большей концентрации, будет больше потенциала электрода, находящегося в контакте с электролитом меньшей концентрации. Следовательно, в таком гальваническом элементе анодом будет электрод, находящийся в контакте с электролитом меньшей концентрации, катодом – электрод, у которого концентрация больше 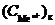 >
> 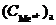 .
.
При замыкании внешней цепи электродное равновесие нарушается. В системе протекает ток, и на аноде происходит окисление металла, а на катоде – восстановление его катионов:
анод(-): Me ® Men+ + nē
катод(+): Men++ nē ® Me
Гальванический элемент такого типа называется концентрационным гальваническим элементом. Поскольку разность стандартных потенциалов равна нулю: (j0к – j0а) = 0, то в этом случае ЭДС определяется только разностью концентраций ионов металла в электролите:
E = 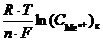
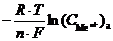 =
= 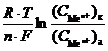
В концентрационных гальванических элементах электрическая энергия получается за счет выравнивания концентрации электролита внутри системы (увеличеия энтропии системы). В электролите катода концентрация ионов металла уменьшается в результате реакции восстановления, а в электролите анода увеличивается за счет реакции его окисления.
