Строение атома и периодическая система
Задания для СРС
Ввиду ограниченности времени по лабораторным занятиям часть лекционного материала студенты должны освоить самостоятельно и решить задачи своего варианта по следующим темам:
1. Строение атома и периодическая система.
2. Химическое равновесие.
3. Свойства разбавленных растворов неэлектролитов.
4. Реакции обмена в растворах электролитов.
5. Ионное произведение воды. Водородный показатель. Гидролиз солей.
Каждое задание выполняется на двойном листе, титульный лист обязателен. Содержание задания и теоретическое введение писать не нужно. Сдавать задания по мере прохождения указанных тем на лекции.
Тема 1
Примеры решения задач
Пример 1.1. Написать электронную формулу атома ванадия 23V и:
а) подчеркнуть валентные электроны; б) указать электронное семейство, период, группу, подгруппу, в которых находится элемент; в) изобразить графически валентные энергетические уровни; г) охарактеризовать квантовыми числами валентные электроны; д) составить формулу высшего оксида ванадия и соответствующего ему гидроксида.
Решение. а) Порядковый номер ванадия (V) в периодической системе 23. Следовательно, положительный заряд ядра равен +23 и столько же электронов в атоме ванадия вращается вокруг ядра. Поскольку ванадий находится в 4 периоде, электроны располагаются на 4-х энергетических уровнях следующим образом: 23V 2е, 8е, 11е, 2е. Запись электронной конфигурации атома по уровням и подуровням имеет вид 1s22s22p63s23p63d34s2. Валентные электроны ванадия 3d34s2.
б) Ванадий относится к d-электронному семейству и расположен в 4 периоде, VВ группе (побочная подгруппа). Валентные энергетические уровни ванадия 3d и 4s и валентные электроны располагаются на них следующим образом:
в) 
г) Каждый электрон в атоме характеризуется набором четырех квантовых чисел: n, l, ml, ms. Главное квантовое число n обозначается арабской цифрой и равно номеру уровня, на котором находится электрон. Для 3d электронов главное квантовое число n равно 3, для 4s электронов – n = 4.
В электронных формулах орбитальное квантовое число обозначается буквой l. Напоминаем:
Значения l 0 1 2 3
Буквенные обозначения s p d f.
Для электронов, находящихся на d-подуровне, l = 2; для электронов
s-подуровня l = 0.
Электроны находятся на разных орбиталях, которые ориентированы по разным направлениям. Ориентацию АО в пространстве определяет магнитное квантовое число ml, значение которого зависит от орбитального квантового числа l. Если l=2, ml принимает значение –2, –1, 0, +1, +2; при l = 0 ml = 0.
Спиновое квантовое число ms принимает значения +½ и –½. Таким образом, электроны состояния 3d3 и 4s2 характеризуются следующими квантовыми числами:
N 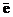  | n | l | ml | ms |
| -2 | +1/2 | |||
| -1 | +1/2 | |||
| +1/2 | ||||
| +1/2 | ||||
| -1/2 |
д) Формула высшего оксида ванадия V2O5. Это кислотный оксид и в качестве гидроксида ему соответствует кислота НVO3.
Пример 1.2. Какие орбитали атома заполняются электронами раньше 5d или 6s; 4f или 6p?
Решение. Последовательность заполнения орбиталей осуществляется в соответствии с правилом Клечковского и определяется суммой (n+l). Для подуровня 5d сумма (n+l) равна (5+2) = 7, для подуровня 6s (6+0) = 6. В первую очередь заполняются орбитали с меньшей энергией, следовательно, вначале заполняется 6s, потом 5d. Для подуровней 4f и 6р сумма (n+l) одинакова (4+3) = 7 и (6+1) = 7. При одинаковом значении суммы (n+l) раньше заполняется подуровень с меньшим n, следовательно, 4f.
Пример 1.3. Записать электронную конфигурацию ионов Fe3+ и S2–.
Решение. Электронная конфигурация атома железа
26Fe0 1s22s22p63s23p63d64s2. Если атом железа отдаст три электрона, он превратится в ион: Fe0 – 3e → Fe3+. В первую очередь атом отдает электроны с более высокого энергетического уровня и подуровня. Электронная конфигурация ионов Fe3+ имеет вид 1s22s22p63s23p63d54s0. Электронная конфигурация атома серы 16S0 1s22s22p63s2 3p4. Приняв два электрона S0 + 2e → S2–, атом серы превращается в ион S2–, электронная конфигурация которого 1s22s22p63s23p6.
Пример 1.4. Какую высшую и низшую степени окисления проявляют фосфор, сера, хлор? Составить формулы соединений данных элементов, отвечающих этим степеням окисления.
Решение. Данные элементы находятся соответственно в VA, VIA, VIIA-группах и имеют электронную конфигурацию внешнего энергетического уровня 3s23p3; 3s23p4; 3s23p5.
Для большинства элементов главных подгрупп высшая степень окисления равна номеру группы, в которой находится элемент, а низшая степень окисления равна разности N–8, (N – номер группы). Ответ на вопрос задачи см. в табл.
Задачи
Билет 1.1
1. Написать электронную формулу 31Ga и: а) подчеркнуть валентные электроны; б) указать электронное семейство, период, группу, подгруппу, в которых находится элемент; в) изобразить графически валентные энергетические уровни; г) охарактеризовать квантовыми числами валентные электроны; д) составить формулу высшего оксида галлия и соответствующего ему гидроксида.
2. Какую атомную орбиталь выберет очередной электрон: а) 4d или 5s;
б) 5p или 4d; в) 5f или 4d; г) 5p или 6s; д) 5f или 6s. Ответ обосновать.
3. У какого элемента пятого периода – молибдена или теллура – сильнее выражены металлические свойства? Ответ мотивировать, записав электронные конфигурации атомов этих элементов. Какой из них образует газообразное соединение с водородом? Составить формулу этого соединения.
Билет 1.2
1. Написать электронную формулу 40Zr и: а) подчеркнуть валентные электроны; б) указать электронное семейство, период, группу, подгруппу, в которых находится элемент; в) изобразить графически валентные энергетические уровни; г) охарактеризовать квантовыми числами валентные электроны; д) составить формулу высшего оксида циркония и соответствующего ему гидроксида.
2. Среди приведенных ниже электронных конфигураций указать невозможные и объяснить причину невозможности их реализации: а) 1р3; б) 3р6; в) 3s2; г) 2s2; д) 2d5; е) 5d2; ж) 3f12; з) 2р4; и) 3р7.
3. Какую низшую и высшую степени окисления проявляют Si, As, Se, I? Составить формулы соединений данных элементов с водородом и кислородом, отвечающих этим степеням окисления.
Билет 1.3
1. Написать электронную формулу 32Ge и: а) подчеркнуть валентные электроны; б) указать электронное семейство, период, группу, подгруппу, в которых находится элемент; в) изобразить графически валентные энергетические уровни; г) охарактеризовать квантовыми числами валентные электроны; д) составить формулу высшего оксида германия и соответствующего ему гидроксида.
2. Записать электронные конфигурации нейтральных атомов по заданным электронным конфигурациям ионов: а) 1s22s22p63s23p63d104s24p6 (Э–);
б) 1s22s22p63s23p63d64s0 (Э3+); в) 1s22s22p63s23p63d104s24p64d105s25p6 (Э2–);
г) 1s22s22p63s23p64s0 (Э2+). Указать символы и названия элементов, для которых приведены электронные конфигурации.
3. Исходя из степени окисления атомов соответствующих элементов, дать мотивированный ответ на вопрос, какой из двух гидроксидов является более сильным основанием: Cr(OH)2 или Cr(OH)3; CuOH или Cu(OH)2; Fe(OH)2 или Fe(OH)3
Билет 1.4
1. Написать электронную формулу 75Re и: а) подчеркнуть валентные электроны; б) указать электронное семейство, период, группу, подгруппу, в которых находится элемент; в) изобразить графически валентные энергетические уровни; г) охарактеризовать квантовыми числами валентные электроны; д) составить формулу высшего оксида рения и соответствующего ему гидроксида.
2. Какие из электронных формул, отражающих строение невозбужденного атома некоторого элемента неверны: а) 1s22s22p53s1; б) 1s22s22p63s23p63d4; в)1s22s22p6; г) 1s22s22p63s23p64s2; д) 1s22s22p63s23p64s3? Почему? Атомам каких элементов отвечают правильно составленные электронные формулы?
3. У какого из p-элементов VII группы – хлора или йода – сильнее выражены неметаллические свойства? Почему? Исходя из высшей степени окисления элементов, написать формулы кислородсодержащих кислот.
Билет 1.5
1. Написать электронную формулу 42Mo и: а) подчеркнуть валентные электроны; б) указать электронное семейство, период, группу, подгруппу, в которых находится элемент; в) изобразить графически валентные энергетические уровни; г) охарактеризовать квантовыми числами валентные электроны; д) составить формулу высшего оксида молибдена и соответствующего ему гидроксида.
2. Составить формулы электронной структуры ионов элементов IV периода, которые по электронному строению аналогичны атому аргона.
3. Составить формулы оксидов и гидроксидов элементов третьего периода, отвечающих их высшей степени окисления. Как изменяется кислотно-основной характер этих соединений при переходе от натрия к хлору? Написать уравнения реакций, доказывающих амфотерность гидроксида алюминия.
Билет 1.6
1. Написать электронную формулу 34Se и: а) подчеркнуть валентные электроны; б) указать электронное семейство, период, группу, подгруппу, в которых находится элемент; в) изобразить графически валентные энергетические уровни; г) охарактеризовать квантовыми числами валентные электроны; д) составить формулу высшего оксида селена и соответствующего ему гидроксида.
2. Составить формулы электронной структуры ионов: Hg2+; Pb2+; Cr3+; I1-
3. Каков вероятный характер оксидов марганца: MnO; Mn2O3; MnO2; MnO3; Mn2O7? Составить формулы соответствующих им гидроксидов.
Билет 1.7
1. Написать электронную формулу 41Nb и: а) подчеркнуть валентные электроны; б) указать электронное семейство, период, группу, подгруппу, в которых находится элемент; в) изобразить графически валентные энергетические уровни; г) охарактеризовать квантовыми числами валентные электроны; д) составить формулу высшего оксида ниобия и соответствующего ему гидроксида.
2. В атоме элемента имеется 5 электронных слоев и 2 внешних электрона. Какими квантовыми числами они характеризуются?
3. Исходя из положения Ca, Ga, W в периодической системе, составить формулы водородного соединения кальция, оксида галлия, вольфрамовой кислоты, отвечающие их высшим степеням окисления.
Билет 1.8
1. Написать электронную формулу 50Sn и: а) подчеркнуть валентные электроны; б) указать электронное семейство, период, группу, подгруппу, в которых находится элемент; в) изобразить графически валентные энергетические уровни; г) охарактеризовать квантовыми числами валентные электроны; д) составить формулу высшего оксида олова и соответствующего ему гидроксида.
2. Какое число электронов содержит атом, если следующий электрон должен сделать выбор между 5p и 4d атомной орбиталью? Какую из них и почему он предпочтет? Атом какого элемента при этом образуется? Написать его электронную формулу.
3. Написать формулы высших оксидов и их гидроксидов для элементов с порядковыми номерами 4; 37; 75. Написать уравнения реакций, доказывающих амфотерный характер гидроксида бериллия.
Билет 1.9
1. Написать электронную формулу 81Tl и: а) подчеркнуть валентные электроны; б) указать электронное семейство, период, группу, подгруппу, в которых находится элемент; в) изобразить графически валентные энергетические уровни; г) охарактеризовать квантовыми числами валентные электроны; д) составить формулу высшего оксида таллия и соответствующего ему гидроксида.
2. Почему при заполнении атомной орбитали очередной электрон идет:
а) на 4s, а не на 3d; в) на 3d, а не на 4p; в) на 4p, а не на 5s?
3. Какую низшую и высшую степень окисления проявляют
а) Si; б) N; в) Se; г) Br? Составить формулы соединений данных элементов, отвечающих этим степеням окисления.
Билет 1.10
1. Написать электронную формулу 52Te и: а) подчеркнуть валентные электроны; б) указать электронное семейство, период, группу, подгруппу, в которых находится элемент; в) изобразить графически валентные энергетические уровни; г) охарактеризовать квантовыми числами валентные электроны; д) составить формулу высшего оксида теллура и соответствующего ему гидроксида.
2. Пользуясь правилом Гунда, распределить электроны по атомным орбиталям, отвечающим возбужденному состоянию атомов P, Al, Si, S, Ni.
3. Исходя из положения металла в периодической системе, дать мотивированный ответ на вопрос, какой из двух гидроксидов более сильное основание:
а) Ba(OH)2 или Mg(OH)2; б) Ca(OH)2 или Fe(OH)2; в) Cd(OH)2 или Sr(OH)2?
Билет 1.11
1. Написать электронную формулу 48Cd и: а) подчеркнуть валентные электроны; б) указать электронное семейство, период, группу, подгруппу, в которых находится элемент; в) изобразить графически валентные энергетические уровни; г) охарактеризовать квантовыми числами валентные электроны; д) составить формулу высшего оксида кадмия и соответствующего ему гидроксида.
2. Написать электронные формулы атомов и ионов:
а) Cl0, Cl‾; б) Mn0, Mn2+.
3. Определить по формулам высших соединений номер группы, в которых находится элемент: а) Э2O5, ЭCl4, ЭН3; б) ЭО2, НЭ, Э2О7; в) Н2Э, Э2О3, ЭО.
Билет 1.12
1. Написать электронную формулу 35Br и: а) подчеркнуть валентные электроны; б) указать электронное семейство, период, группу, подгруппу, в которых находится элемент; в) изобразить графически валентные энергетические уровни; г) охарактеризовать квантовыми числами валентные электроны; д) составить формулу высшего оксида брома и соответствующего ему гидроксида.
2. Сколько неспаренных электронов содержат невозбужденные атомы:
а) B; б) S; в) As; г) Cr; д) Hg?
3. Марганец образует соединения, в которых он проявляет степени окисления +2, +3, +4, +6, +7. Составить формулы его оксидов и гидроксидов, отвечающих этим степеням окисления.
Билет 1.13
1. Написать электронную формулу 33As и: а) подчеркнуть валентные электроны; б) указать электронное семейство, период, группу, подгруппу, в которых находится элемент; в) изобразить графически валентные энергетические уровни; г) охарактеризовать квантовыми числами валентные электроны; д) составить формулу высшего оксида мышьяка и соответствующего ему гидроксида.
2. Написать электронные формулы атомов и ионов:
а) Na0, Na+; б) N0 , N3-; в) Mn0, Mn2+, Mn7+.
3. Назвать элемент по следующим данным: а) элемент 4 периода, высший оксид Э2О7, с водородом образует газообразное соединение НЭ;
б) элемент 5 периода, высший оксид ЭО2, с водородом газообразных соединений не образует; в) элемент 4 периода, высший оксид ЭО, с водородом дает солеобразное соединение ЭН2.
Билет 1.14
1. Написать электронную формулу 82Pb и: а) подчеркнуть валентные электроны; б) указать электронное семейство, период, группу, подгруппу, в которых находится элемент; в) изобразить графически валентные энергетические уровни; г) охарактеризовать квантовыми числами валентные электроны; д) составить формулу высшего оксида свинца и соответствующего ему гидроксида.
2. Написать электронные формулы ионов: а) Sn2+; б) Sn4+; в) Cr3+; г) Br1-.
3. Составить формулы водородного соединения германия; оксида молибдена; рениевой кислоты, отвечающие их высшим степеням окисления.
Билет 1.15
1. Написать электронную формулу 39Y и: а) подчеркнуть валентные электроны; б) указать электронное семейство, период, группу, подгруппу, в которых находится элемент; в) изобразить графически валентные энергетические уровни; г) охарактеризовать квантовыми числами валентные электроны; д) составить формулу высшего оксида иттрия и соответствующего ему гидроксида.
2. Определить по правилу Клечковского последовательность заполнения атомных орбиталей, характеризующихся суммой (n+l): а) 5; б) 6; в) 7.
3. Один из элементов III группы образует оксид с массовой долей кислорода 25,6 %. Рассчитать молярную массу элемента и назвать этот элемент. (Ответ: 69,7 г/моль).
Билет 1.16
1. Написать электронную формулу 49In и: а) подчеркнуть валентные электроны; б) указать электронное семейство, период, группу, подгруппу, в которых находится элемент; в) изобразить графически валентные энергетические уровни; г) охарактеризовать квантовыми числами валентные электроны; д) составить формулу высшего оксида индия и соответствующего ему гидроксида.
2. Назвать элементы, внешний энергетический уровень атомов которых выражается электронной конфигурацией np4. Написать полную электронную конфигурацию атома одного из этих элементов и указать электронное семейство.
3. Составить формулы оксидов и гидроксидов элементов II периода, отвечающих их высшей степени окисления. Как изменяется кислотно-основной характер этих соединений при переходе от лития к фтору?
Билет 1.17
1. Написать электронную формулу 83Bi и: а) подчеркнуть валентные электроны; б) указать электронное семейство, период, группу, подгруппу, в которых находится элемент; в) изобразить графически валентные энергетические уровни; г) охарактеризовать квантовыми числами валентные электроны; д) составить формулу высшего оксида висмута и соответствующего ему гидроксида.
2. Сколько свободных 3d АО имеют возбужденные атомы:
а) Cl; б) V; в) Mn?
3. Вычислить молярную массу и назвать элемент, высший оксид которого отвечает формуле Э2О5, образует с водородом газообразное соединение, массовая доля водорода в котором 8,82 %. (Ответ: 31 г/моль).
Билет 1.18
1. Написать электронную формулу 55Cs и: а) подчеркнуть валентные электроны; б) указать электронное семейство, период, группу, подгруппу, в которых находится элемент; в) изобразить графически валентные энергетические уровни; г) охарактеризовать квантовыми числами валентные электроны; д) составить формулу высшего оксида цезия и соответствующего ему гидроксида.
2. Для каких подуровней сумма (n + l) равна 6: а) 6d, 7s, 3f; б) 7p, 3s, 2p;
в) 6p, 5d, 4p; г) 5f, 4s, 3p; д) 4d, 5p, 6s?
3. Вычислить массовую долю (в %) элементов в высших оксидах:
а) селена; б) рения; в) осмия; г) индия. (Ответ: 62,2%; 76,9%; 74,8%; 82,7%).
Билет 1.19
1. Написать электронную формулу 72Hf и: а) подчеркнуть валентные электроны; б) указать электронное семейство, период, группу, подгруппу, в которых находится элемент; в) изобразить графически валентные энергетические уровни; г) охарактеризовать квантовыми числами валентные электроны; д) составить формулу высшего оксида гафния и соответствующего ему гидроксида.
2. Сколько свободных f-орбиталей содержится в атомах элементов с порядковыми номерами 59, 60, 90, 93? Пользуясь правилом Гунда, распределить электроны по орбиталям для атомов этих элементов.
3. У какого элемента IV периода – хрома или селена сильнее выражены металлические свойства? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивировать строением атомов Cr и Se.
Билет 1.20
1. Написать электронную формулу 56Ba и: а) подчеркнуть валентные электроны; б) указать электронное семейство, период, группу, подгруппу, в которых находится элемент; в) изобразить графически валентные энергетические уровни; г) охарактеризовать квантовыми числами валентные электроны; д) составить формулу высшего оксида бария и соответствующего ему гидроксида.
2. Атомы каких элементов имеют следующее строение внешних электронных слоев: а) 4d45s1; б) 4s24p4. К какому электронному семейству и подгруппе они относятся?
3. Какую низшую степень окисления проявляет водород, фтор, углерод, азот? Составить формулы соединений кальция с данными элементами в этой их степени окисления.
Тема 2
Химическое равновесие
Химическим равновесием называется такое состояние реагирующей системы, при котором скорость прямой реакции равна скорости обратной реакции. Закон действия масс для обратимых процессов: в состоянии химического равновесия при постоянной температуре отношение произведения концентраций продуктов реакции к произведению концентраций исходных веществ есть величина постоянная. Она называется константой равновесияи обозначается Кс. Для реакции nА + mВ ↔ рС + qD константа равновесия имеет вид:
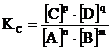 , где
, где
[A], [B], [C], [D] – равновесные концентрации реагирующих веществ;
n, m, p, q – коэффициенты перед веществами А, В, C, D
Химическое равновесие остается неизменным до тех пор, пока условия равновесия (концентрация, температура, давление), при которых оно установилось, сохраняются постоянными. При изменении условий равновесие нарушается. Через некоторое время в системе вновь наступает равновесие, характеризующееся новым равенством скоростей и новыми равновесными концентрациями всех веществ. Переход системы из одного равновесного состояния в другое называется смещением равновесия.
Изменение концентрации
При увеличении концентрации исходных веществ и уменьшении концентрации продуктов реакции равновесие смещается в сторону прямой реакции. При увеличении концентраций продуктов реакции и понижении концентраций исходных веществ равновесие смещается в сторону обратной реакции. Например, в реакции
2СО + О2 ↔ 2СО2
увеличение концентраций СО, О2 (исходные вещества) или уменьшение концентрации СО2 (продукт реакции) приводит к смещению равновесия вправо. Увеличение концентрации СО2 или понижение концентраций исходных веществ СО, О2 смещает равновесие влево.
Изменение температуры
При повышении температуры равновесие смещается в направлении эндотермической, при понижении – в направлении экзотермической реакции. Например, в равновесной системе
N2 + O2 ↔ 2NO. ∆Н0х.р. = 180,5 кДж
прямая реакция эндотермическая, поэтому повышение температуры приводит к смещению химического равновесия в сторону прямой реакции, а понижение температуры – в сторону обратной реакции.
Изменение давления
При повышении давления равновесие смещается в сторону реакции, идущей с уменьшением числа молекул газа, при понижении давления – в сторону реакции, идущей с увеличением числа молекул газа. Так, в системе
N2 + 3H2 ↔ 2NH3
в левой части 4 молекулы, а в правой −2, поэтому при увеличении давления равновесие смещается вправо (там 2 молекулы газа), а при уменьшении влево (4 молекулы газа).
Примеры решения задач
Пример 2.1. При некоторой температуре в системе
N2 (г) + 3Н2 (г) 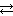 2NH3 (г) равновесные концентрации составляли (моль/л):
2NH3 (г) равновесные концентрации составляли (моль/л):
[N2] = 1,5; [H2] = 1,7; [NH3] = 2,6. Вычислить константу равновесия этой реакции и исходные концентрации азота и водорода.
Решение.Константа равновесия данной реакции выражается уравнением  . Подставляя данные задачи, получаем:
. Подставляя данные задачи, получаем: 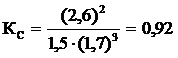 .
.
Исходные концентрации азота и водорода находим на основе уравнения реакции. Согласно уравнению реакции на образование 2 моль NH3 расходуется 1 моль N.2. По условию задачи образовалось 2,6 моль NH3, на что израсходовалось 1,3 моль N2. Учитывая равновесную концентрацию азота, находим его исходную концентрацию: 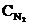 = 1,5 + 1,3 = 2,8 моль/л.
= 1,5 + 1,3 = 2,8 моль/л.
По уравнению реакции на образование 2 моль NH3 необходимо 3 моль H2, а для получения 2,6 моль NH3 требуется 3×2,6 / 2 = 3,9 моль H2. Исходная концентрация водорода СН2 = 1,7 + 3,9 = 5,6 моль/л. Таким образом, КС = 0,92; исходные концентрации 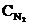 = 2,8 моль/л,
= 2,8 моль/л, 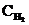 = 5,6 моль/л.
= 5,6 моль/л.
Пример 2.2. Реакция протекает по уравнению А + В 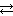 D + F. Определить равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В, соответственно, равны 2 и 1,2 моль/л, а константа равновесия реакции КС = 1.
D + F. Определить равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В, соответственно, равны 2 и 1,2 моль/л, а константа равновесия реакции КС = 1.
Решение. Так как все вещества в данной реакции реагируют в одинаковых соотношениях, обозначим изменение концентрации всех реагирующих веществ через x. К моменту установления равновесия образовалось х моль D и х моль F и соответственно [D] = x; [F] = x. По уравнению реакции на столько же уменьшились концентрации А и В, т. е. [A] = 2 – x; [B] = 1,2 – x. Подставим равновесные концентрации в выражение константы равновесия:
КС= 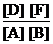 ; 1=
; 1= 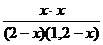 ; х = 0,75.
; х = 0,75.
Отсюда равновесные концентрации: [D] = 0,75 моль/л; [F] = 0,75 моль/л; [A] = 2 – 0,75 = 1,25 моль/л; [B] = 1,2 – 0,75 = 0,45 моль/л.
Пример 2.3. Реакция протекает по уравнению 2SO2 + O2 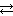 2SO3. В каком направлении сместится химическое равновесие, если объем системы уменьшить в 3 раза?
2SO3. В каком направлении сместится химическое равновесие, если объем системы уменьшить в 3 раза?
Решение. До изменения объема скорости прямой и обратной реакций выражались уравнениями:
vпр = 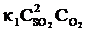 ; vобр =
; vобр = 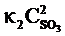 .
.
При уменьшении объема в 3 раза концентрация каждого из реагирующих веществ увеличится в 3 раза. После увеличения концентрации скорость прямой реакции стала: vпр = k1×(3 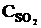 )2×(3
)2×(3 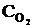 ) = k1× 9
) = k1× 9 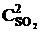 × 3
× 3 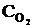 = 27k1
= 27k1 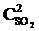
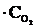 ,
,
т. е. возросла в 27 раз; а скорость обратной – vобр = k2× (3 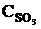 )2 = k2× 9
)2 = k2× 9 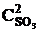 = 9k2
= 9k2 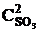 , т. е. возросла в 9 раз. Следовательно, равновесие сместится в сторону прямой реакции (вправо).
, т. е. возросла в 9 раз. Следовательно, равновесие сместится в сторону прямой реакции (вправо).
Пример 2.4. В какую сторону сместится химическое равновесие реакции А + В 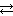 D, если повысить температуру на 30 оС? Температурные коэффициенты скорости прямой и обратной реакции, соответственно, равны 2 и 3.
D, если повысить температуру на 30 оС? Температурные коэффициенты скорости прямой и обратной реакции, соответственно, равны 2 и 3.
Решение. При повышении температуры на 30° скорость прямой реакции возрастет в 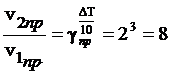 раз, а скорость обратной в
раз, а скорость обратной в 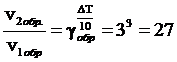 раз. Так как скорость обратной реакции возросла в 27 раз, а скорость прямой в 8 раз, то равновесие этой реакции при повышении температуры сместится в сторону обратной реакции (влево).
раз. Так как скорость обратной реакции возросла в 27 раз, а скорость прямой в 8 раз, то равновесие этой реакции при повышении температуры сместится в сторону обратной реакции (влево).
Пример 2.5. Как изменятся скорости прямой и обратной реакции, если в системе 2NO (г) + О2 (г) 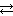 2NO2 (г) уменьшить давление в 2 раза? Произойдет ли при этом смещение равновесия? Если да, то в какую сторону?
2NO2 (г) уменьшить давление в 2 раза? Произойдет ли при этом смещение равновесия? Если да, то в какую сторону?
Решение. До уменьшения давления выражения для скорости прямой и обратной реакции имели вид vпр = k1 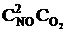 , vобр = k2
, vобр = k2 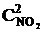 .
.
При уменьшении давления в 2 раза концентрации каждого из реагирующих веществ уменьшаются в 2 раза, так как общий объем системы увеличивается в 2 раза. Тогда
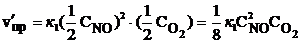 ;
; 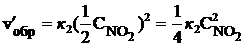 .
.
В результате уменьшения давления скорость прямой реакции уменьшилась в 8 раз, а скорость обратной – в 4 раза. Таким образом, скорость обратной реакции будет в 2 раза больше, чем прямой, и смещение равновесия произойдет в сторону обратной реакции, т. е. в сторону разложения NO2.
Пример 2.6. В каком направлении сместится равновесие реакции
COCl2 ↔ СО + Cl2, ∆H0х.р. = +112,5 кДж а) при повышении давления;
б) с понижением температуры; в) при уменьшении концентрации хлора.
Решение. а) При повышении давления равновесие смещается в сторону реакции, идущей с уменьшением числа молекул газа, при понижении давления – в сторону реакции, идущей с увеличением числа молекул газа. В левой части приведенной реакции 1 молекула (COCl2), а в правой – 2 (1 СО + 1 Cl2), поэтому при повышении давления равновесие смещается в сторону обратной реакции;
б) При понижении температуры равновесие смещается в сторону экзотермической реакции, при повышении температуры – в сторону эндотермической. В нашем примере прямая реакция эндотермическая (∆H0х.р. > 0), а обратная – экзотермическая, следовательно, при понижении температуры равновесие сместится в сторону обратной реакции;
в) При увеличении концентрации исходных веществ и уменьшении концентрации продуктов реакции равновесие смещается в сторону продуктов реакции. При уменьшении концентрации хлора (продукта реакции) равновесие сместится в сторону прямой реакции, т.е. в сторону образования продуктов реакции.
Задачи
2.1. При нагревании диоксида азота в закрытом сосуде до некоторой температуры равновесие реакции 2NO2 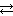 2NO + O2 установилось при следующих концентрациях: [NO2] = 0,4 моль/л; [NO] = 1 моль/л; [O2] = 0,5 моль/л. Вычислить константу равновесия для этой температуры и исходную концентрацию диоксида азота. (Ответ: 3,125; 1,4 моль/л).
2NO + O2 установилось при следующих концентрациях: [NO2] = 0,4 моль/л; [NO] = 1 моль/л; [O2] = 0,5 моль/л. Вычислить константу равновесия для этой температуры и исходную концентрацию диоксида азота. (Ответ: 3,125; 1,4 моль/л).
2.2. Реакция протекает по уравнению АВ 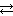 А + В. При некоторой температуре из 1 моль АВ, находящегося в закрытом сосуде емкостью 20 л, разлагается 0,6 моль АВ. Определить константу равновесия. (Ответ: 0,045).
А + В. При некоторой температуре из 1 моль АВ, находящегося в закрытом сосуде емкостью 20 л, разлагается 0,6 моль АВ. Определить константу равновесия. (Ответ: 0,045).
2.3.Константа равновесия реакции N2O4 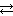 2NO2 равна 0,16 при 375 К. Равновесная концентрация NO2 равна 0,09 моль/л. Вычислить равновесную концентрацию N2O4. (Ответ: 0,051 моль/л).
2NO2 равна 0,16 при 375 К. Равновесная концентрация NO2 равна 0,09 моль/л. Вычислить равновесную концентрацию N2O4. (Ответ: 0,051 моль/л).
2.4. Рассчитать равновесную концентрацию О3 и константу равновесия в реакции 3О2 (г) 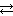 2О3 (г), если начальная масса О2 равна 24 г, а равновесная концентрация О2 равна 0,6 моль/л. (Ответ: 0,1 моль/л; 0,046).
2О3 (г), если начальная масса О2 равна 24 г, а равновесная концентрация О2 равна 0,6 моль/л. (Ответ: 0,1 моль/л; 0,046).
2.5. Используя справочные данные табл. 1 приложения, рассчитать ΔН0х.р. реакции, протекающей по уравнению 2NO2 (г) 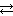 2NO (г) + O2 (г) и определить, в какую сторону сместится равновесие при охлаждении системы.
2NO (г) + O2 (г) и определить, в какую сторону сместится равновесие при охлаждении системы.
2.6. Рассчитать равновесные концентрации газообразных веществ в гетерогенной системе FeO (к) + CO (г) 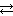 Fe (к) + CO2 (г), если начальная концентрация СО составляла 2 моль/л, константа равновесия КС = 0,6.
Fe (к) + CO2 (г), если начальная концентрация СО составляла 2 моль/л, константа равновесия КС = 0,6.
(Ответ: 1,25 моль/л; 0,75 моль/л.).
2.7. При состоянии равновесия системы N2 + 3H2 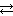 2NH3 концентрации веществ были (моль/л): [N2] = 0,3; [H2] = 0,9; [NH3] = 0,4. Рассчитать, как изменятся скорости прямой и обратной реакции, если концентрации всех участвующих в реакции веществ увеличить в 4 раза. В каком направлении сместится равновесие? (Ответ: 256; 16).
2NH3 концентрации веществ были (моль/л): [N2] = 0,3; [H2] = 0,9; [NH3] = 0,4. Рассчитать, как изменятся скорости прямой и обратной реакции, если концентрации всех участвующих в реакции веществ увеличить в 4 раза. В каком направлении сместится равновесие? (Ответ: 256; 16).
2.8. Вычислить константу равновесия для гомогенной системы:
CO (г) + H2O (г)  СO2 (г) + H2 (г), если равновесные концентрации реагирующих веществ (моль/л): [CO] = 0,004; [H2O] = 0,064; [CO2] = 0,016, [H2] = 0,016. Чему равны исходные концентрации воды и СО?
СO2 (г) + H2 (г), если равновесные концентрации реагирующих веществ (моль/л): [CO] = 0,004; [H2O] = 0,064; [CO2] = 0,016, [H2] = 0,016. Чему равны исходные концентрации воды и СО?
(Ответ: 1; 0,08 моль/л; 0,02 моль/л).
2.9. В начальный момент протекания реакции
NiO (к) + Н2 (г) 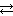 Ni (к) + H2O (г) концентрации были равны (моль/л):
Ni (к) + H2O (г) концентрации были равны (моль/л): 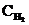 = 0,5;
= 0,5; 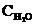 = 1,7. Рассчитать равновесные концентрации газообразных веществ, если КС = 5,66. (Ответ: 0,33 моль/л; 1,87 моль/л).
= 1,7. Рассчитать равновесные концентрации газообразных веществ, если КС = 5,66. (Ответ: 0,33 моль/л; 1,87 моль/л).
2.10. В реакторе при некоторой температуре протекает реакция
СО2 + Н2  СО + Н2О. Определить константу равновесия, если в начальный момент
СО + Н2О. Определить константу равновесия, если в начальный момент 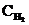 = 2,15 моль/л,
= 2,15 моль/л, 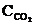 = 1,25 моль/л, а к моменту равновесия прореагировало 60 % начального количества СО2. (Ответ: 0,8).
= 1,25 моль/л, а к моменту равновесия прореагировало 60 % начального количества СО2. (Ответ: 0,8).
2.11. Определить, в какую сторону произойдет смещение равновесия реакции CO2 (г) + 4Н2 (г)  СН4 (г) + 2Н2О (г), ∆Н0х.р = -165 кДж
СН4 (г) + 2Н2О (г), ∆Н0х.р = -165 кДж
при следующих воздействиях: а) увеличении давления; б) повышении концентрации СО2; в) понижении температуры.
2.12. В гомогенной системе установилось равновесие
2H2S + 3O2 ↔ 2SO2 + 2H2O. Константа равновесия КС = 3∙105. Исходные вещества или продукты реакции будут преобладать в равновесной смеси веществ?
Вычислить равновесную концентрацию диоксида серы, если равновесные концентрации веществ, участвующих в реакции, равны (моль/л):
[H2S] = 0,02; [O2] = 0,30; [H2O] = 0,40. (Ответ: 4,5 моль/л).
2.13. Рассчитать КС реакции PCl5 (г)  PCl3 (г) + Cl2 (г) при 500 К, если к моменту равновесия разложилось 54 % PCl5, а исходная концентрация PCl5 была равна 1 моль/л. (Ответ: 0,634).
PCl3 (г) + Cl2 (г) при 500 К, если к моменту равновесия разложилось 54 % PCl5, а исходная концентрация PCl5 была равна 1 моль/л. (Ответ: 0,634).
2.14. После смешивания газов А и В в системе А (г) + В (г)  С (г) +D (г) устанавливается равновесие при следующих концентрациях: [B] = 0,5 моль/л; [C] = 0,2 моль/л. Константа равновесия реакции равна 4×10-2. Найти исходные концентрации вещества А и В. (Ответ: 2,2 моль/л; 0,7 моль/л).
С (г) +D (г) устанавливается равновесие при следующих концентрациях: [B] = 0,5 моль/л; [C] = 0,2 моль/л. Константа равновесия реакции равна 4×10-2. Найти исходные концентрации вещества А и В. (Ответ: 2,2 моль/л; 0,7 моль/л).
2.15. Система С (графит) + СО2 (г)  2СО (г), DН0х.р = 172,5 кДж
2СО (г), DН0х.р = 172,5 кДж
находится в состоянии равновесия. Как повлияет на равновесие системы:
а) повыш
