Периодичность геометрических и энергетических характеристик атомов
Атомный радиус. Квантовая механика показала, что атомы и ионы не имеют определённых границ, поэтому измерить абсолютные размеры атомов невозможно.
За радиус свободного атома можно принять теоретически рассчитанное положение главного максимума плотности внешних электронных облаков. Это так называемый орбитальный радиус. Для любого атома может быть только один орбитальный радиус в нормальном состоянии.
При изучении строения молекул и кристаллов атомы и ионы можно рассматривать как имеющие некий эффективный радиус, зависящий не только от природы атомов, но и от типа химической связи, поэтому для одного и того же элемента он может иметь разные значения. Эффективные радиусы определялись из экспериментальных данных по
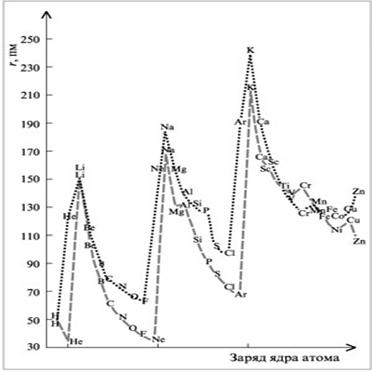
Рис. 1.4. Зависимость орбитальных(----) и эффективных (∙∙∙∙) атомных радиусов от атомного номера элемента
межъядерным расстояниям в молекулах и кристаллах. Из сказанного следует, что орбитальный радиус ближе к истинному размеру атома, чем эффективный.Изменение орбитальных и эффективных атомных радиусов элементов носит периодический характер (рис. 1.4).В периодах орбитальные атомные радиусы по мере увеличения заряда ядра Z уменьшаются.
Наибольшее уменьшение радиусов наблюдается в ряду р- элементов. В пределах каждого ряда наибольшим орбитальным радиусом обладает щелочной металл, а наименьшим − атомы благородных газов (сравните: rLi = 0,159 нм; rNe.= 0,032 нм).
В рядах d- и f-элементов уменьшение радиусов носит название d- и f- сжатия. В отличие от р- элементов оно не
столь заметно, так как идёт заполнение электронами внутренних слоёв (сравните: rSc = 0,157 нм; rZn = 0,107 нм).
В подгруппах радиусы в основном увеличиваются из-за возрастания числа электронных слоёв n.
Наибольшее изменение радиусов, как и в периодах, наблюдается в группах s– и р– элементов, а у d- элементов ме-
таллические радиусы (нм) электронных аналогов V и VI периодов под влиянием лантаноидного сжатия практически одинаковы, что определяет близость свойств этих элементов и нахождение в природе в одних породах
| Период | Элемент | Радиус | Элемент | Радиус | Элемент | Радиус |
| IV | Ti | 0,147 | V | 0,135 | Cr | 0,129 |
| V | Zr | 0,160 | Nb | 0,147 | Mo | 0,140 |
| VI | Hf | 0,159 | Ta | 0,147 | W | 0,141 |
Энергия ионизации
Энергией ионизации (I) называется количество энергии, необходимое для удаления электрона с внешнего уровня нейтрального атома.
I выражается в кДж∙моль‾¹ или эВ∙атом‾¹. Значения І в электронвольтах численно равны потенциалу ионизации, выраженному в вольтах, поскольку Е = ē I.
Можно говорить о первой I1, второй, I2 третьей I3 и т.д. энергиях ионизации:
Э – ē= Э+ I1 первая энергия ионизации;
Э+ – ē = Э2+ I2 вторая энергия ионизации,
при этом значение I1 ‹ I2 ‹ I3… и резко возрастает при переходе от наружного к внутреннему энергетическому уровню. Так, атом р-элемента бора имеет следующие последовательные энергии ионизации (эВ):
8,31; 23,15; 37,92; 259,3; 340,13,
откуда следует, что у него во внешнем валентном слое всего три электрона и, следовательно, он относится к III группе.
Энергии ионизации отражают дискретность структуры
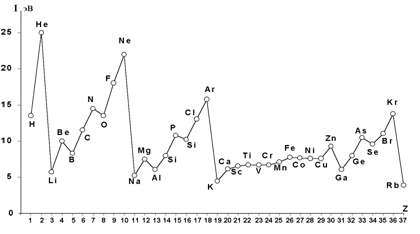
Рис. 1.5. Зависимость первых энергий ионизации атомов от порядкового номера элемента.
электронных уровней и подуровней (второе положение квантовой механики).
Периодическая зависимость первых энергий ионизации I1 атомов от порядкового номера элемента Z аналогична изменению атомных радиусов и, как видно из рис. 1.5, для р- элементов определяется размерами атома и электронной конфигурацией.
Общие тенденции изменения энергий ионизации следующие: в группах сверху вниз с увеличением числа электронных слоёв и ростом атомного радиуса энергия ионизации понижается; в периодах с увеличением заряда ядра и уменьшением атомного радиуса растёт.
Наибольшие величины I1 (15 – 25 эВ) у элементов с электронной конфигурацией s2р6 (благородные газы), а наименьшие (4 – 5 эВ) у щелочных металлов (s1). Повышенные значения энергий ионизации наблюдаются у атомов с наполовину и полностью заполненными оболочками. Так у бериллия и магния (s2), азота и фосфора (s²p³), энергии ионизации больше, чем у следующих за ними бора и алюминия (s2р1), кислорода и серы (s2p4).
Для элементов переходных рядов рост энергий ионизации не столь заметен и имеет более сложный характер. Среди d- элементов сравнительно большими значениями энергий ионизации характеризуются металлы, следующие за лантаноидами, что объясняется проникновением 6s- электронов под двойной экран из 5d и 4f- электронов.
Энергия ионизации определяет восстановительные свойства элементов
Энергия ионизации определяет характер и прочность химической связи и восстановительные свойства элементов.
Энергия ионизации изменяется периодически по мере заполнения электронами оболочек атомов (рис. 1.5).
Наибольшие величины I (15 – 25 эВ) у элементов с электронной конфигурацией s2р6 (благородные газы), а наименьшие (4 – 5 эВ) у щелочных металлов (s1). Повышенные значения I наблюдаются у атомов с наполовину и полностью заполненными оболочками. Так у бериллия и магния (s2), азота и фосфора (s²p³), потенциалы (энергии) ионизации больше, чем у следующих за ними бора и алюминия (s2р1), кислорода и серы (s2p4).
Энергия сродства к электрону (Еср.) – энергия, выделяющаяся при присоединении электрона к нейтральному атому
Э + ē = Эˉ –∆Н = Е ср.
Сродство к электрону зависит от размеров атома, его электронной конфигурации и определяет окислительные свойства элемента. Наибольшим сродством к электрону и, следовательно, наибольшей окислительной способностью обладают атомы с малым радиусом и электронной конфигурацией, легко достраиваемой до октета − р- элементы VII и VI групп, например, фтор → F + ē = F- , (s2p5 + ē = s2p6), Еср. = 3,45 эВ. В периоде Еср увеличивается слева направо, в группе − снизу вверх.
Наименьшим и даже отрицательным сродством обладают нейтральные атомы с устойчивыми конфигурациями s2, s2p6 иs2p3.
Экспериментальное определение энергии сродства к электрону значительно сложнее, нежели энергии ионизации. Величины Еср., эВ для некоторых атомов приведены ниже:
H He Li Be B C N O F Ne
0,75 –0,22 0,8 –0,19 0,30 1,27 0,05 1,47 3,45 –0,57
Немонотонность изменения энергии сродства к электрону в периоде обусловлена повышенной устойчивостью полностью и наполовину заполненных подуровней.
Отметим, что присоединение двух и более электронов к нейтральному атому энергетически затруднено, и многозарядные одноатомные анионы в свободном состоянии не существуют
Электроотрицательность
Энергия ионизации и сродство к электрону относятся к свойствам свободных атомов в газовой сфере. Электроотрицательность(ЭО, χ) является характеристикой атомов, объединённых в молекулы или другие соединения, и позволяет оценить способность атома оттягивать на себя электронную плотность при образовании химической связи.
Чем больше энергия ионизации, тем прочнее атом удерживает электрон. С другой стороны, чем больше сродство к электрону, тем энергетически выгоднее данному атому присоединить электрон. Электроотрицательность атома зависит как от энергии ионизации, так и от сродства к электрону.
Согласно Малликену электроотрицательность χможно определить как полусумму энергий ионизации и сродства к электрону: χ =½(Iион + Еср) эВ
В относительной шкале электроотрицательностей по Полингу (OЭO) электроотрицательности атомов определены по отношению к ЭО фтора (рис. 1.6).
| группа | I | II | III | IV | V | VI | VII | VIII | |||
| период | |||||||||||
| H 2,1 | He - | ||||||||||
| Li 0,97 | Be 1,47 | B 2,01 | C 2,50 | N 3,07 | O 3,5 | F 4,10 | Ne - | ||||
| Na 1,01 | Mg 1,23 | Al 1,47 | Si 1,74 | P 2,1 | S 2,6 | Cl 2,83 | Ar - | ||||
| K 0,91 | Ca 1,04 | Sc 1,20 | Ti 1,32 | V 1,45 | Cr 1,56 | Mn 1,60 | Fe 1,64 | Co 1,70 | Ni 1,75 | ||
| Cu 1,75 | Zn 1,66 | Ga 1,82 | Ge 2,02 | As 2,20 | Se 2,48 | Br 2,74 | Kr - | ||||
| Rb 0,89 | Sr 0,99 | Y 1,11 | Zr 1,22 | Nb 1,23 | Mo 1,30 | Tc 1,36 | Ru 1,42 | Rh 1,45 | Pd 1,35 | ||
| Ag 1,42 | Cd 1,46 | In 1,49 | Sn 1,72 | Sb 1,82 | Te 2,01 | I 2,21 | Xe - | ||||
| Cs 0,86 | Ba 0,97 | La* 1,08 | Hf 1,23 | Ta 1,33 | W 1,40 | Re 1,46 | Os 1,52 | Ir 1,55 | Pt 1,44 | ||
| Au 1,42 | Hg 1,44 | Tl 1,44 | Pb 1,55 | Bi 1,67 | Po 1,76 | At 1,90 | Rn - | ||||
| Fr 0,86 | Ra 0,97 | Ac** 1,00 | *Лантаноиды - 1,08 - 1,14 **Актиноиды - 1,11 - 1,20 |
Рис. 1.6. Относительные электроотрицательности элементов (по Полингу)
В периодах слева направо ЭО заметно растет. Наиболее электроотрицательные элементы сосредоточены в верхней правой части периодической системы, самым электроотрицательным элементом является фтор. В группах однотипных элементов с ростом Z наблюдается менее выраженная тенденция к понижению электроотрицательности. В периодической системе ЭО растет по диагонали от Cs к F. Это обстоятельство определяет диагональное сродство элементов.
Электроотрицательность зависит от состояния элемента в соединениях и увеличивается с ростом степени окисления элемента,например:
Tl (I) 1,62 Pb (II) 1,87 Fe (II) 1,83
Tl (III) 2,04 Pb (IV) 2,33 Fe (III) 1,96
(значенияχ приведены по шкале Полинга).
Разность значений электроотрицательностейслужит хорошим показателем для предсказания полярности связей в молекулах. При разности ЭО > 1,9 связь может считаться ионной, при разности 0,4 – 1,9 имеем полярную связь и при ∆ЭО < 0,4 связь считается чисто ковалентной (неполярной).
Кислотно-основные свойства соединений определяются атомным радиусом, электроотрицательностью, степенью окисления элементов и зависят от положения последних в периодической таблице.
Кислотно-основные свойства соединений, содержащих группировку Э-О-Н (гидроксидов), определяются относительной прочностью связей Э-О и О-Н. Если связь Э-О прочнее связи О-Н, то гидроксид диссоциирует по кислотному типу
Э-О — Н → Э-О– + Н+.
Если прочнее связь О-Н, то соединение диссоциирует как основание Э — О-Н → Э+ + ОН–.
Для одного и того же элемента связь Э-О тем прочнее, чем больше степень окисления и меньше длина связи (радиус элемента).
Ниже сформулированы некоторые закономерности в изменении кислотно-основных свойств гидроксидов элементов:
1. С увеличением положительной степени окисления уменьшается радиус элемента (длина связи Э-О), поэтому кислотные свойства гидроксидов усиливаются, основные падают.
2. При одинаковой степени окисления кислотные свойства гидроксидов в группе сверху вниз уменьшаются вследствие роста эффективного радиуса элемента (Э−О-Н).
3. В периоде слева направо кислотные свойства гидроксидов растут, а основные уменьшаются. Это связано с уменьшением радиуса элемента и соответственно длины связи Э-О, что увеличивает длину и ионность связи О-Н.
4. В низшей степени окисления гидроксиды элементов, как правило, проявляют основные свойства, в высшей – кислотные, в промежуточных степенях окисления – амфотерные.
Более подробно о кислотно-основных свойствах элементов читайте в разделе «Обзор элементов ПС».
