Тема 9. Окислительно-восстановительные процессы в химии
9-1. Степенью окисления называется
а) валентность атома в соединении
б) число электронов, которые находятся у атома на внешнем слое
в) формальный заряд атома в молекуле, вычисленный исходя из предположения, что все связи являются ионными
г) число электронов, которые участвуют в образовании всех химических связей в молекуле
9-2. Окислителем называется частица (атом или ион), которая
а) принимает электроны в окислительно-восстановительном процессе
б) отдает электроны в окислительно-восстановительном процессе
в) соединяется с другими атомами в ходе химической реакции
г) обменивается с другими молекулами своими составными частями
9-3. Восстановителем называется частица (атом или ион), которая
а) принимает электроны в окислительно-восстановительном процессе
б) отдает электроны в окислительно-восстановительном процессе
в) соединяется с другими атомами в ходе химической реакции
г) обменивается с другими молекулами своими составными частями
9-4. Окислением называется процесс, в котором
а) атом или ион отдает электроны
б) атом или ион принимает электроны
в) атом или ион присоединяет к себе другие атомы или ионы
г) молекула или ион обменивается с другими молекулами или ионами своими составными частями
9-5. Потенциал стандартного водородного электрода
а) имеет абсолютное значение 0 В
б) имеет относительно значение 0 В
в) условно принят равным 0 В
г) отличается от 0 при стандартных условиях
9-6. Величина электродного потенциала при стандартной температуре вычисляется по формуле
а) 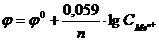 | в) 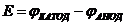 | д) 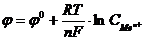 |
б) 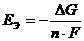 | г) 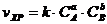 |
9-7. Электродным потенциалом называется потенциал, установившийся
а) на границе между поверхностью металла и внутренним слоем металла
б) между поверхностью металла и близлежащим слоем раствора в двойном электрическом слое
в) перед его погружением в раствор
г) при соединении металла с другими металлами
9-8. Окислительно-восстановительные реакции – это реакции, в которых
а) изменяется степень окисления элементов
б) не изменяется степень окисления элементов
в) происходит обмен составными частями молекул
г) происходит разложение веществ
9-9. Окислитель в ходе окислительно-восстановительного процесса
| а) восстанавливается | в) соединяется |
| б) окисляется | г) разлагается |
9-10. Восстановитель в ходе окислительно-восстановительного процесса
| а) восстанавливается | в) соединяется |
| б) окисляется | г) разлагается |
9-11. Электродный потенциал возникает при погружении металла в раствор
а) между атомами металла, находящимися на поверхности, и находящимися внутри компактного металла
б) между атомами металла, находящимися внутри и раствором
в) на поверхности металла
г) в двойном электрическом слое, образующемся на границе между металлом и раствором
9-12. Абсолютное значение электродного потенциала измерить
а) нельзя ни при каких условиях
б) можно только при стандартных условиях
в) можно только в специальных условиях
г) нельзя только при стандартных условиях
9-13. Стандартным электродным потенциалом металла называется потенциал,
а) установившийся на границе металл–раствор при погружении металла в раствор собственной соли с концентрацией 1 моль/л
б) установившийся на границе металл–раствор при погружении металла в раствор собственной соли, и измеренный с помощью вольтметра
в) металла, погруженного в раствор собственной соли со стандартной концентрацией ионов металла, и измеренный относительно водородного электрода при стандартных условиях
г) вычисленный по уравнению Нернста при стандартных условиях
9-14. Стандартные электродные потенциалы измеряют по отношению к
а) потенциалу Земли
б) стандартному водородному электроду
в) стандартному металлическому электроду
г) эталону электродного потенциала
9-15. Более активными, чем водород, являются металлы, стандартный электродный потенциал 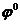 которых
которых
а) более положителен, чем у водорода
б) более отрицателен, чем у водорода
в) совпадает с потенциалом водорода
г) больше, чем потенциал других металлов
9-16. Менее активными, чем водород, являются металлы, стандартный электродный потенциал которых
а) более положителен, чем у водорода
б) более отрицателен, чем у водорода
в) совпадает с потенциалом водорода
г) больше, чем потенциал других металлов
9-17. Металлы, стандартный электродный потенциал которых имеет отрицательную величину,
а) могут вытеснять водород из кислот
б) не могут вытеснять водород из кислот
в) могут вытеснять собственные катионы из растворов солей
г) могут взаимодействовать с другими металлами
9-18. Восстановительная активность металла
а) возрастает с уменьшением величины его электродного потенциала
б) возрастает с увеличение величины его электродного потенциала
в) убывает с уменьшением величины его электродного потенциала
г) убывает с увеличением величины его электродного потенциала
9-19. Возникновение электродного потенциала на цинке показано на рисунке
| а) |  | в) |  |
| б) |  | г) |  |
9-20. Процесс установления равновесия на медном электроде отражает уравнение
| а) Cu0 + 2e D Cu+2 | в) Cu0 – 2e D Cu–2 |
| б) Cu0 +2e D Cu–2 | г) Cu0 – 2e D Cu+2 |
9-21. Азот имеет степень окисления +3 в соединении
| а) NH3 | б) N2 | в) HNO2 | г) HNO3 |
9-22. Азот имеет степень окисления 0 в соединении
| а) NH3 | б) N2 | в) HNO2 | г) HNO3 |
9-23. Азот имеет степень окисления –3 в соединении
| а) NH3 | б) N2 | в) HNO2 | г) HNO3 |
9-24. Азот имеет степень окисления +5 в соединении
| а) NH3 | б) N2 | в) HNO2 | г) HNO3 |
9-25. Сера имеет степень окисления –2 в соединении
| а) H2S | б) S | в) H2SO3 | г) H2SO4 | д) H2S2O7 |
9-26. Азот N2 в реакции N2 + 3H2 " 2NH3 является
| а) окислителем | в) соединителем |
| б) восстановителем | г) заместителем |
9-27. Водород H2 в реакции N2 + 3H2 " 2NH3 является
| а) окислителем | в) соединителем |
| б) восстановителем | г) заместителем |
9-28. Цинк Zn в реакции Zn + 2HCl " ZnCl2 + H2# является
| а) окислителем | в) соединителем |
| б) восстановителем | г) заместителем |
9-29. Окислителем в реакции Zn + 2HCl " ZnCl2 + H2# является
| а) Zn | б) Zn2+ | в) H2# | г) H+ | д) Cl– |
9-30. Величина электродного потенциала металла зависит от
а) природы металла
б)атмосферного давления
в) концентрации ионов металла в растворе
г) температуры
д) величины числа Фарадея
9-31. Верно утверждение: значение электродного потенциала
а) можно вычислить по формуле Нернста
б) можно измерить при стандартных условиях
в) можно измерить в специальных условиях
г) нельзя измерить ни при каких условиях
9-32. Процесс окисления в реакции Ca + S = CaS описывается уравнением
| а) Ca0 – 2e– " Ca+2 | в) Ca+2 + 2e " Ca0 | д) S0 + 2e " S–2 |
| б) Ca0 + 2e " Ca+2 | г) S0 – 2e " S+2 |
9-33. Процесс восстановления в реакции Ca + S = CaS описывается уравнением
| а) Ca0 – 2e– " Ca+2 | в) Ca+2 + 2e " Ca0 | д) S0 + 2e " S–2 |
| б) Ca0 + 2e " Ca+2 | г) S0 – 2e " S+2 |
9-34. Соответствие обозначений в уравнении Нернста 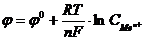 и их физического смысла
и их физического смысла
| 1) | 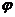 | а) | электродный потенциал |
| 2) | 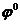 | б) | стандартный электродный потенциал |
| 3) | 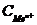 | в) | концентрация ионов металла |
| 4) | 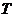 | г) | абсолютная температура |
| 5) | 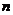 | д) | число электронов, участвующих в равновесном процесс |
| е) | стандартный водородный потенциал | ||
| ж) | универсальная газовая постоянная |
9-35. Наиболее сильными восстановительными свойствами обладает
а) марганец ( 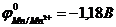 ) ) | в) кадмий ( 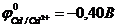 ) ) |
б) цинк ( 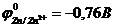 ) ) | г) свинец ( 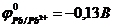 ) ) |
9-36. Наиболее слабыми восстановительными свойствами обладает
а) цинк ( 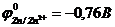 ) ) | в) свинец ( 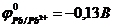 ) ) |
б) кадмий ( 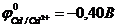 ) ) | г) медь ( 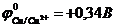 ) ) |
9-37. Будет вытеснять водород из кислот
а) свинец ( 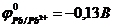 ) ) | в) висмут ( 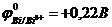 ) ) |
б) 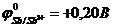 | г) медь ( 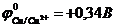 ) ) |
9-38. Потенциал водородного электрода равен нулю при температуре
| а) 273 К | б) 293 К | в) 298 К | г) 215 К |
9-39. Наиболее слабыми восстановительными свойствами обладает
а) марганец ( 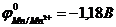 ) ) | в) кадмий ( 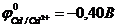 ) ) |
б) цинк ( 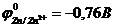 ) ) | г) свинец ( 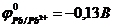 ) ) |
9-40. Наиболее сильными восстановительными свойствами обладает
а) цинк 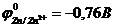 ) ) | в) свинец ( 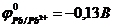 ) ) |
б) кадмий ( 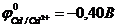 ) ) | г) медь ( 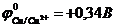 ) ) |
9-41. Потенциал водородного электрода равен 0 В при концентрации ионов водорода
| а) 1 | б) 2 | в) 10 | г) 0,1 |
9-42. Восстановительные свойства металлов усиливаются в ряду
а) 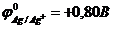 | в) 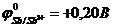 | д) 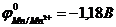 |
б) 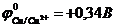 | г) 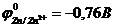 |
9-43. Потенциал серебряного электрода при стандартной температуре и концентрации ионов Ag+ в растворе 0,1 моль/л, ( 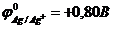 )
)
| а) 0,741 В | б) 0,7705 В | в) 0,80 В | г) 0,859 В |
9-44. Потенциал железного электрода, погруженного в раствор соли двухвалентного железа с концентрацией ионов железа 0,01 моль/л, при стандартной температуре, ( 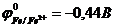 ).
).
| а) –0,499 В | б) –0,381 В | в) –0,558 В | г) –0,322 В |
9-45. Восстанавливать кадмий из водных растворов солей НЕ будут ( 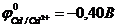 )
)
а) железо ( 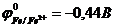 ) ) | в) свинец ( 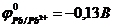 ) ) |
б) сурьма ( 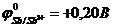 ) ) | г) хром ( 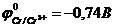 ) ) |
9-46. Металлическая медь будет в водных раствора вытеснять металл из солей, ( 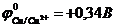 ,
, 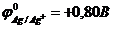 ,
, 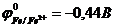 ,
, 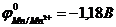 ,
, 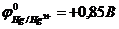 )
)
| а) нитрат железа (II | г) нитрат серебра |
| б) нитрат марганца (II) | д) нитрат меди (II) |
| в) нитрат ртути (II) |
9-47. Потенциал водородного электрода в растворе HCl с концентрацией 1×10–4 моль/л при стандартной температуре
| а) 0 В | в) –0,236 В | д) 0,118 В |
| б) 0,04 В | г) 0,236 В |
9-48. Электродвижущая сила гальванического элемента вычисляется по формуле:
а) 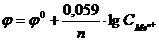 | в) 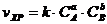 |
б) 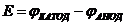 | г) 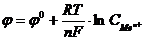 |
9-49. Гальваническим элементом называется устройство для
а) пропускания электрического тока через раствор или расплав веществ
б) превращения энергии окислительно-восстановительных реакций в электрическую энергию
в) превращения энергии электрического тока в химическую энергию
г) превращения энергии реакции нейтрализации в электрическую энергию
9-50. Гальванический элемент является источником тока
| а) первичным | в) основным |
| б) вторичным | г) третичным |
9-51. Аккумулятор является источником тока
| а) первичным | в) основным |
| б) вторичным | г) третичным |
9-52. Анод гальванического элемента
| а) заряжен положительно | в) нейтрален |
| б) заряжен отрицательно | г) знак заряда изменяется при работе элемента |
9-53. Катод гальванического элемента
| а) заряжен положительно | в) нейтрален |
| б) заряжен отрицательно | г) знак заряда изменяется при работе элемента |
9-54. В гальваническом элементе катод и анод погружены в раствор
| а) неэлектролита | в) электролита |
| б) воды | г) органического растворителя |
9-55. Катодом в гальваническом элементе является металл с
а) более отрицательным потенциалом
б) более положительным потенциалом
в) большей атомной массой
г) меньшим радиусом атома
9-56. Анодом в гальваническом элементе является металл с
а) более отрицательным потенциалом
б) более положительным потенциалом
в) большей атомной массой
г) меньшим радиусом атома
9-57. Электродвижущая сила гальванического элемента равна разности
а) электродных потенциалов катода и анода
б) электродных потенциалов анода и катода
в) потенциалов приложенного тока
г) потенциалов ионизации материала анода и материала катода.
9-58. Схема гальванического элемента начинается с записи
| а) анода | б) катода | в) электрода | г) ЭДС |
9-59. Анодная реакция в гальваническом элементе Даниеля – Якоби:
| а) Zn0 – 2e = Zn2+ | в) Zn0 + Cu2+ = Zn2+ + Cu0 |
| б) Cu2+ + 2e = Cu0 | г) Zn2+ + 2e = Zn0 |
9-60. Токообразующая реакция в гальваническом элементе Даниеля – Якоби:
| а) Zn0 – 2e = Zn2+ | в) Zn0 + Cu2+ = Zn2+ + Cu0 |
| б) Cu2+ + 2e = Cu0 | г) Zn2+ + 2e = Zn0 |
9-61. Значения стандартного электродного потенциала 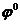 измеряются относительно ...электрода
измеряются относительно ...электрода
| а) ртутного | в) стеклянного |
| б) водородного | г) хлорсеребряного |
9-62. Процесс ... протекает на аноде гальванического элемента
| а) окисления | в) нейтрализации |
| б) восстановления | г) гибридизации |
9-63. Процесс ... протекает на катоде гальванического элемента
| а) окисления | в) нейтрализации |
| б) восстановления | г) гибридизации |
9-64. Условие работы гальванического элемента:
а) 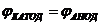 | в) 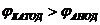 |
б) 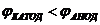 | г) 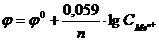 |
9-65. Анодом в гальваническом элементе с железным катодом ( 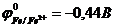 ) будут
) будут
а) никель ( 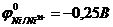 ). ). | в) ртуть ( 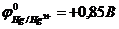 ) ) |
б) алюминий ( 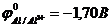 ) ) | г) цинк ( 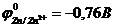 ) ) |
9-66. Никель ( 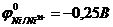 ) будет катодом гальванического элемента в паре с
) будет катодом гальванического элемента в паре с
а) кадмием ( 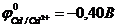 ) ) | в) свинцом ( 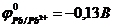 ) ) |
б) медью ( 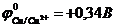 ) ) | г) серебром ( 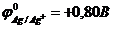 ) ) |
9-67. Катодная реакция в гальваническом элементе Ni |Ni2+ || Pb2+ |Pb ( 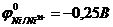 ,
, 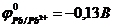 ):
):
| а) Ni0 – 2e = Ni2+ | в) Pb0 – 2e = Pb2+ |
| б) Ni2+ + 2e = Ni0 | г) Pb2+ + 2e = Pb0 |
9-68. Соответствие между словами и схемами
| 1) | никель – анод | а) | Ni | Ni2+ || Cu2+ | Cu |
| 2) | никель – катод | б) | Fe | Fe2+ || Ni2+ | Ni |
| 3) | свинец – анод | в) | Pb | Pb2+ || Ag+ | Ag |
| 4) | свинец – катод | г) | Zn | Zn2+ || Pb2+ | Pb |
| д) | Zn | Zn2+ || Ag+ | Ag |
9-69. Соответствие между токообразующими реакциями в гальваническом элементе и схемами элементов
| 1) | Zn0 + Cu2+ " Zn2+ + Cu0 | а) | Zn | Zn2+ || Cu2+ | Cu | |
| 2) | Zn0 + Fe2+ " Zn2+ + Fe0 | б) | Zn | Zn2+ || Fe2+ | Fe | |
| 3) | Ni0 + Cu2+ " Ni2+ + Cu0 | в) | Ni | Ni2+ || Cu2+ | Cu | |
| 4) | Zn0 + Ni2+ " Zn2+ + Ni0 | г) | Zn | Zn2+ || Ni2+ | Ni | |
| д) | Fe | Fe2+ || Cu2+ | Cu |
9-70. Олово Sn ( 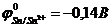 ) является катодом гальванического элемента в паре с
) является катодом гальванического элемента в паре с
а) серебром ( 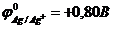 ) ) | г) медью ( 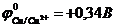 ) ) |
б) ртутью ( 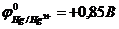 ) ) | д) цинком ( 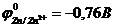 ) ) |
в) никелем ( 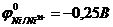 ) ) |
9-71. В кислотном аккумуляторе электроды
| а) железные, кислота серная | г) свинцовые, кислота соляная |
| б) железные, кислота соляная | д) оловянные, кислота серная |
| в) свинцовые, кислота серная |
9-72. Никель будет анодом в гальваническом элементе ( 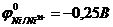 ,
, 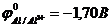 ,
, 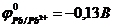 ,
, 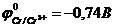 ,
, 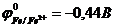 ).
).
| а) Ni | Ni2+ | |Al3+ | Al | в) Ni |Ni2+ || Cr3+ | Cr |
| б) Ni |Ni2+ || Pb2+ |Pb | г) Ni| Ni2+ || Fe2+ | Fe |
9-73. Олово будет катодом в гальваническом элементе ( 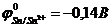 ,
, 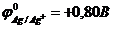 ,
, 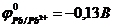 ?
? 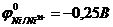 ,
, 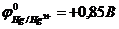 ).
).
| а) Sn | Sn2+ | |Ag+ | Ag | в) Sn | Sn2+|| Ni2+ | Ni |
| б) Sn | Sn2+ || Pb2+ |Pb | г) Sn | Sn2+ || Hg2+ | Hg |
9-74. Записана правильно схема гальванического элемента
( 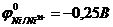 ,
, 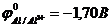 ,
, 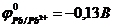 ,
, 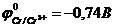 ,
, 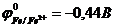 ).
).
| а) Ni | Ni2+ | |Al3+ | Al | в) Ni |Ni2+ || Cr3+ | Cr |
| б) Ni |Ni2+ || Pb2+ |Pb | г) Ni| Ni2+ || Fe2+ | Fe |
9-75. Электроды в схеме гальванического элемента … обозначены правильно
( 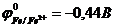 ,
, 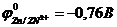 ,
, 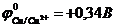 ,
, 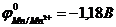 ,
, 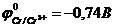 ).
).
| а) –A) Fe | Fe2+ || Zn2+ | Zn (K+ | в) –A) Fe | Fe2+ || Mn2+ | Mn (K+ |
| б) –A) Fe | Fe2+ || Cu2+ | Cu (K+ | г) –A) Fe | Fe2+ || Cr3+ | Cr (K+ |
9-76. Процесс Ni0 – 2e " Ni2+ протекает на аноде в гальванических элементах.... ( 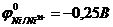 ,
, 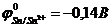 ,
, 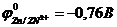 ,
, 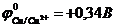 ).
).
| а) Ni | 2H+ || Cu2+ | Cu0 | в) Ni | Ni2+ || Cu2+ | Cu0 |
| б) Ni | Ni2+ || Zn2+ | Zn0 | г) Ni | Ni2+ || Sn2+ | Sn0 |
9-77. Железо окисляется в гальваническом элементе ... ( 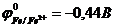 ,
, 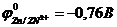 ,
, 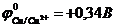 ,
, 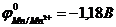 ,
, 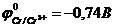 ).
).
| а) Fe | Fe2+ || Zn2+ | Zn | в) Fe | Fe2+ || Mn2+ | Mn |
| б) Fe | Fe2+ || Cu2+ | Cu | г) Fe | Fe2+ || Cr3+ | Cr |
9-78. Электродвижущая сила гальванического элемента, составленного из цинка и ртути ( 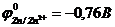 ,
, 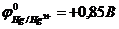 ) равна
) равна
| а) –0,09 В | б) 0,09 В | в) 1,52 В | г) 1,61 В | д) 1,7 В |
9-79. ЭДС (электродвижущая сила) гальванического элемента Ni | Ni2+ || Cu2+ | Cu ( 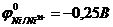 ,
, 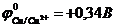 ) равна
) равна
| а) 0,59 В | б) 0,09 В | в) –0,09 В | г) –0,59 В |
9-80. ЭДС (электродвижущая сила) гальванического элемента Fe | Fe2+ || Cu2+ | Cu в сравнении с ЭДС элемента Fe | Fe2+ || Ni2+ | Ni
( 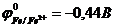 ,
, 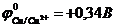 ,
, 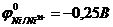 ):
):
| а) больше | в) равна |
| б) меньше | г) ЭДС отсутствует |
9-81. ЭДС (электродвижущая сила) гальванического элемента Fe | Fe2+ || Cu2+ | Cu в сравнении с ЭДС элемента Fe | Fe2+ || Ag+ | Ag
( 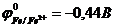 ,
, 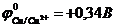 ,
, 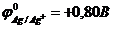 )
)
| а) больше | в) равна |
| б) меньше | г) ЭДС отсутствует |
9-82. ЭДС гальванического элемента при изменении концентрации растворов, в которые погружены катод и анод, в одинаковое число раз
| а) увеличится на это число | г) будет в 2 раза больше |
| б) уменьшится на это число | д) будет в 2 раза меньше |
| в) не изменится |
9-83. ЭДС (электродвижущая сила) гальванического элемента Zn | Zn2+ || Cu2+ | Cu равна ( 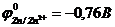 ,
, 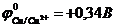 )
)
| а) 1,1 В | б) 0,42 В | в) –0,42 В | г) –1,1 В |
9-84. Наибольшая электродвижущая сила у гальванического элемента ( 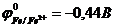 ,
, 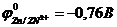 ,
, 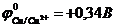 ,
, 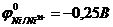 ,
, 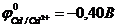 )
)
| а) Fe | Fe2+ || Cu2+ | Cu | в) Zn | Zn2+|| Cu2+ | Cu |
| б) Ni | Ni2+ || Cu2+ | Cu0 | г) Cd | Cd2+|| Cu2+ | Cu |
9-85. Соответствие между схемой гальванического элемента и величиной электродвижущей силы. ( 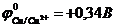 ,
, 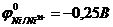 ,
, 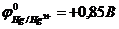 ,
, 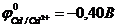 ,
, 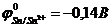 ).
).
| 1) | Cu | Cu2+ || Ni2+| Ni | а) | 0,59 В |
| 2) | Cu | Cu2+ || Hg2+| Hg | б) | 0,51 В |
| 3) | Cu | Cu2+ || Cd2+| Cd | в) | 0,74 В |
| 4) | Cu | Cu2+ || Sn2+| Sn | г) | 0,48 В |
| д) | 0,20 В | ||
| е) | 0,09 В |
9-86. Скорость электрохимической коррозии рассчитывается по формуле
а) 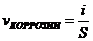 | в) 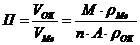 |
б) 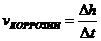 | г) 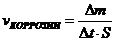 |
9-87. Глубинный показатель коррозии рассчитывается по формуле:
а) 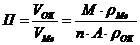 | в) 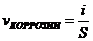 |
б) 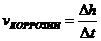 | г) 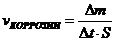 |
9-88. Фактор рыхлости при коррозии металлов рассчитывается по формуле
а)  | в) 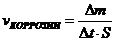 |
б) 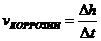 | г) 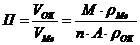 |
9-89. Массовый показатель коррозии рассчитывается по формуле
а) 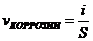 | в) 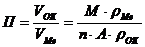 |
б) 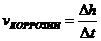 | г) 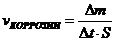 |
9-90. Местная коррозия показана на рисунке
| а) |  | б) |  | в) |  |
9-91. Сплошная коррозия показана на рисунке
| а) |  | б) |  | в) |  |
9-92. Условием возможности протекания коррозии является
а)  | в)  |
б)  | г) 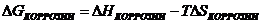 |
9-93. Процесс самопроизвольного разрушения металла при взаимодействии с окислителем возможен
а) 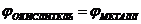 | в) 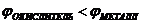 |
б) 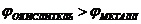 | г) 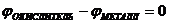 |
9-94. Первичный процесс коррозии железа в чистом влажном воздухе описывается уравнением
| а) 2Fe + O2 = 2FeO | в) 4Fe + 3O2 + 6H2O = 4Fe(OH)3 |
| б) 2Fe + O2 + 2H2O = 2Fe(OH)2 | г) 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 |
9-95. Коррозией называется процесс
а) гетерогенного превращения металла в окружающей среде
б) самопроизвольного разрушения металла, происходящего при взаимодействия с окружающей средой
в) целенаправленного изменения металла, происходящего при взаимодействия с различными веществами
г) самопроизвольного восстановления металла, происходящего при взаимодействия с окружающей средой
9-96. Процесс коррозии представляет собой самопроизвольную реакцию ... происходящую при взаимодействии с веществами, находящимися в окружающей среде
| а) окисления металла | в) ионного обмена металла |
| б) восстановления металла | г) окисления-восстановления металла |
9-97. Коррозия по механизму протекания бывает
| а) химическая | в) механическая |
| б) электрохимическая | г) разрушительная |
9-98. Химическая коррозия протекает
а) в газовой среде в отсутствии влаги
б) в газовой среде при контакте двух металлов
в) во влажном воздухе
г) в атмосферном воздухе промышленных предприятий
9-99. Процессы окисления металла и восстановления окислителя при химической коррозии протекают ... на поверхности металла
а) одновременно в одном месте
б) одновременно в различных местах
в) в различное время в одном месте
г) в различное время в различных местах
9-100. Процессы окисления металла и восстановления окислителя при электрохимической коррозии протекают ... на поверхности металла
а) одновременно в одном месте
б) одновременно в различных местах
в) в различное время в одном месте
г) в различное время в различных местах
9-101. Механизм электрохимической коррозии
а) перенос электронов от металла к окислителю
б) одновременная работа множества микрогальванических элементов
в) перенос электронов между активными участками внутри металла
г) перенос электронов между активными участками на поверхности металла
9-102. Электрохимическая коррозия может протекать в следующих средах
| а) влажный воздух | в) растворы солей | д) аргон |
| б) растворы кислот | г) растворы щелочей |
9-103. Катодный процесс, протекающий в чистом влажном воздухе
| а) O02 + 4e = 2O-2 | в) 2H+ + 2e = H02 |
| б)O02 + 2H2O + 4e = 4OH- | г) 2H2O + 2e = H02 + 2OH- |
9-104. Катодный процесс, протекающий в кислой среде
| а)2H+ + 2e = H02 | в) O02 + 4e = 2O-2 |
| б) 2H2O + 2e = H02 + 2OH- | г) O02 + 2H2O + 4e = 4OH- |
9-105. Анодный процесс, протекающий в чистом влажном воздухе
| а) Me0 – ne = Men+ | в) 2Me0 + O2 = 2MeO |
| б) 2Me0 + O2 + 2H2O = 2Me(OH)2 | г) Me0 + 2H+ = Me2+ + H2# |
9-106. Анодный процесс, протекающий в кислой среде
| а) Me0 – ne = Men+ | в) 2Me0 + O2 = 2MeO |
| б) 2Me0 + O2 + 2H2O = 2Me(OH)2 | г) Me0 + 2H+ = Me2+ + H2# |
9-107. Первичными продуктами электрохимической атмосферной коррозии металла во влажном воздухе являются
| а) оксиды металлов | в) соли металлов |
| б) гидроксиды металлов | г) сплавы металлов |
9-108. Первичными продуктами электрохимической коррозии металла в кислой среде являются
| а) оксиды металлов | в) соли металлов |
| б) гидроксиды металлов | г) сплавы металлов |
9-109. Реакция ... протекает на катодных участках при электрохимической коррозии с водородной деполяризацией
| а) 2H+ + 2e = H02 | в) O02 + 4e = 2O–2 |
| б) 2H2O + 2e = H02 + 2OH– | г) O02 + 2H2O + 4e = 4OH– |
9-110. Анодным называется покрытие
| а) более активным металлом | г) менее активным неметаллом |
| б) менее активным металлом | д) полимерное покрытие |
| в) более активным неметаллом |
9-111. Катодным называется покрытие
| а) более активным металлом | г) менее активным неметаллом |
| б) менее активным металлом | д) полимерное покрытие |
| в) более активным неметаллом |
9-112. Анодное покрытие является более эффективным при защите от коррозии, потому что
а) образует плотную пленку на поверхности металла
б) разрушается само при повреждении поверхности
в) способствует разруш<
