Факторы, влияющие на растворимость
Большой прогресс был сделан в разработке способов прогнозирования растворимости веществ в водных средах, они могут основываться как на оценке площади поверхности молекулы, так и на характере основных химических групп в исходной структуре. Важность площади поверхности становится очевидна, если мы подумаем о процессах растворения кристалла (рис. 5.1).
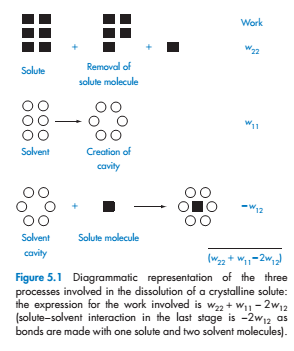
Процесс можно описать тремя стадиями:
1. Молекула растворяемого вещества «удаляется» из его кристалла
1. В растворителе создается полость для молекулы
2. Молекула этого вещества входит в эту полость
Процесс размещения молекулы растворенного вещества требует образования ряда контактов между растворенным веществом и растворителем; чем больше молекула растворяемого вещества, тем больше контактов будет создано.Если площадь поверхности молекулы растворенного вещества равна А, граница растворимого растворителя увеличивается на σ12A, где σ12 - межфазное натяжение между растворителем (индекс 1) и растворителем (индекс 2). ơ является параметром, который нелегко получить для твердых веществ на молекулярном уровне, но он может быть вычислен из знания поверхностного натяжения на границе раздела фаз молекулы при нормальном натяжении.
Количество молекул растворителя, в которые могут упаковаться молекулы растворяемого вещества, рассматриваются в расчетах термодинамических свойств раствора. Поэтому площадь поверхности молекулы растворяемого вещества является ключевым параметром, и хорошие корреляции могут быть получены между растворимостью в воде и этим параметром.
Конечно, большинство веществ не являются простыми неполярными углеводородами, и мы должны учитывать полярные молекулы и слабые органические электролиты.Термин w12, мера взаимодействия между растворителем и растворяемым веществом, далее должен быть разделен, принимая во внимание взаимодействия, в которых принимают участие неполярная часть и полярная в растворе. Площадь молекулярной поверхности молекулы каждого участка можно рассматривать отдельно: чем больше площадь гидрофильной части по отношению к гидрофобной, тем больше растворимость в воде. Для гидрофобной площади молекулы А, изменение свободной энергии помещения растворенного вещества в полость растворителя является ơ12 А. В самом деле, можно показать, что обратимая работа раствора А отображается формулой (w11+w22-2w12)A.
В этом выводе заложено предположение о том, что образованный раствор является разбавленным, так что взаимодействие между растворенным веществом и растворяемым раствором не важно. Об успехе подхода с молекулярной площадью свидетельствует тот факт, что записанное уравнение может связать растворимость с площадью растворимости.(уравнение верно прмерно для 55 веществ)

где S - это моляльный (не молекулярный!) раствор и А — общая площадь поверхности в нм. В таблице 5.1 все вещества — жидкости, поэтому процесс растворения намного легче, чем показано на рис 5.1.
Структурные черты и водные растворы
Форма
Разветвление гидрофобных групп влияет на растворимость в воде, как это показано в таблице 5.2, растворимость спиртов с разветвленной и прямой цепью. (разветвленные и симметричные растворяются легче)
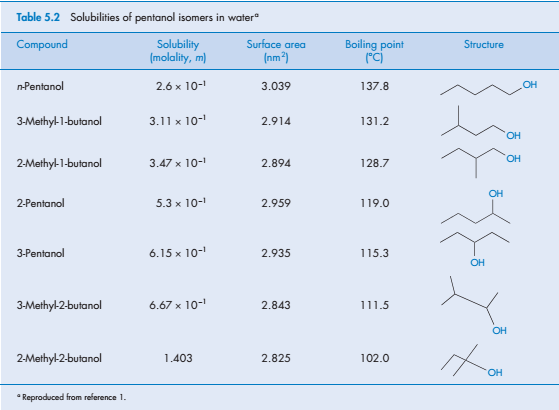
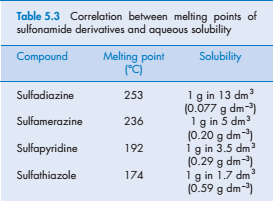
Температура кипения жидкости и температура плавления твердых веществ отражают сильные взаимодействия между молекулами в чистой жидкости или твердом состоянии. Температура кипения коррелирует с общей площадью поверхности, и в достаточно большом диапазоне соединений мы можем обнаружить тенденцию снижения растворимости в воде с увеличением температуры кипения (см. таблица 5.2). Так как точка кипения жидкости и плавления твердых веществ являются индикаторами молекулярного сцепления, они могут быть полезными индикаторами в ряде подобных соединений. Температуры плавления даже тех веществ, которые образуют реальные растворы, могут быть использованы в качестве руководства по порядку растворимости в близкородственных соединениях, как это можно видеть по параметрам сульфонамидных производных, перечисленных в табл. 5.3. Такие корреляции зависят от относительно большого значения w22 в процессе растворения этих соединений.
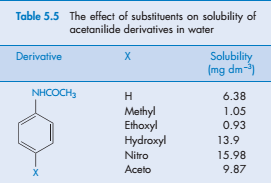
Заместители
Влияние заместителей на растворимость молекул в воде возможно из-за их влияния на свойства твердых или жидких веществ (например, на их молекулярном сцеплении) или на взаимодействие заместителя с водой. В качестве ориентира к растворению, заместители могут быть классифицированы как гидрофобные и гидрофильные, в зависимости от их полярности..
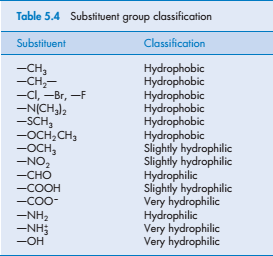
Очевидно, что сильные гидрофильные свойства полярных групп обуславливают способность водорода взаимодействовать с молекулами воды. Наличие гидроксильных групп заметно изменяет растворимость соединений. Например, фенол растворяется в воде в 100 раз лучше, чем бензол. В случае фенола, растворение которого происходит с образованием водородных связей, взаимодействие типа растворенное вещество—растворитель (w12) перевешивает другие факторы (такие как w22 или w11). Но, способность к растворению связана с положением функциональных групп в исходной молекуле.
Положение заместителя может влиять на его эффект. Это можно увидеть в водных растворах о-, м- и п- дигидрокси бензолов; как и ожидалось, все значения выше, чем у бензола, но они не являются одинаковыми, 4, 9 и 0.6 моль/дм3, соответственно. Относительно низкая растворимость пара-соединений является следствием большей стабильности его кристаллического состояния. Точки плавления этих производных подтверждают, что это так (105, 111 и 170 °С).
В случае орто-производных возникновение межмолекулярных водородных связей в водной среде способствует меньшему взаимодействию ОН-групп с молекулами воды, что объясняет меньшую растворимость орто-производных в сравнении с мета-производными.