Поскольку скорость реакции теперь эффективно зависит от одного члена концентрации, это реакция первого порядка или, что более правильно, в этом случае реакция псевдо-первого порядка
Большинство реакций разложения, включающих наркотики, попадают в эту категорию либо потому, что вид, реагирующий с лекарственным средством, поддерживается постоянным путем буферизации или потому, что, как и в случае некатализируемых реакций гидролиза, вода является в таком большом избытке, что любое изменение его концентрации пренебрежимо мало.
Если и поддерживать постоянное количество воды в реакции, мы также сохраняем фиксированную концентрацию лекарственного средства, тогда уравнение становится (нулевой)
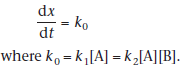
В этих системах суспендированный лекарственный препарат медленно растворяется при разложении лекарственного средства и поэтому поддерживается постоянная концентрация лекарственного средства в растворе.
15. Стабильность лекарственных веществ. Кинетика химического распада в растворе. Реакции третьего порядка. Определение порядка реакций. Комплексные реакции. Приведите примеры.
Методы определения порядка реакции
Проведение реакции в условиях, когда концентрация одного из реагентов много меньше концентрации другого (других) и скорость реакции зависит от концентрации только этого реагента, используется для определения частных порядков реакции – это т.н. метод избыточных концентраций или метод изолирования Оствальда. Порядок реакции по данному веществу определяется одним из перечисленных ниже методов.
Графический метод заключается в построении графика зависимости концентрации реагента от времени в различных координатах. Для различных частных порядков эти зависимости имеют следующий вид:
| Порядок реакции | Зависимость концентрации от времени |
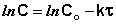 | |
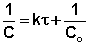 | |
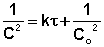 |
Если построить графики этих зависимостей на основании опытных данных, то лишь одна из них будет являться прямой линией. Если, например, график, построенный по опытным данным, оказался прямолинейным к координатахlnC = f(t), то частный порядок реакции по данному веществу равен единице.
Метод подбора кинетического уравнения заключается в подстановке экспериментальных данных изучения зависимости концентрации вещества от времени в кинетические уравнения различных порядков. Подставляя в приведённые в таблице уравнения значения концентрации реагента в разные моменты времени, вычисляют значения константы скорости. Частный порядок реакции по данному веществу равен порядку того кинетического уравнения, для которого величина константы скорости остаётся постоянной во времени.
| Порядок реакции | Выражение для константы скорости |
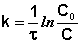 | |
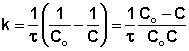 | |
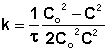 |
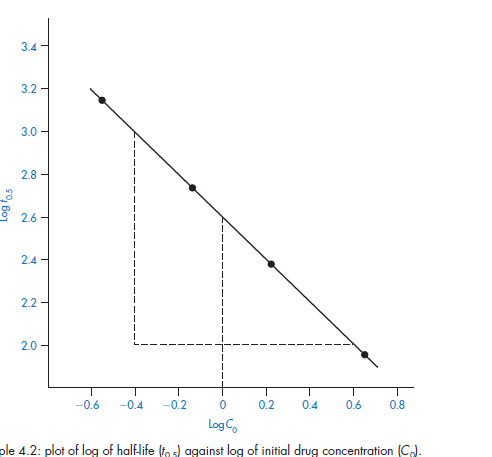
Метод определения времени полупревращения заключается в определении t1/2 для нескольких начальных концентраций. Как видно из приведённых в таблице уравнений, для реакции первого порядка время полупревращения не зависит от Co, для реакции второго порядка – обратно пропорционально Co, и для реакции третьего порядка – обратно пропорционально квадрату начальной концентрации.
| Порядок реакции | Выражение для периода полупревращения |
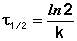 | |
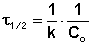 | |
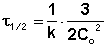 |
По характеру зависимости t1/2 от Co нетрудно сделать вывод о порядке реакции по данному веществу. Данный метод, в отличие от описанных выше, применим и для определения дробных порядков.
Из книги
Альтернативный метод определения порядка реакции, который позволяет избежать этой проблемы, основан на уравнении
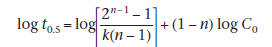
Период полураспада реакции определяется для серии исходных концентраций лекарственного средства, C0! , А порядок n вычисляется по наклону графиков log t! 0,5 как функция log C0! ,
Реакции третьего порядка
встречаются редко в исследованиях стабильности лекарств, связанных, как и в случае одновременного столкновения трех молекул реагентов. Общая скорость разрушения ампициллина путем одновременного гидролиза и полимеризации может быть представлена уравнением вида 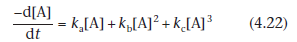
ka, kb and kc- зависящие от рН константы постоянной скорости для гидролиза, некатализированной полимеризации и обычной кислотно-основно катализируемой полимеризации ампициллина соответственно. Как видно из уравнения (4.22), скорость разложения показывает как зависимость второго порядка, так и третьего порядка от общей концентрации ампициллина [А].
Сложные реакции
Существует множество примеров лекарственных средств, разложение которых одновременно происходит в двух и более направлениях, или состоит из нескольких этапов или обратимых реакций. Пути разложения некоторых лекарств являются примером разных видов сложных реакций. Поэтому возникает необходимость в преобразовании кинетических уравнений для подобных реакций.
Обратимые реакции
Кинетические уравнения обратимых реакций включают две кинетические константы: первая из которых, 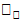 , описывает скорость прямой реакции, а вторая,
, описывает скорость прямой реакции, а вторая, 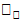 , предназначена для обозначения скорости обратной реакции. Простейшим примером в данном случае является реакция первого порядка:
, предназначена для обозначения скорости обратной реакции. Простейшим примером в данном случае является реакция первого порядка:
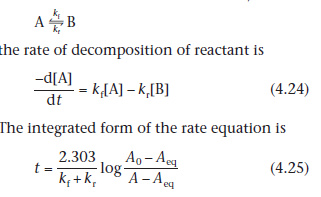
Скорость разложения действующего вещества описывается уравнением:
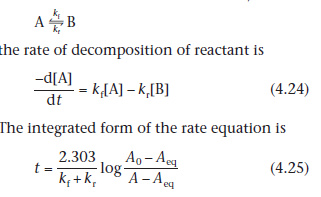
Интегрированная форма кинетического уравнения:
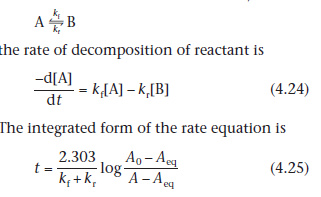
где 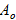 , А, Аeqобозначают соответственно начальную концентрацию, концентрацию в момент времени t и равновесную концентрацию вещества А.
, А, Аeqобозначают соответственно начальную концентрацию, концентрацию в момент времени t и равновесную концентрацию вещества А.
Уравнение 4.25 можно изобразить графически ( по оси ординат откладываем t, а по оси абсцисс log[(Ао - Аeq)/(А - Аeq)], мы получим линейную зависимость с тангенсом угла наклона графика 2.303/(А - Аeq), обе константы можно рассчитать по отдельности, если нам известна константа равновесия К, тогда
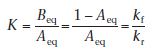
где Beq – это равновесная концентрация вещества В.
Эпимеризация тетрациклинов( см. раздел 4.1.3) является примером обратимой реакции разложения первого порядка
2.1.11 Кинетика двусторонних (обратимых) реакций
Химические реакции часто являются двусторонними (обратимыми), т.е. могут протекать при данных условиях в двух противоположных направлениях (понятие обратимая реакция следует отличать от термодинамического понятия обратимый процесс; двусторонняя реакция обратима в термодинамическом смысле лишь в состоянии химического равновесия). Рассмотрим элементарную двустороннюю реакцию
А + В <––> D + E
Скорость уменьшения концентрации вещества А при протекании прямой реакции определяется уравнением (II.40):
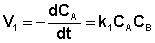 , (II.40)
, (II.40)
а скорость возрастания концентрации вещества А в результате протекания обратной реакции – уравнением (II.41):
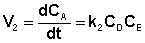 (II.41)
(II.41)
Общая скорость двусторонней реакции в любой момент времени равна разности скоростей прямой и обратной реакции:
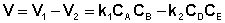 (II.42)
(II.42)
По мере протекания двусторонней реакции скорость прямой реакции уменьшается, скорость обратной реакции – увеличивается; в некоторый момент времени скорости прямой и обратной реакции становятся равными и концентрации реагентов перестают изменяться. Таким образом, в результате протекания в закрытой системе двусторонней реакции система достигает состояния химического равновесия; при этом константа равновесия будет равна отношению констант скоростей прямой и обратной реакции:
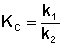 (II.43)
(II.43)
Параллельные реакции
Разложения многих лекарственных веществ может происходить по двум и более путям, более вероятный путь зависит от условий реакции.
У нитразепама (VI) есть два пути разложения, параллельные реакции псевдо-первого порядка, в результате которых образуются различные продукты распада, как в растворе, так и в твердом состоянии. Разрушение таблеток натризепама во влажной среде может происходить по обоим направлениям, при этом соотношение конечных продуктов будет зависеть от количества воды.
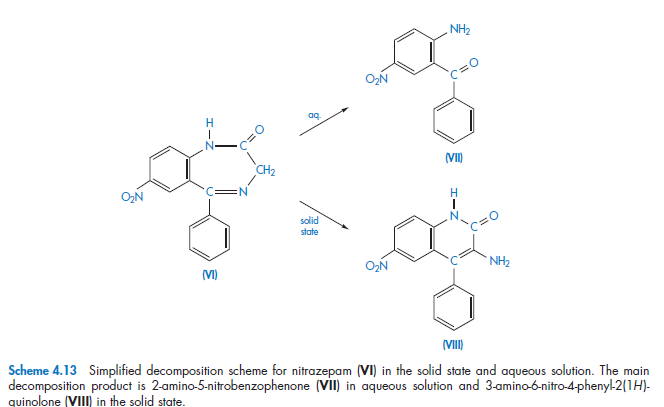
В других случаях процесс разложения может происходить в двух направлениях одновременно, как, например, и происходит при гидролизе и эпимеризации пилокарпина
Общее кинетическое уравнение для параллельных реакций является суммой констант для каждого из путей разложения. Например, разложение вещества Х идёт по двум направлениям, каждое из которых является реакцией первого порядка,
в таком случае кинетическое уравнение будет представлено в следующем виде
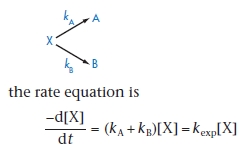
где ka и kb – это константы скорости для веществ А и В соответственно, а kexp – экспериментально определённая константа скорости. Значения констант скорости ka и kb могут быть рассчитаны по отдельности с помощью определения соотношения концентраций продуктов (R), образовавшихся в результате каждой реакции.
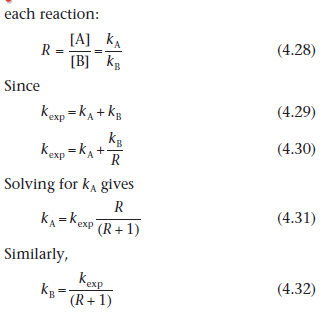
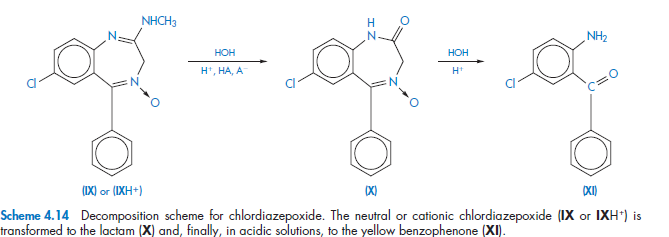
Последовательные реакции
Простейший пример последовательной реакции выражается уравнением
А ͢ᵏ В ͢ᵏ С
В котором каждая стадия-необратимая реакция первого порядка.Гидролиз хлордиазэпоксида протекает по схеме гидролиза реакции первого порядка аналогично представленному уравнению
Константа распада вещества А

Константа изменения концентрации вещества В

И то же для вещества С

Интегрирование константы уравнения (4,36) дает

Замена уравнением 4,36 в уравнении 4,34 дает
 ,
,
которая после интегрирования дает

С этого момента,

Уравнения 4,36,4,37 и 4,38 могут быть использованы для расчета констант kA и kB и также для расчета концентрации распада -продукта С.
16. Стабильность лекарственных веществ. Факторы, влияющие на стабильность лекарственного препарата. Жидкие лекарственные формы. Полутвердые лекарственные формы. Твердые лекарственные формы.
Факторы, влияющие на стабильность лекарственного препарата.
Жидкие лекарственные формы.
рН
