Экспериментально мы можем контролировать скорость разложения препарата либо путем его уменьшения концентрации во времени, либо, наоборот, по скорости появления одного из продуктов распада.

Реакции нулевого порядка
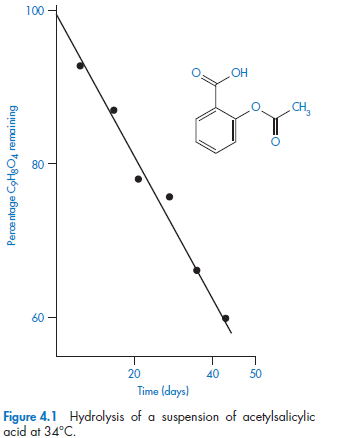
Для реакций нулевого порядка кинетическое уравнение имеет следующий вид:
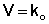 (II.5)
(II.5)
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ; это характерно для многих гетерогенных (идущих на поверхности раздела фаз) реакций в том случае, когда скорость диффузии реагентов к поверхности меньше скорости их химического превращения.
Многие реакции разложения в твердой фазе или в суспензии, по-видимому, следуют кинетике нулевого порядка. На рис. 4.1 показан гидролиз суспензии ацетилсалициловой кислоты.
Реакции первого порядка
Рассмотрим зависимость от времени концентрации исходного вещества А для случая реакции первого порядка А ––> В. Реакции первого порядка характеризуются кинетическим уравнением вида (II.6). Подставим в него выражение (II.2):
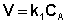 (II.6)
(II.6)
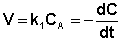 (II.7)
(II.7)
После интегрирования выражения (II.7) получаем:
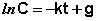 (II.8)
(II.8)
Константу интегрирования g определим из начальных условий: в момент времени t = 0 концентрация С равна начальной концентрации Со. Отсюда следует, что g = ln Со. Получаем:
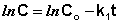 (II.9)
(II.9)
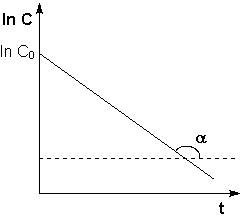
Рис. 2.3 Зависимость логарифма концентрации от времени для реакций первого порядка
Т.о., логарифм концентрации для реакции первого порядка линейно зависит от времени (рис. 2.3) и константа скорости численно равна тангенсу угла наклона прямой к оси времени.
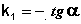 (II.10)
(II.10)
Из уравнения (II.9) легко получить выражение для константы скорости односторонней реакции первого порядка:
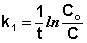 (II.11)
(II.11)
Еще одной кинетической характеристикой реакции является период полупревращения t1/2 – время, за которое концентрация исходного вещества уменьшается вдвое по сравнению с исходной. Выразим t1/2 для реакции первого порядка, учитывая, что С = ½Со:
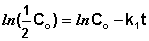 (II.12)
(II.12)
Отсюда
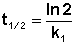 (II.13)
(II.13)
Как видно из полученного выражения, период полупревращения реакции первого порядка не зависит от начальной концентрации исходного вещества.
Реакцией псевдопервого порядка
Даже в случае реакции с участием более чем одного реагирующего вида скорость может все еще следовать кинетике первого порядка. Наиболее распространенный пример этого имеет место, когда один из реагентов находится в таком большом избытке, что любое изменение его концентрации пренебрежимо мало по сравнению с изменениями концентрации других реагентов. Такие реакции часто встречаются в исследованиях стабильности препаратов, которые гидролизуются в растворе, причем вода находится в таком избытке, что изменения в ее концентрации незначительны, и, следовательно, скорость реакции зависит только от концентрации лекарственного средства.
Рассмотрим в качестве примера элементарную реакцию гидролиза этилового эфира уксусной кислоты (этилацетата), кинетика которой изучается в лабораторном практикуме по физической химии:
СН3СООС2Н5 + Н2О ––> СН3СООН + С2Н5ОН
Если проводить эту реакцию при близких концентрациях этилацетата и воды, то общий порядок реакции равен двум и кинетическое уравнение имеет следующий вид:
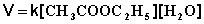 (II.23)
(II.23)
При проведении этой же реакции в условиях большого избытка одного из реагентов (воды или этилацетата) концентрация вещества, находящегося в избытке, практически не изменяется и может быть включена в константу скорости; кинетическое уравнение для двух возможных случаев принимает следующий вид:
1) Избыток воды:
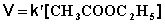 (II.24)
(II.24)
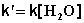 (II.25)
(II.25)
2) Избыток этилацетата:
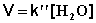 (II.26)
(II.26)
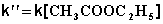 (II.27)
(II.27)
Проведение реакции при большом избытке одного из исходных веществ используется для определения частных порядков реакции.
Реакции второго порядка
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
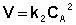 (II.14)
(II.14)
либо
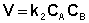 (II.15)
(II.15)
Рассмотрим простейший случай, когда кинетическое уравнение имеет вид (II.14) или, что то же самое, в уравнении вида (II.15) концентрации исходных веществ одинаковы; уравнение (II.14) в этом случае можно переписать следующим образом:
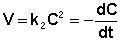 (II.16)
(II.16)
После разделения переменных и интегрирования получаем:
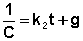 (II.17)
(II.17)
Постоянную интегрирования g, как и в предыдущем случае, определим из начальных условий. Получим:
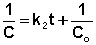 (II.18)
(II.18)
Т.о., для реакций второго порядка, имеющих кинетическое уравнение вида (II.14), характерна линейная зависимость обратной концентрации от времени (рис. 2.4) и константа скорости равна тангенсу угла наклона прямой к оси времени:
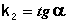 (II.19)
(II.19)
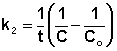 (II.20)
(II.20)
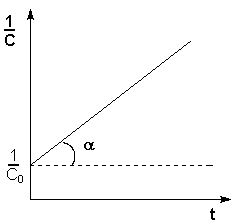
Рис. 2.4 Зависимость обратной концентрации от времени для реакций второго порядка
Если начальные концентрации реагирующих веществ Cо,А и Cо,В различны, то константу скорости реакции находят интегрированием уравнения (II.21), в котором CА и CВ – концентрации реагирующих веществ в момент времени t от начала реакции:
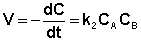 (II.21)
(II.21)
В этом случае для константы скорости получаем выражение
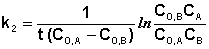 (II.22)
(II.22)
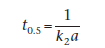
В отличие от t0,5 для реакций первого порядка период полураспада реакции второго порядка зависит от начальной концентрации реагентов. Невозможно вывести простое выражение для периода полураспада реакции второго порядка с неравными начальными концентрациями.
ПРИМЕРЫ
многие реакции гидролиза катализируются H+, OH- или буферными компонентами, поэтому мы можем написать уравнение (второй порядок)

Когда раствор буферизуется при постоянном рН, [H +] является постоянным, и мы можем написать уравнение как (псевдопервый порядок)

