Диссоциация слабых кислотных и основных лекарственных препаратов, и их солей
Согласно теории кислот и оснований Бренстеда-Лоури, кислота – это соединение, которое способно отщеплять протон, а основание – соединение, которое способно присоединять протон. Таким образом, диссоциация ацетилсалициловой кислоты, слабой кислоты, может быть представлена на схеме :
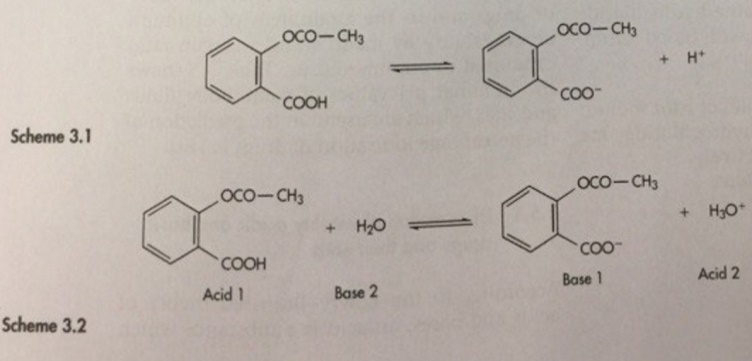
В данном равновесии ацетилсалициловая кислота выступает в роли кислоты, потому что она является донором протона, а ацетилсалицилат-ион – в роли основания, потому что он присоединяет протон, отщепленный (пришедший) от кислоты. Кислота и основание, существующие в виде равновесия, могут называться сопряженной кислотно-основной парой.
Но поскольку протоны слишком реакционноспособны, чтобы существовать в свободном виде, они сразу поглощаются (взаимодействуют с) растворителем. Объектом, принимающим протон, согласно формулировке Бренстеда-Лоури, является основание, и продуктом, образующимся после присоединения протона от растворителя, является кислота. Так возникает второе кислотно-основное равновесие, когда растворитель присоединяет протон, что может быть представлено в виде:
H2O + H+ ↔ H3O+
Cуммарное уравнение этих процессов показано на схеме 3.2, или в общем виде выглядит так:
НА + Н2О ↔ А- + Н3О+
С помощью подобных рассуждений может быть составлена схема диссоциации бензокаина, слабого основания,
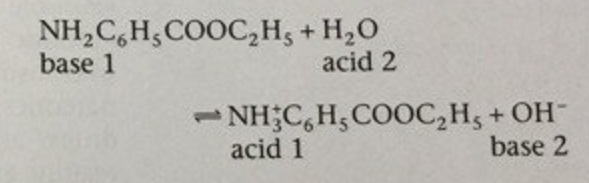
или в общем виде:
B + Н2О ↔ BH+ + OH-
Сравнение этих двух основных выражений указывает на то, что вода может выступать как в роли кислоты, так и в роли основания. Такие растворители называются амфотерными.
Соли разбавленных кислот или оснований по существу полностью ионизированы. Например, гидрохлорид эфедрина (соль эфедрина по слабому основанию и сильной кислоте - HCl) существует в водном растворе в форме кислоты, сопряженной со слабым основанием C6H5CH(ОН)CH(CH3)N+H2CH3, вместе с его противоионом Сl-. Подобным образом, когда салицилат натрия (соль разбавленной салициловой кислоты и сильного основания - NaOH) растворяясь в воде, ионизируется почти полностью на основание, сопряженное с салициловой кислоты, HOC6H5COO- и Nа + ионы.
Сопряженные кислоты и основания, образуются при условии кислотно-щелочного равновесия.
Эффект pH на ионизации слабо кислых или основных наркотиков их соли.
Если ионизация разбавленной кислоты представлена, как описано выше, мы можем выразить константу равновесия следующим образом:

Если предположить, что активность коэффициентов близка к единице в разбавленном растворе, активность может быть заменена концентрацией:

Ka по-разному упоминается как постоянная ионизация, константа диссоциации или кислотность, постоянная для разбавленной кислоты. Отрицательный логарифм Ka упоминается как pKa, как отрицательный логарифм концентрации ионов водорода называют pH. Таким образом

Точно так же константа диссоциации или константа основности , постоянная для слабого основания,

Таким образом, значения рКа и pКb обеспечивают удобное средство сравнения силы слабых кислот и щелочей. Чем ниже рКа, тем сильнее кислота; чем ниже pKb, тем сильнее основание. Значения рКа и pKb сопряженных кислотно-основных пар связаны выражением

где pKw является отрицательный логарифмом константы диссоциации воды, Kw. Kw вытекает из равновесия
H2O+H2O =H3O+ +OH-
где одна молекула воды ведет себя как разбавленная кислота или основание ,а другая, как растворитель.(3.68)
Тогда концентрация молекулярной воды считается фактически постоянной для разведенных водных растворов.(3.69)
Поэтому, где константа диссоциации для воды (произведение растворимости) теперь включает в себя термин для молекулярной воды и имеет значения, приведённые в Таблице 3.7.
Степень ионизации разбавленных кислот и оснований

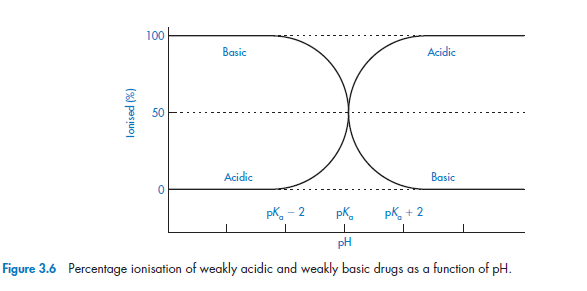
Когда рН водного раствора слабокислого или основного лекарственного средства приближается к рКа или pKb, существует очень сильное изменение ионизации этого препарата. Влияние рН на процент ионизации может быть определено для препаратов с известным рКа.
Пример 3.5
Расчет процента ионизации
Рассчитывают процент кокаина, существующий в виде свободного основания в растворе гидрохлорида кокаина при рН 4,5, и при рН 8,0. pKb кокаина 5.6.
Ответ
Из уравнения (3.73):
При рН 4,5:
процент ионизации = 
Таким образом, процент имеющегося кокаина = 0,01%.
При рН 8,0:
процент ионизации = ...

Таким образом, процент имеющегося кокаина = 28,47%
Если проводить расчеты, такие как в примере по всему диапазону рН для обоих кислотных-основных лекарственных средств, мы приходим к графику, представленному на рис. 3.6. Обратите внимание:
●Основной препарат практически полностью ионизируются при значениях рН до 2-х единиц ниже ее рКа, и практически не ионизируется при значениях рН выше, чем на 2 единицы выше его рКа.
●Кислотный препарат практически не ионизиуется при значениях рН до 2 единиц ниже его pKA и практически полностью ионизируется при значениях рН выше 2 единиц выше pKA.
● Оба кислотных и основных препарата ровно на 50% ионизируются по значениям pKA.
8. Физико-химические свойства лекарственных веществ в растворе. Ионизация лекарственных веществ в растворе. Ионизация амфотерных лекарственных препаратов. Ионизация полипротонных лекарственных препаратов.
