Сырьевые источники органических соединений.
Номенклатура.
По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь так, чтобы у наибольшего числа заместителей был минимальный номер в цепи. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающая группа или гетероатом, затем название группы или гетероатома и название главной цепи. Если группы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых групп указывают приставками ди-, три-, тетра-. Если группы неодинаковые, то их названия перечисляются в алфавитном порядке.
Физ. св-ва. При норм.усл. первые 4 гомолог. Ряда (С1-С4) – газы без цвета и запаха. Алканы неразветвлённого строения (С5-С17) – бесцв. Жидкости с запахом бензина. Алканы с С18 – тв. в-ва белого цвета, жирные на ощупь. Чем больше число атомов С в цепи, тем больше t0кип.,плав. и плотность алканов. Газообразные и жидкие алканы образуют взрывоопасную смесь с воздухом. Жид. и тв. алканы легко смешиваются др. с др.
Получение: из нефти и природ. газа; гидрирование непред. углеводородов,углерода; взаимодействие смеси оксида С(II) с Н. Крекинг – процесс гомологич. разрыва связей С-С, который протек. при нагревании орг. в-ва без доступа воздуха в присутствии/отсутствии катализатора.
Хим. Cв-ва. При обыч. усл химически инертны. При норм. темп. устойчивы к реагентам. Хим.устойчивость определяется выс. прочностью сигма-связей С-С и С-Н, их низ. Полярностью и малой поляризуемостью. Р-ции радикального замещения, каталитического окисления, галогенирование, все алканы горят, нитрирование по Коновалову, пиролиз, дегидрирование, изомеризация, конверсия метана.
Применение.Топливо, в парфюмерии, медицине, технике, в хим. пром. получают сажу для производ. типографич. красок…
Циклоалканы – пред. Углеводороды, содержащ. замкнут. цепь углерод. атомов. Соединения: циклопропан, циклобутан, циклопентан, циклогексан. СтН2т. Молекула циклогексана содержит на 2 атома Н меньше, чем молекула алкана. Все атомы в циклоалканах в состоянии sp3-гибридизации, поэтому эти соединения относят к предельным углеводородам. На св-ва этих соед. оказ. влияние устойч-сть цикла, связанная с его размером. Изомерия углеродного скелета. В циклоалканах невозможно свобод. вращ. относительно связей С-С в цикле.
Названия циклоалканов образуют добавлением префикса цикло- к названию соответствующего неразветвлённого предельного углеводорода с тем же числом углеродных атомов.
Заместители же нумеруются в соответствии с их положением в цикле таким образом, чтобы сумма чисел в названии вещества была минимальной.
Физ. св-ва.С3 и С4 при обыч. усл. – газообразные, С5 и С6 – жидкости. Нафтеновые углеводороды почти не растворимы в воде, их t кип и плав. выше, чем у алканов.
Получениевпервые были выведены из нефти и изучены Морковниковым В.В. Внутримолекулярная р-ция Вюрца; при каталитич. гидрировании ароматич. углеводород.
Хим. Св-васуществование углового напряжения циклопропане и циклобутане приводит к тому, что их св-ва существенно отличаются от св-в нафтенов со сред. размером цикла. Циклопентан и циклогексан лизки к алканам. Они легко вступают в реакции замещения. Присоединение галогенов и галогенводородов происход. труднее, чем с алкенами.
Применение.Практич. значение им. циклогексан, метилгексан и др. В процессе ароматизации нефти эти соединения превращ. в бензол, тоулол и др. в-ва, для синтеза красителей, медикаментов и т.д. Циклопропан прим. в медиц. в качестве наркоза.
№2
Алкены и алкадиены.
Непредельные соединения – углеводороды, содержащие в углеродной цепи 1 или неск. кратных углерод-углеродных связей.
Алкены(этиленовые) – непред. углеводороды, молекулы которых содержат 1 двойную углерод-углеродную С-С СnH2n
Изомерия: углерод. скелета, положение двойной связи, пространственная.
Физ. св-ва:При обыч. усл. С2-С4 – газ. в-ва без цвета и запаха, С5-С15 – бесцв. жидкости, С16 – тв. в-ва. Нерастворимы в воде, но раств. в орг. соединениях. Газообразные алкены образуют с воздухом взрывоопасные смеси. Низкие t кип. и плав.
Получение. В природе нет. Способ получения этиленовых углеводородов основан на превращении алканов в алкены с использованием природ. источников углеводородов. Крекинг алканов, дегидрирование алканов, дегидратация предельных одноатом. спиртов, дегалогенирование дигалогеналканов.
Хим. Cв-ва.Р-ция присоединения, гидрогалогенирование, гидратация, галогенирование, гидрирование, р-ция окисления, р-ция полимеризации.
Алкадиены (диеновые) – углеводороды, в молекулах которых содержатся 2 двойные связи С=С. СnH2n-2
Получение: дегидрирование алканов, р-ция Лебедева.
Cв-ва: лёгкость протекания р-ций присоед., окисл., полимеризации обусловлена наличием в молекуле алкадиенов 2 двойных связей. В результате полимеризации получаются синтетич. каучуки.
Применение. Для различного вида каучуков: дивинилового, изопренового, хлоропренового, бутадиен-стирольного и др.
№3
Алкины.
Алкины (непред. УВ ряда ацетилена) – содерж. тройную связь. Сn H2n-2. Атомы углерода при тройной связи наход. в состоян. sp-гибридизации.
Номенклатура.
Простейшим алкином явл. этин (ацетилен C2H2). По номенклатуре IUPAC названия алкинов образ. от названий соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной связи указ. арабскими цифрами.
Углеводородные радикалы, образов. от алкинов, им. суф. «-инил», так CH≡C- называется «этинил».
Гомолог. ряд алкинов:
Этин: C2H2, Пропин: C3H4, Бутин: C4H6, Пентин: C5H8, Гексин: C6H10, Гептин: C7H12, Октин: C8H14, Нонин: C9H16, Децин: C10H18
Физ. св-ва.
Алкины по своим физ. св-вам напоминают соответствующие алкены. Низшие (до С4) — газы без цвета и запаха, имеющие более высокие темп. кипения, чем аналоги в алкенах. Алкины плохо раств. в воде, лучше — в орг. растворителях.
Хим. св-ва.
Для алкинов характерны р-ции присоед. В отличие от алкенов, которым свойст. р-ции электрофильного присоед., алкины могут вступ. и в р-кции нуклеофильного присоед. Это обусловлено значительным s-характером связи и, как следствие, повыш. электроотрицательностью атома углерода. Кроме того, больш. подвижность атома Н при тройной связи обуславливает кислот. св-ва алкинов в р-циях замещ.
Качественная реакция.
Р-ция алкинов с аммиакатами серебра или одновалентной Сu явл. качественной на наличие тройной связи
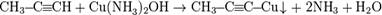
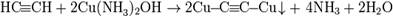
Нахождение в природе.
В природе алкины не встреч. В некот. видах грибов Basidiomycetes были обнаруж. в крайне малом кол-ве соединения, содержащие полиацетиленовые структуры.
Ацетилен обнаруж. в атмосфере Урана, Юпитера и Сатурна.
Алкины облад. слаб. наркоз. действием. Жид. алкины выз. судороги.
Применение.
Из всех ацетиленовых УВ серьёзное промыш. знач. им. только ацетилен, кот. явл. важнейшим хим. сырьём.
При горении ацетилена выделяется много тепла, что используется для резки и сварки металлов в ацетилен-кислородной сварке (расходуется до 30 % всего производимого ацетилена).
В конце 19-го — начале 20-го века шир. популярностью польз. многочисленные ацетиленовые светильники (источником ацетилена служил дешевый карбид кальция), используемые на железнодорожном и вод. транспорте, для освещ. улиц, в быту.
Получение.
Осн. Промыш. способ. Получ. ацетилена явл. электро- или термокрекинг метана, пиролиз природ. газа и карбидный метод.
Карбидный метод (промышленный способ). Прокаливанием в электрических печах смеси оксида кальция с коксом при 1800—2000°С получ. карбид кальция:
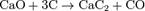
При действии на полученный карбид воды образуется гидроксид кальция и ацетилен:
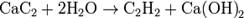
Пиролиз УВ (промышленный способ) Суть способа заключ. в пропускании над спец. огнеупорной насадкой смеси природ. газа с воздухом, который, сгорая, подним. темп. до 1500 °C. Затем на насадке происходит пиролиз метана.
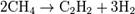
Крекинг природного газа (промышленный способ Электрокрекинг Метод заключ. в пропускании метана между двумя металлическими электродами с огромной скоростью. Температура 1500—1600°С. С хим. точки зрения метод аналогичен методу пиролиза, отличаясь лишь технологическим и аппаратным исполнением.
Термоокислительный крекинг.В этом методе использ. Частич. окисление метана благодаря использованию теплоты, образующейся при его сгорании.
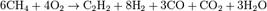
Метод прямого синтеза Углерод напрямую взаим. с Н при очень выс. темп-х:
№4
Ароматическими соединениями обычно называют карбоциклические соединения, в молекулах которых имеется особая циклическая группировка из шести углеродных атомов – бензольное ядро. Простейшим веществом является углеводород бензол; все остальные ароматические соединения этого типа рассматривают как производные бензола.
Благодаря наличию в ароматических соединениях бензольного ядра они по некоторым свойствам значительно отличаются от предельных и непредельных алициклических соединений, а также и от соединений с открытой цепью. Отличительные свойства ароматических веществ, обусловленные наличием в них бензольного ядра, обычно называют ароматическими свойствами, а бензольное ядро – соответственно ароматическим ядром.
Физические свойства.
Бензол и его простейшие гомологи – бесцветные жидкости с характерными запахами, не смешивающиеся с водой. Некоторые высшие гомологи – твердые вещества. Температуры кипения и плавления ароматических углеводородов зависят от величины и изомерии боковых целей, а также от взаимного положения их в бензольном ядре.
Химические свойства
Бензол, несмотря на то, что по составу он является ненасыщенным соединением, проявляет склонность преимущественно к реакциям замещения, и бензольное ядро очень устойчиво. В этом заключаются свойства бензола, которые называют ароматическими свойствами. Последние характерны и для других ароматических соединений; однако различные заместители в бензольном ядре влияют на его устойчивость и реакционную способность; в свою очередь бензольное ядро оказывает влияние на реакционную способность соединенных с ним заместителей. Рассмотрим следующие группы реакций ароматических углеводородов : а) реакции замещения, б) реакции присоединения в) действие окислителей.
Номенклатура.
По международной номенклатуре (правила ИЮПАК) все ароматические углеводороды объединяют названием – арены. Соответственно, их одновалентные остатки, образованные отнятием водорода от углеродных атомов ядра (одновалентные ароматические радикалы), называют арилами и обозначают - Ar. Остаток бензола – С6Н5 называется фенилом.
Ароматичность — особое св-во некот. хим. соединений, благодаря которому сопряженное кольцо ненасыщ. связей прояв. аномально выс. стабильность; большую чем та, которую можно было бы ожидать только при одном сопряжении.
Стабильность циклич. систем. Валентный угол (угол между связями) в ненапряженном фрагменте С-С-С составляет 109°, и кольца, в которых сохраняется это значение, более стабильны, чем те, где углы сильно отклоняются от этого значения. Напряжение, возникающее в циклических системах в результате искажения валентных углов, носит название байеровского - по имени немецкого химика А. Байера, впервые предложившего такое объяснение устойчивости насыщенных колец. Так, в трехчленных кольцах, где валентный угол составляет всего 60°, кольца сильно напряжены и легко разрываются; некоторые из их реакций напоминают реакции двойной связи С=С. Четырехчленные кольца также напряжены (валентный угол 90°), но не столь сильно. Пятичленные кольца почти плоски и их углы равны 108°; поэтому они ненапряжены и стабильны. В таких шестичленных кольцах, как циклогексан, атомы углерода не лежат в одной плоскости; такие циклы являются складчатыми, что уменьшает напряжение кольца. Пяти- и шестичленные кольца являются наиболее обычными. Большие кольца также способны снижать угловое напряжение путем образования складок, но в некоторых из них (от семи- до двенадцатичленных) атомы водорода на противоположных сторонах кольца сближаются настолько, что их отталкивание делает соединение менее стабильным (прелоговское напряжение, по имени швейцарского химика В.Прелога, открывшего этот эффект).
Ориентации правила , в органической химии определяют порядок замещения в ароматическом кольце при наличии в нём заместителя (ориентанта). При электрофильном ароматическом замещении) ориентанты I рода (OH, OR, OCOR, SH, SR, NH2, NHR, NR2, алкилы, галогены) направляют замещение в орто- и пара-положения кольца, ориентанты II рода (SO3H, NO2, COOH, COOR, CN, CF3, , CHO) — в мета-положение; при наличии ориентантов менее ярко выраженной природы (NO, RCO, CHCl2, CH2NO2) наблюдается смешанная ориентация . Ориентирующий эффект обусловлен электронным влиянием заместителя на перераспределение электронной плотности в молекуле по системе простых (индуктивный I-эффект) и сопряжённых (мезомерный М-эффект) связей. Введение ориентантов I рода увеличивает электронную плотность бензольного кольца в целом, но особенно в орто- и пара- положениях, введение ориентантов II рода соответственно уменьшает.
№5
Применение
В хим. промыш. хлористый метил и хлористый этил применяются как алкилирующие средства, для наполнения манометрических термометров, в медицине - для кратковременного наркоза и для местной анастезии (обезболивания), как хладагент (в последнее время вытеснен менее токсичным и более экологически безвредными веществами), как интермедиат в производстве фармацевтических препаратов.
№8
Спирты- органические соединения, содержащие одну или более гидроксильных групп (гидроксил, −OH), непосредственно связанных с насыщенным (находящемся в состоянии sp³ гибридизации) атомом углерода. Спирты можно рассматривать как производные воды (H−O−H), в которых один атом водорода замещен на органическую функциональную группу: R−O−H.
Химические свойства спиртов
Все химические реакции спиртов можно разделить на три условных группы, связанные с определёнными реакционными центрами и химическими связями:
Разрыв связи O−H (реакционный центр — водород)
Разрыв или присоединение по связи С−OH (реакционный центр — кислород)
Разрыв связи −СOH (реакционный центр — углерод)
Образование алкоголятов
Спирты ведут себя как слабые кислоты, вступая в реакцию по связи O−H со щелочными и некоторыми другими металлами, и с сильными основаниями, например:
2 R−OH + 2 Na → 2 R−O−Na+ + H2↑
Применение:
В парфюмерно-косметической промышленности и производстве отдушек для бытовой химии и прочей потребительской продукции, в пищевой промышленности, широко используемых в кулинарии, спирты можно встретить среди самых разных пищевых добавок, многие спирты используются в фармацевтическом производстве.
Физ св-ва и строение.
Подобно воде, спирты имеют существенно более высокие температуры плавления и кипения, чем можно было бы предполагать на основании физических свойств родственных соединений.
Так, из ряда монозамещённых производных метана, метанол имеет необычно высокую температуру кипения, несмотря на относительно небольшую молекулярную массу
Этот феномен объясняется наличием в спиртах водородных связей
Энергия разрыва водородной связи значительно меньше, чем обычной химической связи, но тем не менее, она существенным образом влияет на физические свойства спиртов.
Следует отметить, что влияние гидроксильной группы особенно велико на соединения с небольшой углеводородной цепочкой. Так, например, метанол и этанол неограниченно смешиваются с водой и имеют довольно высокие плотности и температуры кипения для своей молекулярной массы, в то время как высшие спирты гидрофобны и мало отличаются по свойствам от соответствующих углеводородов
Осно́вные св-ва
Спирты могут также вести себя как слабые основания Льюиса, образовывая с сильными минеральными кислотами соли алкоксония, а также давая донорно-акцепторные комплексы с кислотами Льюиса.
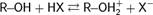
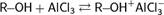
Обычно подобные реакции не останавливаются на указанной стадии и ведут к нуклеофильному замещению гидроксильной группы или отщеплению воды.
АЛКОГОЛЯТЫ, продукты замещения атома Н в молекуле спирта на металл (М).
Алкоголята одноатомных спиртов. Их общая ф-ла M(OR)n, где n-степень окисления металла. А. щелочных, щел.-зем. металлов, Т1(1) и первичных спиртов-ионные соед.; неплавки, нелетучи; т. разл. 200-300 °С; раств. в спиртах и жидком NH3; электролиты в растворе. Из спиртовых р-ров обычно выделяются в виде кристаллосольватов. Производные металлов III-VIII групп и спиртов (начиная с С2Н5ОН), а также M1OR-mpem- молекулярные мономерные или олигомерные соед.; имеют низкие температуры плавления и кипения; хорошо раств. в неполярных растворителях, плохо-в спиртах; растворы не проводят ток. Метилаты тех же элементов-обычно координац. полимеры; неплавки, нелетучи; не раств. ни в одном из растворителей. Большинство А. элементов середины периодич. системы сочетают свойства ионных и молекулярных соед. (см. табл.). Все А. очень гигроскопичны.
Ароматические спирты имеют в молекуле бензольное кольцо, отделенное от гидроксильной группы одним или несколькими насыщенными атомами углерода.
Если же гидроксильная группа присоединена непосредственно к бензольному кольцу (например, в такие соединения уже не являются спиртами). Они относятся к классу фенолов и существенно отличаются от спиртов по свойствам.
Фено́лы— органические соединения ароматического ряда, в молекулах которых гидроксильные группы связаны с атомами углерода ароматического кольца. По числу ОН-групп различают:
одноатомные фенолы (аренолы): фенол (C6H5OH) и его гомологи;
двухатомные фенолы (арендиолы): гидрохинон, пирокатехин, резорцин;
трёхатомные фенолы (арентриолы): пирогаллол, флороглюцин, гидроксигидрохинон и т.д.
Фенол является окончанием боковой группы стандартной аминокислоты тирозина, и поэтому входит в состав практически каждой белковой молекулы.
Химические свойства
1. Реакции с участием гидроксильной группы
Кислотные свойства
Диссоциация в водных растворах с образованием фенолят-ионов и ионов водорода;
Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов);
Взаимодействие с активными металлами с образованием фенолятов (образующиеся в результате реакций 2) и 3) феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов, следовательно, фенол — ещё более слабая кислота, чем угольная).
При взаимодействии фенолятов с галогенпроизводными образуются простые и сложные эфиры (реакция Фриделя — Крафтса).
[править]
2. Реакции с участием бензольного кольца
Реакции замещения
Галогенирование (взаимодействие с галогенами)
Нитрование (взаимодействие с азотной кислотой)
Сульфирование (взаимодействие с серной кислотой)
Реакции присоединения
Гидрирование (восстановление водородом до циклогексанола)
Качественные реакции на фенолы
В водных растворах одноатомные фенолы взаимодействуют с хлоридом железа (III) с образованием комплексных фенолятов, которые имеют фиолетовую окраску; окраска исчезает после прибавления синильной кислоты
Простые эфиры — органические вещества, имеющие формулу R-O-R1, где R и R1 — углеводородные радикалы. Следует однако учитывать, что такая группа может входить в состав других функциональных групп соединений, не являющихся простыми эфирами.
Физические свойства
Простые эфиры — подвижные легкокипящие жидкости, малорастворимые в воде, очень легко воспламеняющиеся. Проявляют слабоосновные свойства (присоединяют протон по атому O).
Способы получения по Вильямсону
в лабораторных условиях эфиры получают по Вильямсону взаимодействием галогенопроизводных, способных вступать в реакцию Sn2 и алкоксид- и феноксид-ионами. Реакция протекает гладко с галогенметаном и первичными галогеналканоми. В случае вторичных галогеналканов реакция может быть осложнена побочной реакцией элиминирования.
Феноляты, солеобразные продукты, получаемые замещением водорода гидроксильной группы фенолов металлами, например C6H5ONa – фенолят натрия.
Нафтолы — оксипроизводные нафтена (нафталина) C10H(8-n)(ОН)n, где n = 1, 2, 3 и более. По свойствам нафтолы близки к фенолам бензольного ряда. В больших количествах нафтолы и их производные применяют в производстве красителей и органических полупродуктов.
Физические свойства
Нафтолы представляют собой бесцветные кристаллические вещества со слабым фенольным запахом. Нафтолы хорошо растворимы в органических растворителях, таких как этанол, диэтиловый эфир, хлороформ, бензол[1]; плохо растворимы в холодной воде, несколько лучше растворяются в горячей воде.
Химические свойства
Нафтолы вступают в химические реакции подобно фенолам.Как и фенолы, они являются слабыми кислотами.
В реакциях с водными растворами щелочей они образуют нафтоляты, хорошо растворимые в воде.
Способы получения
Нафтолы в живых организмах
Этиловый эфир 2-нафтола (неролин, или бромелия) входит в состав неролиевого масла, получаемого из цветков померанца (Citrus aurantium var. amara и Citrus aurantium var. aurantium).
Применение нафтолов
В химической промышленности нафтолы используются как промежуточные продукты в синтезе различных азокрасителей. 2-Нафтол используют в качестве антисептика.
№9
Нитросоединения— органические соединения, содержащие одну или несколько нитрогрупп —NO2.
Нитрогруппа имеет строение 
Ароматические нитросоединения — желтоватые жидкости или кристаллические вещества, хорошо растворимые в органических растворителях, плохо — в воде; их синтезируют в промышленности и лабораторных условиях нитрованием ароматических соединений нитрующими смесями
Хим. св-ва
По химическому поведению нитросоединения обнаруживают определенное сходство с азотной кислотой. Это сходство проявляется при окислительно-восстановительных реакциях.
Восстановление нитросоединений (Реакция Зинина)
R-NO2 + 6H → R-NH2 + 2 H2O
Физ.св Нитрогруппа полярна это влияет на tкип и tплав,мало растворимы в воде,ядовиты
Применение. В качестве взрывчатых веществ и в меньшей степени как компоненты ракетных топлив. Как р-рители в лакокрасочной пром-сти и в произ-ве полимеров, в частности эфиров целлюлозы; для очистки минер. масел; депарафинизации нефти и др. В качестве биологически активных в-в. Так, эфиры фосфорной к-ты -важнейшие антибактериальные препараты, на их основе созданы лекарства, обладающие широким спектром действия (фуразолидин и др.).
Нитропарафины обладают сильным местным раздражающим действием и являются относительно токсичными в-вами. Относятся к клеточным ядам общего действия, особенно опасны для печени.
Важнейшие представители.
Тетранитрометан C(NO2)4, Нитробензол — токсичное органическое вещество, имеющее миндальный запах формула C6H5NO2. Тринитротолуо́л C7H5N3O6— одно из наиболее распространённых бризантных взрывчатых веществ. Представляет собой желтоватое кристаллическое вещество с температурой плавления 80,85 °C (плавится в очень горячей воде). Нитронафталины — органические соединения, нитропроизводные нафталина, с общей формулой C10H8-n(NO2)n.
Общие признаки.
Различают моно-, ди-, три- и полинитросоединения (поли-Н.). Н. могут быть алифатическими (нитропарафины и нитроолефины); ароматическими, содержащими нитрогруппы в ароматическом ядре, например нитроанилины, нитробензол, нитротолуолы, нитронафталины и др.; жирноароматическими — Н. с нитрогруппами только в боковой алифатической цепи, например фенилнитрометан С6Н5СН2NO2, нитростирол C6H5CH = CHNO2 и др., а также Н. с нитрогруппами в боковой цепи и ароматическом кольце, например n-нитрофенилнитрометан O2NC6H4CH2NO2.
№10
Ами́ны— орг. соед., являющиеся производными аммиака, в молекуле которого один, два или три атома Н замещены на УВ радикалы.
По числу замещённых атомов водорода различают соответственно первичные, (Замещен один атом водорода) вторичные (Замещены два атома водорода из трех) и третичные (Замещены три атома водорода из трех) амины. Четвертичное аммониевое соединение вида [R4N]+Cl- является органическим аналогом аммониевой соли.
По характеру органической группы, связанной с азотом, различают алифатические CH3-N<, ароматические C6H5-N< и жирно-алифатические (содержат ароматический и алифатический радикалы) амины.
По числу NH2-групп в молекуле амины делят на моноамины, диамины, триамины и так далее.
Номенклатура
К названию органических остатков, связанных с азотом, добавляют слово «амин», при этом группы упоминают в алфавитном порядке: CH3NC3H7 — метилпропиламин, CH3N(C6H5)2 — метилдифениламин. Для высших аминов название составляется, взяв за основу углеводород, прибавлением приставки «амино», «диамино», «триамино», указывая числовой индекс атома углерода.
Для некоторых аминов используются тривиальные названия: C6H5NH2 — анилин (систематическое название — фениламин).
Хим. св-ва
Амины, являясь производными аммиака, имеют сходное с ним строение и проявляют подобные ему свойства. Для них также характерно образование донорно-акцепторной связи. Азот предоставляет неподеленную электронную пару, исполняя роль донора. В качестве акцептора электоронов может выступать, например, протон Н+, образуя ион R3NH+. Возникшая ковалентная связь N-H полностью эквивалентна остальным связям N-H в амине.
Алкиламины являются сильными основаниями, ариламины менее основны.
Взаимодействие с водой. Водные растворы алифатических аминов проявляют щелочную реакцию, так как при их взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные гидроксиду аммония:
C2H5NH2 + H2O → [C2H5NH3]+OH-
CH3NH2 + H2O → [CH3NH3]+OH-
Взаимодействуя с кислотами, амины образуют алкиламмониевые соли, в большинстве случаев растворимые в воде. Например, амины присоединяют галогеноводороды:
RNH2 + HCl → [RNH3]+Cl−
C6H5NH2 + HCl → [C6H5NH3]+Cl−
Амины присоединяют галогеналканы RCl, с образованием донорно-акцепторной связи N-R, которая также эквивалентна уже имеющимся.
Амины реагируют с галогенами. При галогенировании анилина бромной водой комнатной температуре, образуется триброманилин (в виде осадка белого цвета):
C6H5NH2 + 3Br2 → C6H2NH2Br3 + 3HBr
Если нет реакционноспособных групп в радикале, то образуются N-галогенамины.
Первичные и вторичные амины взаимодействуют с азотистой кислотой различным образом. При помощи азотистой кислоты первичные, вторичные и третичные амины отличают друг от друга. Из первичных аминов образуются первичные спирты:
C2H5NH2 + HNO2 → C2H5OH + N2 +H2O
При этом выделяется газ (азот). Это признак того, что в колбе первичный амин.
Вторичные амины образуют с азотистой кислотой желтые, трудно растворимые нитрозамины — соединения, содержащие фрагмент >N-N=O:
(C2H5)2NH + HNO2 → (C2H5)2N-N=O + H2O
Вторичные амины сложно не узнать, по лаборатории распространяется характерный запах нитрозодиметиламина.
Третичные амины при обычной температуре в азотистой кислоте просто растворяются.
Получение
Восстановление нитросоединений — Реакция Зинина. Действуя на нитробензол сульфидом аммония, он получил анилин:
C6H5NO2 + 3(NH4)2S → C6H5NH2 + 6NH3 + 3S + 2H2O
Восстановление железом:
4C6H5NO2 + 9Fe + 4H2O → 4C6H5NH2 + 3Fe3O4
Восстановление водородом в присутствии катализатора и при высокой температуре:
C6H5NO2 + 3H2 → C6H5NH2 + 2H2O
Некоторые наиболее известные амины
Метиламин, CH3 —NH2
Диметиламин, CH3 —NH —CH3
Триметиламин, (CH3)3N
Диэтиламин
Триэтиламин
Пропиламин
Этилендиамин Анилин
Пропилендиамин
N-Метиланилин
N,N-Диметиланилин
N-Этиланилин
N,N-Диэтиланилин
Пиперидин
Вредное воздействие
Очень токсичные вещ-ва. Опасно как вдыхание их паров, так и контакт с кожей. Амины, например анилин, способны всасываться сквозь кожу в кровь и нарушать функции гемоглобина, что может привести к летальному исходу. В случае попадания амина на незащищенные участки кожи необходимо быстро и аккуратно, не увеличивая площадь поражения, очистить пораженный участок кожи ватой, смоченной в спирте. В случае отравления вывести пострадавшего на свежий воздух, обратиться к врачу.
№11
Карбонильные соединения–это соединения, содержащие в своем составе одну или несколько карбонильных групп (C=O).К ним относятся альдегиды и кетоны.
Кетоны–органические вещества, молекулы которых содержат карбонильную группу, соединенную с двумя углеводородными радикалами.
Альдегиды — класс органических соединений, содержащих карбонильную группу (С=О) с однималкильным или арильным заместителем.
Изомерия.
Для альдегидов характерна изомерия углеводородного радикала, который может иметь как нормальную (неразветвленную) цепь, так и разветвленную, а также межклассовая изомерия с кетонами.
Номенклатура:1)систематическая2)тривиальная
1) Систематические названия альдегидов строят по названию соответствующего углеводорода и добавлением суффикса -аль. Нумерацию цепи начинают с карбонильного атома углерода. Тривиальные названия производят от тривиальных названий тех кислот, в которые альдегиды превращаются при окислении.
2) Названия альдегидов по заместительной номенклатуре в соответствии с правилами ИЮПАК производят из названия соответствующего углеводорода с добавлением окончания -аль. Перед корнем названия записывают боковые заместители с указанием их положения их числа. Нумерация атомов углерода начинается с углеродного атома карбонильной группы.
Важнейшие реакции присоединения:
1. Присоединение водорода (восстановление). При взаимодействии альдегидов с водородом получаются первичные спирты:
Ni, t
R-CH=O + Н2 → R-CH2-OH.
Кетоны в аналогичной реакции дают вторичные спирты. В лабораторных условиях для восстановления карбонильных соединений используют алюмогидрид лития LiAlH4.
2. Присоединение циановодородной (синильной) кислоты:
KCN
СН3-СН=О + H-CN → СН3-СН(СN)-ОН.
3. Взаимодействие со спиртами. Альдегиды могут взаимодействовать с одной или двумя молекулами спирта, образуя соответственно полуацетали и ацетали.
Полуацеталями называют соединения, содержащие при одном атоме углерода гидроксильную и алкоксильную (OR) группы. Ацетали — это соединения, содержащие при одном атоме углерода две алкоксильные группы:
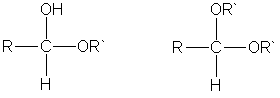
полуацеталь ацеталь
Реакцию получения ацеталей широко используют в органических синтезах для "защиты" активной альдегидной группы от нежелательных реакций:
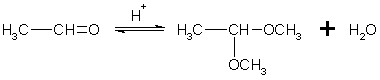
Особенно важное значение подобные реакции имеют в химии углеводов.
4. Присоединение гидросульфитов служит для выделения альдегидов из смесей с другими веществами и для получения их в чистом виде, поскольку полученное сульфопроизводное очень
легко гидролизуется:
R-CH=O + NaHSO3 → R-CH(OH)-SO3Na.
5. Присоединение реактива Гриньяра. В органическом синтезе чрезвычайно часто используется реактив Гриньяра — одно из простейших металлоорганических соединений.
При добавлении раствора галогеналкана в диэтиловом эфире к магниевой стружке легко происходит экзотермическая реакция, магний переходит в раствор и образуется реактив Гриньяра:
R-X + Mg → R-Mg-X ,
где R — алкильный или арильный радикал, X — галоген.
6. Присоединение воды. Альдегиды в водных растворах существуют в виде гидратных форм, образующихся в результате присоединения воды к карбонильной группе:
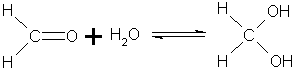
Гидратная форма
формальдегида
Реакции окисления. Альдегиды и кетоны по-разному относятся к действию окислителей. Альдегиды легко (значительно легче, чем спирты) окисляются в соответствующие карбоновые кислоты. Для их окисления можно использовать такие мягкие окислители, как оксид серебра и гидроксид меди (II).
Кетоны к действию окислителей инертны, в частности, они не окисляются кислородом воздуха. Кетоны реагируют только с очень сильными окислителями, способными разорвать связи С-С в их молекуле.
7. Реакция "серебряного зеркала" — это окисление альдегидов аммиачным раствором оксида серебра. В водном растворе аммиака оксид серебра образует комплексное соединение
[Аg(NН3)2]ОН, при действии которого на альдегид происходит окислительно-восстановительная реакция с образованием соли аммония:
R-CH=0 + 2[Ag(NH3)2]OH → RCOONH4+ 2Ag↓+ 3NH3 + H2O (2)
8. При окислении альдегидов гидроксидом меди (II) последний превращается в желтый гидроксид меди (I), который при нагревании разлагается с образованием оксида меди (I) красного цвета:
t
СН3-СН=О + 2Сu(ОН)2 → СН3-СООН + Cu2O↓ + 2Н2О.
Данная реакция и реакция серебряного зеркала являются качественными реакциями на альдегиды. Реакции поликонденсации
9. Для альдегидов характерны реакции поликонденсации.
Применение. Формальдегид используют для получения полимерных материалов (фенолформальдегидных смол). В водном растворе формальдегида (формалине) хранят анатомические препараты. Ацетальдегид применяют для получения различных соединений алифатического ряда — уксусной кислоты, уксусного ангидрида, этилового эфира уксусной кислоты и т.д. Ацетон используют как растворитель для лаков, красок и т.д.
Альдегиды физ св-ва. Физические свойства
Простейший альдегид – муравьиный – газ с весьма резким запахом. Другие низшие альдегиды – жидкости, хорошо растворимые в воде. Альдегиды обладают удушливым запахом, который при многократном разведении становится приятным, напоминая запах плодов. Альдегиды кипят при более низкой температуре, чем спирты с тем же числом углеродных атомов. Это c
