Способы выражения концентраций растворов
Количественной характеристикой состава растворов является концентрация. Под концентрацией понимают содержание растворенного вещества в определенной массе или в определенном объеме раствора или растворителя. Для выражения состава растворов чаще всего используются массовая доля растворенного вещества (w,%), молярная (молярность,См), моляльная (моляльность, Сm ), нормальная (нормальность, Сн) концентрации и титр (Т).
Массовая доля (ω) представляет собой отношение массы (г) растворенного вещества (mв-ва) к массе (г) всего раствора (mр-ра):
ω = 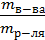 . (7.2)
. (7.2)
Это безразмерная величина, выражаемая в долях от единицы или в процентах: 
 ω,% =
ω,% = 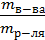 100%.
100%.
Массовая доля численно равна числу граммов вещества, растворенного в 100г раствора. Например, 3% Н2О2 означает, что в 100г раствора содержится 3г пероксида водорода (т.е. 100г раствора содержит 3г Н2О2 и 97г Н2О).
Молярность ( М или СМ )- число молей растворенного вещества в 1л раствора. Молярность рассчитывают по формуле
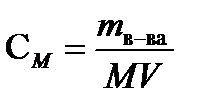 ,моль/л, (7.3)
,моль/л, (7.3)
где mв-ва – масса растворенного вещества ( г), М – молярная масса растворенного вещества ( г/моль), V- объем раствора (л).
Например, 0,1М H2SO4 (или CM = 0,1 моль/л) – в 1 литре раствора содержится 0,1 моль H2SO4. Учитывая, что МH2SO4= 98 г/моль, 0,1М раствор соответствует концентрации 9,8г/л.
Моляльность (m или Сm) – число молей растворенного вещества в 1000г растворителя. Моляльность рассчитывают по формуле
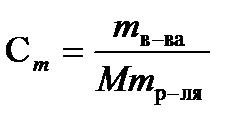 моль/кг, (7.4)
моль/кг, (7.4)
где mв-ва – масса растворенного вещества (г), М – молярная масса растворенного вещества (г/моль), mр-ля – масса растворителя (г).
Нормальность(н или Сн ) – число эквивалентов растворенного вещества в 1л раствора. Эквивалентом вещества называется такое его количество, которое в обменных химических реакциях обменивает один моль ионов Н+ или в окислительно-восстановительных реакциях переносит один моль электронов.
Нормальность рассчитывают по формуле
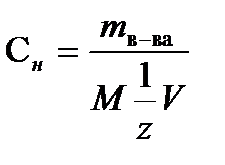 ,моль/л , (7.5)
,моль/л , (7.5)
где mв-ва – масса растворенного вещества (г), М – молярная масса растворенного вещества (г/моль), V- объем раствора (л), 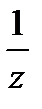 = fэкв – фактор эквивалентности, безразмерная величина.
= fэкв – фактор эквивалентности, безразмерная величина.
Чаще всего для приготовления растворов используются кислоты, щелочи и соли. Для кислоты z = числу ионов водорода в молекуле, для основания z = числу гидроксильных групп, для соли z = произведению числа атомов металла в молекуле (или ионов NH4+) на валентность металла в данном конкретном соединении (или на заряд иона).
Например, для H2SO4 - z = 2; H3PO4 - z =3 NaOH - z = 1; Ca(OH)2 – z = 2 AlCl3 – z = 3; Al2(SO4)3 – z = 2∙3=6; NH4Cl – z = 1.
Таким образом, 0,01н H2SO4 (или Cн=0,01 моль/л) – в 1 литре раствора содержится 0,01 моль эквивалента H2SO4.
Нормальная концентрация связана с молярной концентрацией соотношением 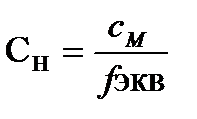 . (7.6)
. (7.6)
Титр Т – число граммов растворенного вещества в 1 мл раствора – рассчитывают по формуле
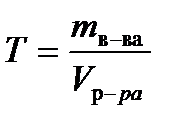 , г/мл, (7.7)
, г/мл, (7.7)
где mв-ва – масса растворенного вещества (г), Vр-ра – объем раствора (мл).
Мольная доля (Ni)- этоотношение числа молей данного компонента i к сумме молей всех компонентов, содержащихся в растворе:
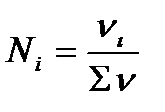 . (7.8)
. (7.8)
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Понятие электролит восходит к середине XIX века и было введено М.Фарадеем для обозначения веществ, растворы которые проводят электрический ток (электролит – «разлагаемый током»). Фарадей считал, что распад молекулярных веществ на заряженные частицы в растворе происходит лишь под действием внешнего электрического поля. Эти предположения оказались верны только для растворов очень слабых электролитов при громадной напряженности внешнего поля. Сильные электролиты распадаются на ионы в растворе без наложения электрических полей.
В настоящее время чаще используют обобщенное понятие электролитов. Это вещества или системы, обладающие ионным типом проводимости (проводники второго рода). Они бывают твердыми, жидкими и даже газообразными.
Свойства растворов, проводящих электрический ток, не подчиняются законам Рауля и Вант Гоффа. С целью формального учета этого отклонения Вант Гофф ввел в уравнение коэффициент, названный изотоническим коэффициентом i, причем для одного и того же раствора величина изотонического коэффициента
одинакова и для законов Рауля.
Эти наблюдения позволили сделать вывод о том, что количество частиц в растворе, проводящем ток, существенно больше, чем можно было ожидать, учитывая лишь число молекул растворенного вещества, то есть число частиц в растворах электролитов и неэлектролитов одной и той же молярности существенно различается.
Различия в свойствах растворов, проводящих и не проводящих электрический ток, впервые были объяснены в рамках теории, получившей название «теория электролитической диссоциации».
