Гидролиз солей в неживой и живой природе
Гидролиз солей имеет большое биологическое и практическое значение.
Начнём с того, что без гидролиза были бы невозможны химическое преобразование земной коры и геологические процессы. Действительно, земная кора содержит в своем составе огромное количество сульфидов. Эти соли плохо растворяются в воде, но, как известно, вода и камень точит. Поэтому взаимодействуя с водой на поверхности Земли, а также в её глубинах при повышенной температуре, сульфиды в ходе реакции гидролиза преобразуются в сероводород, который является одним из основных вулканических газов.
Кроме сульфидов горные породы содержат силикаты и карбонаты. Разложение водой солей кремния, например алюмосиликатов, с течением времени приводит к разрушению горной породы.
Самый, пожалуй, известный продукт гидролиза неорганических веществ (карбонатов) – это малахит – очень красивый поделочный камень зелёного цвета.
Одной из важных химических функций почвы является обмен катионов и анионов благодаря которому минеральные удобрения и микроэлементы становятся доступными для растений. Гидролиз солей может внести существенные коррективы в этот процесс. Например, при недостаточной кислотности почвы у растений появляется болезнь хлороз, вызывающая пожелтение или побеление листьев, отставание в росте и развитии. В таком случае в почву вносят удобрение сульфат аммония, которое способствует её подкислению, благодаря гидролизу по катиону.
Повышение кислотности заболоченных почв приводит к усилению гидролиза сульфидов и выделению Н2S ‑ крайне токсичного для растений и многих полезных микроорганизмов вещества.
В таких случаях проводят известкование почв, основанное на реакции:
CO32- + H-OH ⇄ НCO3- + ОН-.
Еще в древности в качестве моющего средства люди использовали золу. В золе содержится карбонат калия, который в воде гидролизуется по аниону, водный раствор приобретает мылкость за счёт образующихся при гидролизе ионов ОН‑.
В настоящее время в быту мы используем мыло, стиральные порошки и другие моющие средства. Основной компонент мыла ‑ это натриевые или калиевые соли высших карбоновых кислот: стеараты, пальмитаты, которые гидролизуются по аниону. В состав же стиральных порошков и других моющих средств специально вводят соли неорганических кислот (фосфаты, карбонаты), которые усиливают моющее действие за счёт повышения рH среды.
Полный гидролиз солей аммония, таких как карбонат и гидрокарбонат аммония приводит к образованию аммиака и угольной кислоты, которая тут же распадается на углекислый газ и воду. Именно за счёт образования газа эта реакция может быть использована в пищевой и кондитерской промышленности для придания тесту воздушности и пышности.
Реакцию гидролиза солей алюминия используют для очистки воды. По сути дела, соли алюминия ‑ это глины, проходя через которые, вода очищается благодаря тому, что частички грязи и вредных примесей обволакиваются продуктом гидролиза нерастворимым гидроксидом алюминия и оседают на дно.
Для очистки воды и уменьшения её жёсткости применяют некоторые гидролизующиеся соли: Na2CO3, Na3PO4 и др.
Одним из основных требований к инъекционным лекарственным формам является требование их стабильности. Под этим термином подразумевают способность сохранять физико-химические свойства и активность, предусмотренные требованиями фармакопеи или НТД в течение определённого срока хранения. Однако в процессе хранения возможно разложение действующих веществ, что вызывает необходимость их стабилизации.
Для повышения устойчивости лекарственных форм для инъекций используют стабилизацию физическими, химическими и комплексными методами. В частности, стабильность лекарств достигается при помощи стабилизаторов ‑ веществ, повышающих химическую устойчивость лекарств в инъекционных растворах. Применения стабилизаторов или особых условий приготовления требуют около 90% лекарственных веществ, поэтому изучение вопросов стабилизации инъекционных растворов является важной технологической задачей.
Одной из причин разложения лекарственных веществ является гидролитическое расщепление. Этот процесс приводит к снижению активности препарата, а в некоторых случаях и к появлению токсичных компонентов. Так, неактивные и даже ядовитые продукты образуются в процессе гидролиза дикаина, новокаинамида, новокаина, атропина сульфата, скополамина гидробромида и других веществ.
Для того, чтобы правильно выбрать стабилизатор, необходимо глубоко понимать суть происходящих процессов. Если препарат представляет собой соль, которая образована слабым основанием и сильной кислотой (атропина сульфат, скополамина гидробромид и др.) или сложный эфир (новокаин), то в качестве стабилизатора, подавляющего процесс гидролиза солей и омыления сложных эфиров, рекомендуется добавлять раствор хлороводорода (соляной кислоты), как правило, с С(HCl) = 0,1 моль/л.
В случае, когда препарат является производным сильного основания и слабой кислоты (кофеин-бензоат натрия, тиосульфат натрия, нитрит натрия и др.), гидролитические процессы, наоборот, в кислой среде усиливаются. Для подавления гидролиза необходимо создавать слабощелочную среду, что достигается путём добавления раствора гидроксида натрия или гидрокарбоната натрия. Так, для стабилизации 1 л 10 и 20% растворов кофеин-бензоата натрия ГФ Х издания рекомендует добавлять 4 мл раствора гидроксида натрия с C(NaOH) = 0,1 моль/л, а к 30% раствору тиосульфата натрия ‑ гидрокарбонат натрия из расчета 20 г на 1 литр.
Ситуационная задача №3
Для полоскания горла пациента требуется приготовить раствор со слабощелочной реакцией среды. Имеются растворы NaCl, NH4Cl, Na2CO3 и NaHCO3 с молярной концентрацией 0,05 моль/л. Выберите раствор для полосканий, если для H2CO3 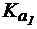 = 4×10-7;
= 4×10-7; 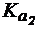 = 5×10-11, а
= 5×10-11, а 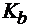 (NH3×Н2О) = 1,8×10-5.
(NH3×Н2О) = 1,8×10-5.
Решение.
Растворы хлоридов натрия и аммония для заданной цели не подходят, так как имеют нейтральную и слабокислую (гидролиз по катиону) среду соответственно.
Поставленной задаче могут соответствовать растворы карбоната и гидрокарбоната натрия, гидролизующихся по аниону.
Гидрокарбонат натрия гидролизуется в одну ступень:
NaHCO3 + H-OH ⇄ H2CO3 + NaОН
и pH можно рассчитать по формулам:
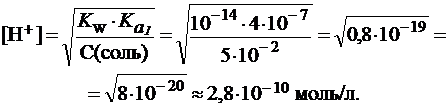
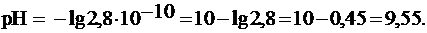
Среда раствора близка к слабощелочной (pH 7-9), поэтому данный раствор можно использовать.
Гидролиз карбоната натрия протекает ступенчато, однако второй ступенью можно пренебречь:
Na2CO3 + H-OH ⇄ NaHCO3 + NaОН
и рассчитывать pH по формулам:
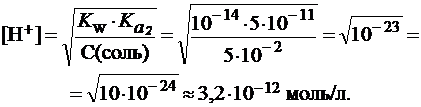
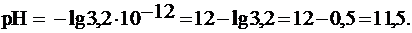
Среда раствора щелочная, ее pH приблизительно соответствует раствору KOH с C(KOH) » 0,01 моль/л. Такой раствор может вызвать щелочной ожог слизистой оболочки рта.
Примеры решения задач
Задача №1
Вычислить константу и степень гидролиза хлорида аммония в растворе с С(NH4Cl) = 0,1 моль/л и рН этого раствора, если 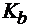 (NH3×Н2О) = 1,8×10-5.
(NH3×Н2О) = 1,8×10-5.
Решение.
Для солей, гидролизующихся по катиону:
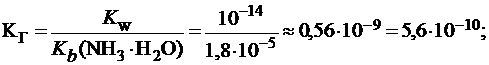
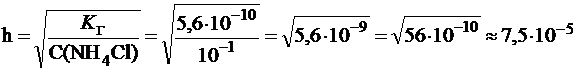 ;
;
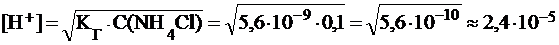 ;
;
pH = ‑lg 2,4∙10-5 » 4,63.
Задача №2
Рассчитать константу и степень гидролиза цианида аммония с молярной концентрацией 0,002 моль/л и рН этого раствора, если  (HCN) = 8×10–10,
(HCN) = 8×10–10, 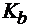 (NH3×Н2О) = 1,8×10–5. Указать характер среды.
(NH3×Н2О) = 1,8×10–5. Указать характер среды.
Решение.
Для солей, гидролизующихся по катиону и по аниону:
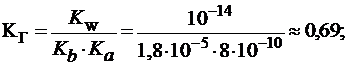
Степень гидролиза таких солей практически не зависит от концентрации раствора и определяется соотношением (25):
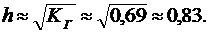
pH раствора определим из уравнения (28):
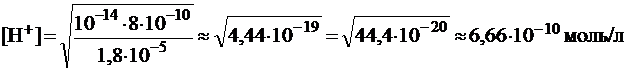 .
.
pH = -lg6,66·10-10 = 10 - lg6,66 = 10 - 0,82 = 9,18.
7 < pH » 9, следовательно среду раствора можно охарактеризовать как слабощелочную.
Задача №3
Найти массу ацетата натрия в 500 мл раствора с pH 9, если 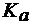 (СН3СООН) = 1,8×10-5.
(СН3СООН) = 1,8×10-5.
Решение.
[H+] = 10-pH = 10-9 моль/л.
Из уравнения (27) найдем концентрацию соли в растворе:
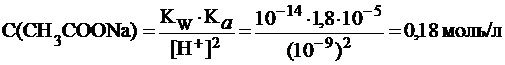 .
.
Отсюда:
m(CH3COOH) = C·M·V = 0,18 моль/л·60 г/моль·0,5 л = 5,4 г.
Задача №4
Известно, что лекарственный препарат представляет собой натриевую соль слабой одноосновной кислоты. Раствор с молярной концентрацией препарата 0,1 моль/л имеет pH 8,5. Найти константу диссоциации кислоты.
Решение.
Константу диссоциации кислоты найдем из уравнения (27):
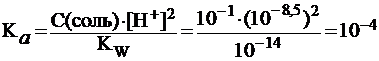 .
.
Задача №5
Сравнить степень гидролиза нитрита натрия в растворах соли с концентрациями 0,1 и 0,001 моль/л, если  (HNO2) = 4×10-4.
(HNO2) = 4×10-4.
Решение.
Введем обозначения: С1 = 0,1 моль/л; С2 = 0,001 моль/л.
Тогда: 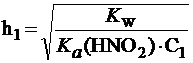 ;
; 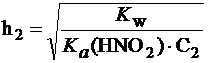 .
.
Разделим одно выражение на другое и получим:
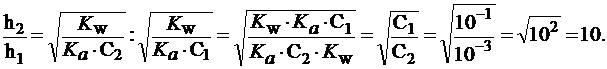
Задача №6
Вычислить константу и степень гидролиза карбоната натрия по первой и по второй ступени в растворе с С(Na2CO3) = 0,01 моль/л, если для H2CO3 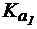 = 4×10-7;
= 4×10-7; 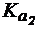 = 5×10-11.
= 5×10-11.
Решение.
Гидролиз Na2CO3 протекает ступенчато:
Na2CO3 + H-OH ⇄ NaHCO3 + NaОН (1 ступень)
В сокращенном виде уравнение выглядит так:
|
|
NaHCO3 + H-OH ⇄ H2CO3 + NaОН (2 ступень)
|
|
Гидролиз Na2CO3 по первой ступени приводит к образованию гидрокарбонат-иона HCO3-, который является слабым электролитом:
HCO3- ⇄ H+ + СО32-
Данное уравнение соответствует диссоциации H2CO3 по второй ступени и характеризуется константой 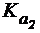 (H2CO3) = 5×10-11.
(H2CO3) = 5×10-11.
Поэтому:
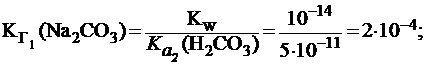
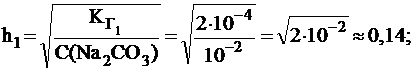
Гидролиз соли по второй ступени приводит к образованию H2CO3, поэтому:
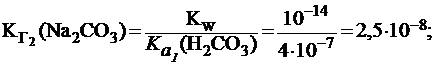
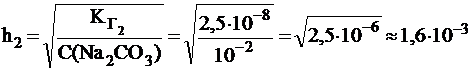 .
.
Вопросы для самоконтроля
1. Какой процесс называется гидролизом соли?
2. Какова причина изменения рН раствора за счёт гидролиза?
2. Какие типы солей подвергаются гидролизу в растворе? Приведите примеры.
3. Почему соли NaCl, KI, СаС12, CuS не подвергаются гидролизу?
4. В каких случаях при гидролизе солей образуются кислые (основные) соли? Приведите примеры.
5. В каких случаях происходит необратимый гидролиз соли? Приведите примеры.
6. Какие продукты образуются при взаимодействии водных растворов хлорида хрома (III) и сульфида аммония (NH4)2S?
7. Что называется константой гидролиза? От каких факторов зависит и от каких не зависит константа гидролиза?
8. Что называется степенью гидролиза? Как она связана с константой гидролиза различных типов солей?
9. Какие факторы влияют на величину степени гидролиза соли?
10. Почему степень гидролиза увеличивается при повышении температуры?
11. Для каких солей разбавление раствора практически не влияет на степень гидролиза?
12. Каким способом можно гидролизовать FeCl3 до образования Fe(OH)3?
13. При гидролизе каких солей рН раствора близок к 7?
14. Почему раствор NaHCO3 имеет слабощелочную реакцию, а раствор NaHSO3 - слабокислую? 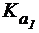 (H2CO3) = 4×10-7,
(H2CO3) = 4×10-7, 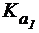 (H2SO3) = 1,7×10-2.
(H2SO3) = 1,7×10-2.
15. Необходимо приготовить раствор соли FeSO4, при гидролизе которой образуется малорастворимое соединение (раствор мутнеет). В какой среде (кислой или щелочной) следует готовить раствор, чтобы избежать его помутнения? Почему?
16. Как скажется на степени гидролиза добавление небольшого количества щёлочи к растворам солей: ацетата натрия, карбоната калия, нитрата цинка?
17. Как скажется на степени гидролиза добавление небольшого количества кислоты к растворам солей: фосфата калия, хлорида хрома (Ш), сульфата алюминия?
18. Какую окраску приобретёт раствор карбоната натрия при добавлении к нему фенолфталеина?
19. Какую окраску приобретёт раствор хлорида алюминия при добавлении к нему метилоранжа?
20. Появится ли окраска раствора ацетата аммония при добавлении к нему фенолфталеина?
Варианты задач для самостоятельного решения
Вариант №1
1. Определить реакцию среды водных растворов перечисленных солей: Na2SO4, FeCl2, Na2S и написать уравнения гидролиза, если он происходит (в молекулярном и ионном виде).
2. Рассчитать константу и степень гидролиза нитрата аммония в растворе с С(NH4NO3) = 0,001 моль/л, если 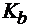 (NH3×Н2О) = 1,8×10-5.
(NH3×Н2О) = 1,8×10-5.
3. Вычислить значение pH раствора ацетата калия с C(СН3СООK) = 0,005 моль/л, если  (СН3СООН) = 1,8×10-5.
(СН3СООН) = 1,8×10-5.
4. Сравнить степень гидролиза карбоната натрия по первой и второй ступеням в растворе с С(Na2CO3) = 0,1 моль/л, если для H2CO3 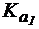 = 4×10-7;
= 4×10-7; 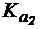 = 5×10-11.
= 5×10-11.
Вариант №2
1. Определить реакцию среды водных растворов перечисленных солей: MnSO4, KI, Na2SiO3 и написать уравнения гидролиза, если он происходит (в молекулярном и ионном виде).
2. Рассчитать константу и степень гидролиза цианида натрия в растворе с С(NaCN) = 0,01 моль/л, если  (HCN) = 8×10-10.
(HCN) = 8×10-10.
3. Вычислить значение рН раствора нитрита натрия с C(NaNO2) = 0,01 моль/л, если  (HNO2) = 4×10-4.
(HNO2) = 4×10-4.
4. Сравнить величины констант гидролиза Pb(NO3)2 по первой и по второй ступени, если для Pb(OH)2 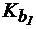 = 9,6×10-4;
= 9,6×10-4; 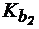 = 3×10-8.
= 3×10-8.
Вариант №3
1. Определить реакцию среды водных растворов перечисленных солей: Ca(NO3)2, Na2SO3, Cu(NO3)2 и написать уравнения гидролиза, если он происходит (в молекулярном и ионном виде).
2. Вычислить константу и степень гидролиза гипохлорита калия в растворе с C(KClO) = 0,1 моль/л, если  (НClO) = 5,6×10-8.
(НClO) = 5,6×10-8.
3. Вычислить значение рН раствора цианида калия с C(KCN) = 0,05 моль/л, если  (HCN) = 8×10-10.
(HCN) = 8×10-10.
4. Сравнить степень гидролиза фосфата натрия по первой, второй и третьей ступеням в растворе с С(Na3PO4) = 0,1 моль/л, если для H3PO4 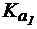 = 7,6×10-3;
= 7,6×10-3; 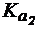 = 5,9×10-8,
= 5,9×10-8, 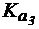 = 3,3×10-13.
= 3,3×10-13.
Вариант №4
1. Определить реакцию среды водных растворов перечисленных солей: K3PO4, CaCl2, ZnCl2 и написать уравнения гидролиза, если он происходит (в молекулярном и ионном виде).
2. Сравнить степень гидролиза NaCN в растворах с молярной концентрацией соли 0,1 и 0,001 моль/л, если  (HCN) = 8×10-10.
(HCN) = 8×10-10.
3. Вычислить значение рН раствора нитрата аммония с C(NH4NO3) = 0,1 моль/л, если 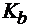 (NH3×Н2О) = 1,8×10-5.
(NH3×Н2О) = 1,8×10-5.
4. Сравнить степень гидролиза KHCO3 в растворах с с молярной концентрацией соли 0,01 и 0,1 моль/л, если для H2CO3 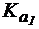 = 4×10-7;
= 4×10-7; 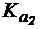 = 5×10-11.
= 5×10-11.
Вариант №5
1. Определить реакцию среды водных растворов перечисленных солей: CuSO4, Li2S, NaBr и написать уравнения гидролиза, если он происходит (в молекулярном и ионном виде).
2. Рассчитать константу и степень гидролиза нитрита натрия в растворе с С(NaNO2) = 0,01 моль/л, если  (HNO2) = 4×10-4.
(HNO2) = 4×10-4.
3. Вычислить значение рН раствора NH4I с концентрацией соли 0,02 моль/л, если 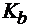 (NH3×Н2О) = 1,8×10-5.
(NH3×Н2О) = 1,8×10-5.
4. Сравнить величины констант гидролиза Na2SiO3 по первой и по второй ступени, если для H2SiO3 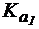 = 1,3×10-10;
= 1,3×10-10; 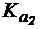 = 2×10-12.
= 2×10-12.
Вариант №6
1. Определить реакцию среды водных растворов перечисленных солей: SrCl2, Fe(NO3)3, K2S и написать уравнения гидролиза, если он происходит (в молекулярном и ионном виде).
2. Сравнить величины степени гидролиза NaF в растворах с молярной концентрацией эквивалента соли 0,2 и 0,002 моль/л.  (HF) = 6,6×10-4.
(HF) = 6,6×10-4.
3. Вычислить значение pH раствора НСООNa с молярной концентрацией соли 0,05 моль/л, если  (НСООН) = 2,2×10-4.
(НСООН) = 2,2×10-4.
4. Сравнить степень гидролиза солей NaHS и NH4HS в растворах с молярной концентрацией 0,05 моль/л, если для H2S 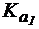 = 1×10-7;
= 1×10-7; 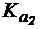 = 1×10-13, а
= 1×10-13, а 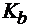 (NH3∙H2O) = 1,8∙10-5.
(NH3∙H2O) = 1,8∙10-5.
Вариант №7
1. Определить реакцию среды водных растворов перечисленных солей: NaNO3, ZnSO4, Ca(OCl)2 и написать уравнения гидролиза, если он происходит (в молекулярном и ионном виде).
2. Рассчитать константу гидролиза и степень гидролиза нитрита аммония в растворе с С(NH4NO2) = 0,05 моль/л, если  (HNO2) = 4×10-4,
(HNO2) = 4×10-4, 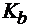 (NH3×Н2О) = 1,8×10-5.
(NH3×Н2О) = 1,8×10-5.
3. Вычислить значение рН раствора C6H5COONa с концентрацией соли 0,01 моль/л, если  (C6H5COOH) = 6,3×10-5.
(C6H5COOH) = 6,3×10-5.
4. Сравнить степень гидролиза по первой ступени солей Na3PO4 и (NН4)3PO4 в растворах с молярной концентрацией 0,1 моль/л, если для H3PO4 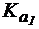 = 7,6×10-3;
= 7,6×10-3; 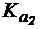 = 5,9×10-8,
= 5,9×10-8, 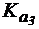 = 3,3×10-13, а
= 3,3×10-13, а 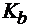 (NH3∙H2O) = 1,8∙10-5.
(NH3∙H2O) = 1,8∙10-5.
Вариант №8
1. Определить реакцию среды водных растворов перечисленных солей: Pb(NO3)2, CaS, KC1 и написать уравнения гидролиза, если он происходит (в молекулярном и ионном виде).
2. Сравнить величины констант и степеней гидролиза солей NaF и NaCN в растворах с одинаковыми концентрациями, если  (HF) = 6,6×10-4;
(HF) = 6,6×10-4;  (HCN) = 8×10-10.
(HCN) = 8×10-10.
3. Вычислить значение рН раствора CH3COONH4 с молярной концентрацией соли 0,05 моль/л, если  (CH3COOH) = 1,8×10-5;
(CH3COOH) = 1,8×10-5; 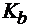 (NH3×H2O) = 1,8×10-5.
(NH3×H2O) = 1,8×10-5.
4. Рассчитать константу и степень гидролиза Na2C2O4 по первой ступени в растворе с концентрацией соли 0,05 моль/л, если для Н2C2O4 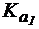 = 5,9×10-2,
= 5,9×10-2, 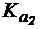 = 6,4×10-5.
= 6,4×10-5.
Вариант №9
1. Определить реакцию среды водных растворов перечисленных солей: Ba(NO3)2, NiCl2, K2SO3 и написать уравнения гидролиза, если он происходит (в молекулярном и ионном виде).
2. Pассчитать константу гидролиза и степень гидролиза ацетата аммония в растворе с С(CH3COONH4) = 0,002 моль/л, если  (CH3COOH) = 1,8×10-5;
(CH3COOH) = 1,8×10-5; 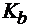 (NH3×H2O) = 1,8×10-5.
(NH3×H2O) = 1,8×10-5.
3. Сравнить значения рН растворов соли KF с концентрациями 0,001 моль/л и 0,1 моль/л, если  (HF) = 6,6×10-4.
(HF) = 6,6×10-4.
4. Рассчитать константу и степень гидролиза тартрата натрия по первой ступени в растворе с концентрацией соли 0,05 моль/л, если винная кислота является двухосновной и имеет 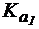 = 9,1×10-4,
= 9,1×10-4, 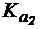 = 4,3×10-5.
= 4,3×10-5.
Вариант №10
1. Определить реакцию среды водных растворов перечисленных солей: CoSO4, Na2C2O4, Sr(NO3)2 и написать уравнения гидролиза, если он происходит (в молекулярном и ионном виде).
2. Сравнить величины констант и степеней гидролиза NH4F в растворах с концентрациями 0,02 моль/л и 0,002 моль/л, если  (HF) = 6,6×10-4,
(HF) = 6,6×10-4, 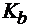 (NH3×H2O) = 1,8×10-5.
(NH3×H2O) = 1,8×10-5.
3. Вычислить значение рН раствора NH4CN с концентрацией 0,01 моль/л, если  (HCN) = 8×10-10,
(HCN) = 8×10-10, 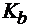 (NH3×Н2О) = 1,8×10-5.
(NH3×Н2О) = 1,8×10-5.
4. Рассчитать константу и степень гидролиза сукцината натрия по первой ступени в растворе с концентрацией соли 0,05 моль/л, если янтарная кислота является двухосновной и имеет 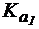 = 1,6×10-5,
= 1,6×10-5, 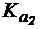 = 2,3×10-6.
= 2,3×10-6.
Вариант №11
1. Определить реакцию среды водных растворов перечисленных солей: BaS, K2SO4, CrCl3 и написать уравнения гидролиза, если он происходит (в молекулярном и ионном виде).
2. Вычислить константу и степень гидролиза HCOONa в растворе с молярной концентрацией соли 0,001 моль/л, если  (HCOOH) = 2,2×10-4.
(HCOOH) = 2,2×10-4.
3. Вычислить значение рН раствора NH4F с концентрацией 0,02 моль/л, если 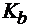 (NH3×Н2О) = 1,8×10-5,
(NH3×Н2О) = 1,8×10-5,  (HF) = 6,6×10-4.
(HF) = 6,6×10-4.
4. Сравнить величины констант гидролиза Na2S по первой и по второй ступени, если 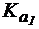 (H2S) = 1×10-7;
(H2S) = 1×10-7; 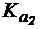 (H2S) = 1×10-13.
(H2S) = 1×10-13.
Вариант №12
1. Определить реакцию среды водных растворов перечисленных солей: Ni(NO3)2, K2CO3, ВаС12 и написать уравнения гидролиза, если он происходит (в молекулярном и ионном виде).
2. Сравнить величины констант и степеней гидролиза NH4NO3 в растворах с концентрациями соли 0,02 и 0,002 моль/л, если 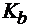 (NH3×H2O) = 1,8×10-5.
(NH3×H2O) = 1,8×10-5.
3. Вычислить значение рН раствора KClO с концентрацией соли 0,04 моль/л, если  (HClO) = 5,6×10-8.
(HClO) = 5,6×10-8.
4. Рассчитать рН раствора гидрофосфата аммония с С((NН4)2HPO4) = 0,1 моль/л, если для H3PO4 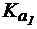 = 7,6×10-3;
= 7,6×10-3;
= 5,9×10-8, 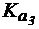 = 3,3×10-13, а
= 3,3×10-13, а 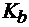 (NH3∙H2O) = 1,8∙10-5.
(NH3∙H2O) = 1,8∙10-5.
Вариант №13
1. Определить реакцию среды водных растворов перечисленных солей: NaI, K2SiO3, Fe2(SO4)3 и написать уравнения гидролиза, если он происходит (в молекулярном и ионном виде).
2. Вычислить константу и степень гидролиза C2H5COONa в растворе с С(C2H5COONa) = 0,l моль/л, если  (C2H5COOH) = 1,3×10-5.
(C2H5COOH) = 1,3×10-5.
3. Вычислить значение рН раствора NaHCO3, если степень гидролиза соли в нем составляет 1%. 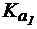 (Н2СО3) = 4×10-7,
(Н2СО3) = 4×10-7, 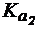 (H2CO3) = 5×10-11.
(H2CO3) = 5×10-11.
4. Сравнить степень гидролиза о-фталата натрия по первой и второй ступеням в растворе с концентрацией соли 0,05 моль/л, если
о-фталевая кислота является двухосновной и имеет 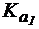 = 10-3,
= 10-3, 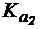 = 6×10-6.
= 6×10-6.
Вариант №14
1. Определить реакцию среды водных растворов перечисленных солей: Na2HPO4, KNO3, Bi(NO3)3 и написать уравнения гидролиза, если он происходит (в молекулярном и ионном виде).
2. Вычислить степень гидролиза NH4F в растворе с С(NH4F) = 0,02 моль/л, если  (HF) = 6,6×10-4,
(HF) = 6,6×10-4, 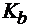 (NH3×H2O) = 1,8×10-5.
(NH3×H2O) = 1,8×10-5.
3. Рассчитать значение рН раствора Na2C2O4 с С(Na2C2O4) = 0,01 моль/л, если 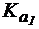 (Н2C2O4) = 5,9×10-2,
(Н2C2O4) = 5,9×10-2, 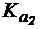 (Н2C2O4) = 6,4×10-5.
(Н2C2O4) = 6,4×10-5.
4. Рассчитать константу диссоциации кислоты, в растворе натриевой соли которой степень гидролиза составляет 0,0112%, а рН 8,75.
Вариант №15
1. Определить реакцию среды водных растворов перечисленных солей: NaClO4, Na2SeO3, FeCl3 и написать уравнения гидролиза, если он происходит (в молекулярном и ионном виде).
2. Вычислить константу и степень гидролиза лактата натрия в растворе с С(CH3CH(OH)COONa) = 0,02 моль/л, если  (CH3CH(OH)COOH) = 1,4×10-4.
(CH3CH(OH)COOH) = 1,4×10-4.
3. Вычислить значение рН раствора Na2CO3 при степени гидролиза 4,6%, если 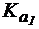 (Н2СО3) = 4×10-7,
(Н2СО3) = 4×10-7, 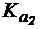 (Н2СО3) = 4,7×10-11.
(Н2СО3) = 4,7×10-11.
4. Сравнить величины констант гидролиза ZnCl2 по первой и по второй ступеням, если для Zn(OH)2 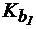 = 4×10-5;
= 4×10-5; 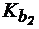 = 1,5×10-9.
= 1,5×10-9.
Вариант №16
1. Определить реакцию среды водных растворов перечисленных солей: NiSO4, Li2SO3, LiCl и написать уравнения гидролиза, если он происходит (в молекулярном и ионном виде).
2. Сравнить величины констант и степеней гидролиза солей KNO2 и KCN в растворах с одинаковыми концентрациями, если  (HCN) = 8×10-10,
(HCN) = 8×10-10,  (HNO2) = 4×10-4.
(HNO2) = 4×10-4.
3. Вычислить значение рН раствора NH4NO2 с концентрацией соли 0,05 моль/л, если  (HNO2) = 4×10-4,
(HNO2) = 4×10-4, 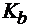 (NH3×H2O) = 1,8×10-5.
(NH3×H2O) = 1,8×10-5.
4. Рассчитать степень гидролиза селенита натрия по первой ступени в растворе с рН с C(Na2SeO3) = 0,02 моль/л, если для H2SeO3 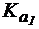 = 3,5×10-3,
= 3,5×10-3, 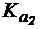 = 5×10-8.
= 5×10-8.
Вариант №17
1. Определить реакцию среды водных растворов перечисленных солей: Na2Te, MnCl2, KBr и написать уравнения гидролиза, если он происходит (в молекулярном и ионном виде).
2. Рассчитать константу и степень гидролиза C6H5COONa в растворе с С(C6H5COONa) = 0,002 моль/л, если  (C6H5COOH) = 6,3×10-5.
(C6H5COOH) = 6,3×10-5.
3. Вычислить значение рН раствора KBrO с концентрацией соли 0,05 моль/л, если  (HBrO) = 2×10-8.
(HBrO) = 2×10-8.
4. Рассчитать константу и степень гидролиза селенида натрия в растворе с рН 10,15, если для H2Se 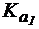 = 1,4×10-4,
= 1,4×10-4, 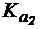 = 5×10-11.
= 5×10-11.
Вариант №18
1. Определить реакцию среды водных растворов перечисленных солей: Ca(CH3COO)2, Sb(NO3)3, BaBr2 и написать уравнения гидролиза, если он происходит (в молекулярном и ионном виде).
2. Вычислить константу и степень гидролиза NH4Br в растворе с С(NH4Br) = 0,05 моль/л, если 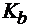 (NH3×Н2О) = 1,8×10-5.
(NH3×Н2О) = 1,8×10-5.
3. Сравнить значения рН растворов KF и KCN с одинаковыми концентрациями, если  (HF) = 6,6×10-4,
(HF) = 6,6×10-4,  (HCN) = 8×10-10.
(HCN) = 8×10-10.
4. Рассчитать рН раствора цитрата натрия по первой ступени в растворе с концентрацией соли 0,05 моль/л, если лимонная кислота является трехосновной и имеет 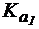 = 1,2×10-3,
= 1,2×10-3, 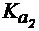 = 7,3×10-5,
= 7,3×10-5, 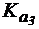 = 1,6×10-6.
= 1,6×10-6.
Вариант №19
1. Определить реакцию среды водных растворов перечисленных солей: Na2Se, Sn(NO3)2, Li2SO4 и написать уравнения гидролиза, если он происходит (в молекулярном и ионном виде).
2. Вычислить степень гидролиза цианида аммония в растворе с C(NH4CN) = 0,02 моль/л, если  (HCN) = 8×10-10,
(HCN) = 8×10-10, 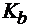 (NH3×H2O) = 1,8×10-5.
(NH3×H2O) = 1,8×10-5.
3. Вычислить значение рН раствора (NН4)2НPO4 с концентрацией соли 0,1 моль/л, если для H3PO4 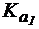 = 7,6×10-3;
= 7,6×10-3; 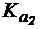 = 5,9×10-8,
= 5,9×10-8, 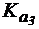 = 3,3×10-13, а
= 3,3×10-13, а 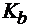 (NH3×H2O) = 1,8∙10-5.
(NH3×H2O) = 1,8∙10-5.
4. Сравнить степень гидролиза цитрата натрия по первой и второй ступеням в растворе с концентрацией соли 0,2 моль/л, если лимонная кислота является трехосновной и имеет 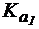 = 1,2×10-3,
= 1,2×10-3, 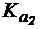 = 7,3×10-5,
= 7,3×10-5, 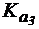 = 1,6×10-6.
= 1,6×10-6.
Вариант №20
1. Определить реакцию среды водных растворов перечисленных солей: K2C2O4, Al2(SO4)3, LiNO3 и написать уравнения гидролиза, если он происходит (в молекулярном и ионном виде).
2. Сравнить величины констант и степеней гидролиза солей KF и CH3COOK в растворах с одинаковыми концентрациями, если  (HF) = 6,6×10-4,
(HF) = 6,6×10-4,  (CH3COOH) = 1,8×10-5.
(CH3COOH) = 1,8×10-5.
3. Вычислить значение рН раствора Na2HPO4 с концентрацией соли 0,01 моль/л, если для H3PO4 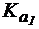 = 7,6×10-3;
= 7,6×10-3; 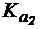 = 5,9×10-8,
= 5,9×10-8, 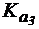 = 3,3×10-13.
= 3,3×10-13.
4. Вычислить рН раствора адипината натрия со степенью гидролиза 1%, если адипиновая кислота является двухосновной и имеет 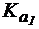 = 3,9×10-5;
= 3,9×10-5; 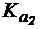 = 3,9×10-6.
= 3,9×10-6.
[1] Теория Аррениуса часто критиковалась современниками. В числе противников был и великий русский учёный Дмитрий Иванович Менделеев, создатель физико-химической теории растворов. Менделеев резко критиковал не только саму идею Аррениуса о диссоциации, но и чисто «физический» подход к пониманию природы растворов, не учитывающий химических взаимодействий между растворённым веществом и растворителем (гидратации в случае воды, или сольватации в общем случае). Теория Аррениуса давала сбои в случае концентрированных растворов электролитов, так как не учитывала межионные (электростатические) взаимодействия. Впоследствии И. А. Каблуков, В. А. Кистяковский, Г. Льюис, П. Дебай и Э. Хюккель объединили взгляды Менделеева и Аррениуса и ввели поправки в теорию диссоциации, учитывающие факторы меж-ионного взаимодействия.
[2] В дальнейшем будем называть их средними
[3] В случае многоосновных кислот (многокислотных оснований) сравнительную силу электролита оценивают по первой ступени диссоциации
[4] Интересной научной проблемой является функциональная асимметрия в организме человека и участие в ней ионов водорода. Так, у человека обнаружены небольшие, но достоверные, различия в величине внутриклеточного pH в лобных долях головного мозга: слева pH 7,05; справа pH 7,04.
